理化学研究所(理研)生命機能科学研究センター細胞構造生物学研究チームの八木宏昌研究員、葛西卓磨研究員、木川隆則チームリーダーらの共同研究チームは、グルコースからアデノシン三リン酸(ATP)[1]を合成する解糖系[2]酵素の一つであるホスホグリセリン酸キナーゼ(PGK)[3]が、細胞内ATP濃度に応じてブドウ糖(グルコース)代謝量(解糖流量)を制御していることを発見しました。
本研究成果は、酵素による代謝制御の新たな仕組みを明らかにするとともに、解糖系が亢進するがん細胞の増殖を抑制する新たな抗がん剤治療の開発や、代謝異常が関わる生活習慣病の改善につながると期待できます。
解糖系は連続した酵素反応からなる代謝経路で、生物が呼吸を通じてATPを合成し、エネルギーを獲得する重要な役割を担っています。解糖系は、酸素欠乏の環境下やがん化した細胞で特に活発に働くことが知られていますが、細胞内外の環境変化がどのような仕組みで解糖流量の変化につながるかはよく分かっていませんでした。
今回、共同研究チームは、ATP合成が準平衡状態[4]にある反応を担う酵素PGKに着目しました。核磁気共鳴(NMR)法[5]を用いて生理的な条件でのPGKの反応制御機構を解析した結果、PGKは細胞内のATPの濃度を感知しながら、基質である3-ホスホグリセリン酸(3PG)との結合親和性[6]を変化させることで、ATPの合成を巧みに調節していることを明らかにしました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』オンライン版(12月10日付)に掲載されました。
背景
生物は食事などによって得た栄養源を代謝によって分解し、生命活動に必要なさまざまな物質をつくり出しています。食事で得られる最も基本的なエネルギー源のブドウ糖(グルコース)は、「解糖系」という10ステップの酵素反応が連なる代謝経路でピルビン酸に分解され、その過程で高エネルギー通貨とも呼ばれるアデノシン三リン酸(ATP)が合成されます(図1左上)。ピルビン酸はさらに、ミトコンドリア内にある「クエン酸回路[7]」に運ばれ、酸素呼吸によるATP合成に使われます。
一方、細胞が酸素を利用できない条件では、ピルビン酸はミトコンドリアには運ばれず、細胞質内で乳酸に代謝されます。この場合、酸素呼吸によるATP合成ができないため、代わりに解糖系が活発に働き、細胞のATP合成の多くを解糖系が賄うことになります。またがん細胞では、酸素があるにもかかわらず解糖系に偏ったエネルギー代謝が行われ、解糖系から多くのATPが合成されます。この現象を「ワールブルグ効果[8]」と呼びます。
このように私たちの細胞は、細胞内外の状態変化によって解糖系の活性状態を変化させ、グルコース代謝量(解糖流量)をコントロールしています。解糖系の活性状態はこれまで、一連の酵素反応のうち反応が自発的に進むステップでコントロールされると考えられてきました(図1右)。しかし最近、反応が進みにくい(反応が準平衡状態にある)ステップも、解糖流量の調節に関与し得ることを示唆する報告が出てきました。
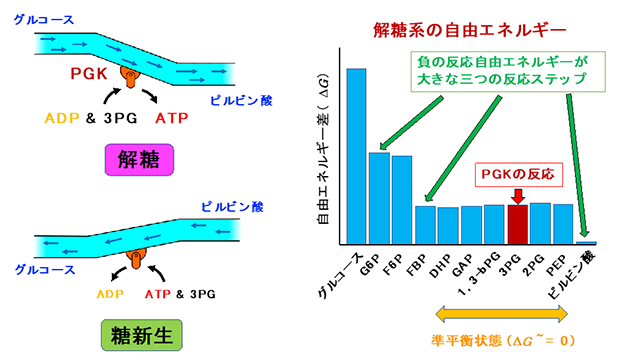
図1 PGKが担う解糖系・糖新生の反応と、解糖系の10ステップ
- 左)アデノシン二リン酸(ADP)にリン酸を付加する反応によりATPを合成する解糖と、逆反応によりADPを合成する糖新生の模式図。
- 右)グルコースがピルビン酸に代謝されるまでの代謝産物とそれぞれ反応の自由エネルギー差。反応が一つ進むときの自由エネルギー差が大きいほど反応が進みやすく、差がほとんどない準平衡状態では自発的な反応は起きにくい。PGK(ホスホグリセリン酸キナーゼ)は準平衡状態のうち1,3-bPG(1,3-ビスホスホグリセリン酸)から3PG(3-ホスホグリセリン酸)への反応を担い、この際1分子のATPを合成する。
解糖系酵素の一つであるホスホグリセリン酸キナーゼ(PGK)は、解糖系で最初にATPが合成される準平衡状態の反応を触媒します。PGKは直接ATPをつくり出す酵素のため、その反応機構は解糖流量の調整に重要な役割を担うはずです。さらに、がん細胞ではPGKの発現量が増加していることが知られており、細胞のがん化との関わりも注目されています。しかし、PGKの反応機構についての研究は、多くの場合生理状態とかけ離れた条件下で行われており、細胞の環境変化や状態変化に対して、どのような分子機構で反応を制御しているかは全く明らかにされていませんでした。
そこで共同研究チームは、生理的条件下で解析可能な核磁気共鳴(NMR)法と、実際の細胞中で標的タンパク質の解析が行えるin-cell NMR法[9]を使い、細胞の状態変化とPGKの反応制御機構の関係を明らかにしようと考えました。
研究手法と成果
PGKは、アデノシン二リン酸(ADP)[1]にリン酸を付加することで、ATPを合成します。この際、副産物として3-ホスホグリセリン酸(3PG)も同時につくられます。また逆に、細胞が糖を作る「糖新生[10]」では、ATPのリン酸を3PGに移してADPを合成します(図1左下)。このようにPGKは、両方向への反応を触媒して基質の合成・分解を行う酵素ですが、どちらの方向に対しても、反応自由エネルギー(ΔG)[4]の値は0に近く、自発的には進みにくい反応です。
一般的に酵素は、基質と結合することで反応を触媒します。そこで共同研究チームはまず、ATP合成(分解)反応の基質であるATP、ADP、3PGが、PGKとどの程度強く結合しているかを調べました。NMR法による基質滴定実験(NMR滴定実験[5])を行い、細胞内の塩濃度を反映した水溶液中でのPGKに対する3PGの結合親和性を解析した結果、PGKと3PGの結合は、ADPとATPの影響を受けていることが分かりました。具体的には、PGKにADPが結合していると、3PGの結合力は、ADPが結合していない場合と比べて2倍程度弱くなり(結合していない場合の1/2程度になる)、逆にATPが結合している場合は、ATPが結合していない場合と比べ、1.4倍程度強くなることが判明しました(図2)。
これは、3PGはADPが結合しているとPGKに結合しにくく(負の協同性)、逆にATPが結合しているとより結合しやすく(正の協同性)なることを表しています。
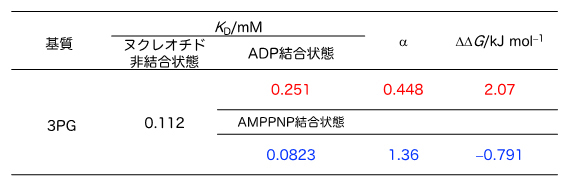
図2 PGKの基質結合親和性
NMRによる基質滴定実験で得られたPGKに対する3PGの基質結合親和性(KD値)を示す。なおATP結合状態での解析については、ATPはPGKと結合するとADPに分解されてしまうため、分解を受けない構造を持つATP類似体(AMPPNP)を用いた。αは協同性因子を表す。一般に、α>1ならば正の協同性、α<1ならば負の協同性を示す。またその際に生じる自由エネルギー差(ΔΔG)も併せて表示した。
こうした基質結合協同性がPGKの反応機構にどのような影響を与えるかを調べるため、PGKの酵素反応を試験管内で再現し、NMR法を用いてリアルタイムに3PGの変化を計測した結果、ATPの濃度が低い場合にはADPと3PGの負の協同性が3PGのPGKからの解離を促進し、ATPの濃度が高い場合は、ATPと3PGの正の協同性が3PGの解離を一部抑制することが分かりました(図3A)。
さらに、in-cell NMRの手法を使って実際の細胞中におけるPGKの基質結合状態の解析を行ったところ、ATPが枯渇している状態ではADP結合状態が優位に観測され、またATPが通常の濃度で存在する状態では3PG結合状態が一部観測されたことから、試験管内での解析結果とよく一致する結果となりました(図3B)。
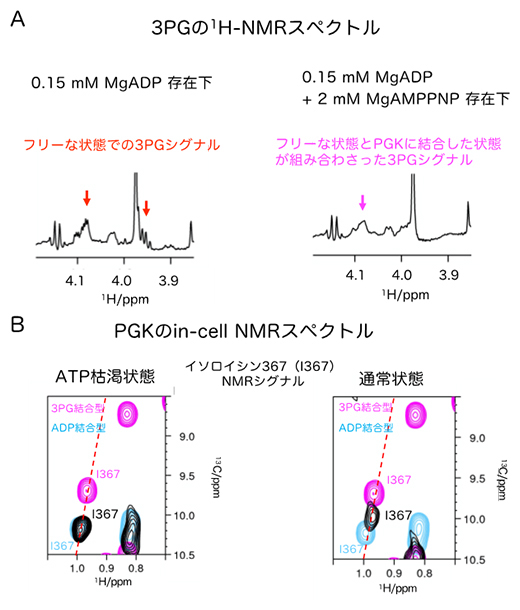
図3 PGK反応のリアルタイム計測とin-cell NMRスペクトル
- (A)3PGのメチレン基の水素の1H NMRスペクトル。PGK(0.05mM)に対して3倍量のADP(0.15mM)存在下では、フリーな状態での3PGシグナル(赤矢印)が観測された。一方、ATPがADPより10倍以上多く存在する(2mM)場合は、フリーな状態とPGKに結合した状態が組み合わさった3PGシグナル(マゼンタ矢印)が観測された。
- (B)HeLa細胞(ヒト子宮頸がん細胞)中におけるPGKのin-cell NMRスペクトル。残基番号367のイソロイシン残基のNMRシグナル(黒)の拡大図を比較した。このイソロイシンは、3PGの結合状態を鋭敏に反映する。ATP枯渇状態の細胞のin-cell NMRシグナル(黒)は、溶液NMRにおけるADP結合型(シアン)とよく一致しており、3PGが結合していないことを示している。一方通常状態の細胞のin-cell NMRシグナル(黒)は、溶液NMRにおける3PG結合型(マゼンタ)にシグナルが近づき、3PG結合状態の割合が増えていることが分かる。
すなわち、PGKはATP合成を促進すべき状況ではADP結合状態を増やして合成反応を進め、そうでない場合は3PGをある程度結合させることで合成反応が進みすぎないように自身の反応を制御していることになります。以上の結果から、PGKは細胞中のATPの濃度を感知し、基質結合協同性を巧みに利用することで、解糖流量をコントロールすることが明らかになりました(図4)。
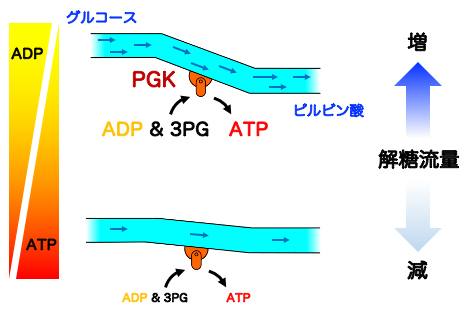
図4 ATP濃度に依存したPGKの反応機構
細胞中のATP濃度が高い場合(通常状態、下段)は、3PGとATPの正の協同性から3PGの解離が抑えられ、解糖流量を制御する。細胞中のATP濃度が低い場合(ATP枯渇状態、上段)は、反応終了後に生じたATPがADPと素早く置き換わり、ADPと3PGの負の協同性が3PGの解離を促進し解糖流量が増加する。
今後の期待
解糖系の恒常的な活性化は、がん細胞特有の現象であることが知られており、特定のがん細胞ではPGKの発現量の増加が見られます。また近年の研究から、ある種のがん細胞では解糖系酵素が液-液相分離[11]によってG-bodyと呼ばれる酵素クラスターを形成し、解糖流量を促進させることが分かってきました。解糖系を標的とした抗がん剤治療は古くから提唱されているものの、細胞がエネルギーを獲得する仕組みそのものにメスを入れることになるため、副作用の影響などから実用化に至っていないのが現状です。本研究から、今後、がん細胞に特化した解糖系の活性化を調節する仕組みの理解が進むことで、新しい抗がん剤治療の開発の糸口になると期待できます。
本研究で明らかになったPGKによる解糖流量の制御の仕組みは、準平衡状態(ΔG~=0)の反応において、基質結合協同性の非常に小さな結合自由エネルギー差(ΔΔG=-0.8~2kJ/mol)の違いがもたらすものでした(図1)。このような基質結合協同性を利用した制御機構は、エネルギー変化が小さいが故に、基質の合成・分解の両方向への反応を触媒する酵素が特有に持つ、タンパク質レベルでの反応制御機構だと考えられます。これは遺伝子レベルでの酵素量の増減による制御と異なり、細胞の状態変化に素早く対応できるため、外部環境変化に迅速に対応するために備わった細胞の防御システムの一つである可能性があります。解糖系以外の代謝系でもこのような制御が働いているか、さらなる検証が期待されます。
代謝は私たちの日常生活と深く関わっています。代謝の乱れは、糖尿病や脂質異常症(高脂血症)、メタボリックシンドロームなどの生活習慣病を誘発します。代謝制御機構の深い理解は、こうした生活習慣病の改善につながることも期待できます。
補足説明
- 1.アデノシン三リン酸(ATP)、アデノシン二リン酸(ADP)
生物全般に存在するリン酸化合物の一つで、塩基と糖が結合した化合物(ヌクレオシド)に三つのリン酸が結合していることから、三リン酸と呼ばれている。加水分解により一つのリン酸が解離するとアデノシン二リン酸となる。この加水分解で得られたエネルギーはさまざまな生体機能に利用されることから、エネルギー通貨とも呼ばれる。 - 2.解糖系
生物の体内にある糖の代謝経路。グルコースをピルビン酸や乳酸などに分解し、細胞のエネルギー源となるATPを産生する多段階の化学反応で、細胞質で進行する。 - 3.ホスホグリセリン酸キナーゼ(PGK)
解糖系の7段階目の酵素反応を担い、1,3-ビスホスホグリセリン酸とADPから、3-ホスホグリセリン酸とATPを産生する。 - 4.準平衡状態、反応自由エネルギー(ΔG)
ある系の化学反応が自発的に進まない状態を平衡状態と呼び、ほぼ平衡にある状態を準平衡状態と呼ぶ。反応自由エネルギー(ΔG)は平衡と自発性の指標であり、等温等圧過程での自由エネルギー(Gibbs free energy:記号G)の変化が負(ΔG<0)であれば化学反応は自発的に起こり、自由エネルギーが極小の一定値(ΔG=0)を取るときは、系が平衡状態にあることを意味する。 - 5.核磁気共鳴(NMR)法、NMR滴定実験
強い磁場中に置かれた原子核に電磁波を照射すると、核スピンの共鳴現象により、原子核の性質や周囲の環境に応じた周波数(共鳴周波数)の電磁波の吸収や放出が起こるが、その電磁波をNMR信号として捉えることで、物質の分子構造の解析や物性の解析を行う手法。NMR 滴定実験は、酵素を含む溶液に基質を一定量ずつ添加(滴定)してNMR信号を測定し、基質の濃度と酵素のNMR 信号の関係から解離定数を求める手法。NMRはNuclear Magnetic Resonanceの略。 - 6.結合親和性
生体分子(タンパク質やDNAなど)と、基質あるいは結合パートナー(薬剤や阻害剤など)との相互作用の強さを表し、一般的に解離定数(KD)によって示される。KDが小さいほど、結合親和性が高い(結合力が強い)。 - 7.クエン酸回路
TCA回路とも呼ばれ、糖や脂肪酸などの有機物が呼吸により完全酸化される回路。解糖で生じたピルビン酸がアセチルCoAとなって本回路に入り、クエン酸になる。その後、脱炭酸、脱水素を受けながら回路状の反応系を一巡し、1分子のピルビン酸から3分子の二酸化炭素、2分子の水、15分子のATPを生じる。動物細胞ではミトコンドリア内に存在する。 - 8.ワールブルグ効果
ドイツの生理学者オットー・ワールブルグ(Otto Warburg)が観察した現象。がん細胞は有酸素下(好気状態)でも、ミトコンドリア内で行われる酸化的リン酸化よりも解糖系によるATP生産を優先する現象のこと。グルコースは解糖系で代謝された後にミトコンドリアに入ることなく、乳酸に変換される。 - 9.in-cell NMR法
生きた細胞内に導入したタンパク質を測定する方法。細胞内はタンパク質や核酸などの生体分子が高濃度で存在する「分子混雑」の状態で、水溶液中とは異なった環境である。in-cell NMRでは、実際に機能している環境下でタンパク質を解析できる。 - 10.糖新生
動物が脂質やアミノ酸など糖質以外の物質からグルコースを合成する代謝経路。ほとんどは肝臓の細胞で、一部は腎臓で行われる。解糖系やクエン酸回路とほぼ逆の反応で、ピルビン酸や乳酸、クエン酸回路の中間体などからグルコースがつくられる。 - 11.液-液相分離
二つの液体が混ざり合わずに互いに排除し合うことで2相に分離する現象。細胞内においても核酸やタンパク質が液-液相分離を起こし、周囲とは異なる液相を形成することが明らかになってきた。核やミトコンドリアなどが「膜で仕切られたオルガネラ」と呼ばれるのに対し、核酸やタンパク質が作る生体高分子の液滴は「膜のないオルガネラ」として、細胞のさまざまな機能との関連が注目されている。
共同研究チーム
理化学研究所 生命機能科学研究センター 細胞構造生物学研究チーム
研究員 八木 宏昌(やぎ ひろまさ)
研究員 葛西 卓磨(かさい たくま)
実習生(研究当時) エリサ・リオール(Elisa Rioual)
チームリーダー 木川 隆則(きがわ たかのり)
東京都立大学 理学部
准教授 池谷 鉄兵(いけや てっぺい)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、RIKEN Pioneering Project「Dynamic Structural Biology by Integrating Physics, Chemistry, and Computational Science Research」、「Biology of Intracellular Environments」)で実施し、科学技術振興機構(JST)戦略的創造研究推進事業CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中啓二)」の研究課題「NMRと計算科学の融合によるin situ構造生物学の確立と真核細胞内蛋白質の動態研究への応用(研究代表者:伊藤隆、分担:木川隆則)」による支援を受けて行われました。
原論文情報
- Hiromasa Yagi, Takuma Kasai, Elisa Rioual, Teppei Ikeya, and Takanori Kigawa, "Molecular mechanism of glycolytic flux control intrinsic to human phosphoglycerate kinase", Proceedings of the National Academy of Sciences of the United States of America(PNAS), 10.1073/pnas.2112986118
発表者
理化学研究所
生命機能科学研究センター 細胞構造生物学研究チーム
研究員 八木 宏昌(やぎ ひろまさ)
研究員 葛西 卓磨(かさい たくま)
チームリーダー 木川 隆則(きがわ たかのり)
 八木 宏昌
八木 宏昌
 葛西 卓磨
葛西 卓磨
 木川 隆則
木川 隆則
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
