2009年4月10日
独立行政法人 理化学研究所
女性ホルモン「エストロゲン」の記憶改善効果の一端を解明
-慢性脳循環障害の遺伝子改変で性差、女性の脳は男性より記憶障害に強い-
ポイント
- 脳循環障害モデルマウスは、脳血管の破壊や梗塞なしに脳アストロサイトが膨張
- アストロサイトが膨張した脳組織は、神経突起が萎縮しシナプスが減少
- エストロゲンはアストロサイトの膨張を抑制し、記憶学習機能を回復
要旨
独立行政法人理化学研究所(野依良治理事長)は、女性ホルモンであるエストロゲン※1が、脳血管を拡張し脳循環を回復することで、記憶を改善する機能を発揮するという、分子メカニズムの一端を解明しました。理研脳科学総合研究センター(利根川進センター長)山田研究ユニットの山田真久ユニットリーダーと北村尚士テクニカルスタッフらによる研究成果です。
慢性脳循環障害を引き起こすアセチルコリン※2受容体遺伝子欠損マウスを、電子顕微鏡画像などで解析したところ、脳循環(脳の血液循環など)が低下すると、脳血管の破壊や梗塞(こうそく)が起きていなくても、脳アストロサイト※3の膨張や神経突起萎縮(いしゅく)を引き起こすことが分かりました。ところが、このような異常は、オスの遺伝子欠損マウスだけで観察され、メスの遺伝子欠損マウスでは、野生型マウスと違いがありませんでした。この性差に着目し、卵巣から放出されるエストロゲンの作用を調べたところ、エストロゲンがアセチルコリンと同様に脳血管拡張効果を持ち、脳血管拡張機能を代償していることが分かりました。そこで、オスの脳循環障害マウスにエストロゲンを投与したところ、脳アストロサイトの膨張や神経突起萎縮の症状が回復し、記憶学習能力も改善していることが判明しました。
本研究の成果は、アセチルコリンとエストロゲンが共に脳血管の拡張効果を持ち、共通のメカニズムで記憶改善に働くことを示しました。特に、神経突起の萎縮が可逆的に改善できたことは、脳血管の拡張メカニズムが、予防的な薬だけではなく、発症後の機能改善に役立つ薬の開発のターゲットとなりうると期待できます。
本研究成果は、米国のオンライン科学雑誌『PLoS ONE』(4月10日付け:日本時間4月10日)に掲載されます。
背景
アセチルコリンの受容体には、ニコチン性※4とムスカリン性※5の受容体があり、それぞれ発現する組織や受容体機能が異なることが知られています。中枢神経系のムスカリン性アセチルコリン受容体を介した神経伝達経路は、脳高次機能発現に対して主要な役割を担っていると考えられています。ムスカリン性アセチルコリン受容体には5種類(M1-M5)のサブタイプがありますが、完全なサブタイプ特異的なリガンドがなく、種々の神経組織で各受容体が共発現していることから、サブタイプ特異的な生理機能は不明のままでした。この問題に取り組むために、研究ユニットは各ムスカリン性受容体(M1-M5)遺伝子欠損マウスを作製し、個体解析を行ってきました。
脳内のM5受容体タンパク質発現量は、全ムスカリン発現量の2%にしかすぎないことが知られており、脳血管内皮細胞に顕著に発現しています。山田ユニットリーダーは、これまでに、アセチルコリンによる動脈の拡張能力が、M5受容体の遺伝子欠損マウスの脳底動脈で完全に消失していることを見いだし、アセチルコリンの血管拡張作用がM5受容体に依存していることを明らかにしています(PNAS 98: 14096-14101, 2001)。また、オスのM5受容体遺伝子欠損マウスは、この恒常的な脳血管の収縮により、脳底動脈や中大動脈などの動脈で、脳血流量が野生型マウスに比べて約20~30%減少していました(Neurobiol Dis. 24: 334-344., 2006)。このマウスでは、脳血管の破壊や梗塞(こうそく)による細胞死や、血液成分の脳組織内への侵入がない状態で生じる脳内変化を観察することができます。このマウスは、血管の結紮(けっさつ:糸結び)などといった手術を用いない、新規の脳循環障害モデルマウスといえます。
研究手法と成果
(1)エストロゲンの作用の解明
研究ユニットは、メスのM5受容体遺伝子欠損マウスが、野生型と同様の表現型である(異常がない)のに対し、卵巣を摘出したメスのM5受容体遺伝子欠損マウスが、オスのM5受容体遺伝子欠損マウスと同様の異常を示すことを発見しました。そこで、卵巣から放出される女性ホルモンのエストロゲンの作用に着目しました。
エストロゲンは、Gタンパク質共役型受容体で、膜貫通型エストロゲン受容体GPR30を介して、血管拡張作用を持つ一酸化窒素(NO)を産生することが種々の細胞株で報告されています。しかし、これまでエストロゲンやアセチルコリンの血管拡張作用を調べた実験は、末梢血管内皮細胞を使って行っていました。今回、研究ユニットは初めて、脳由来のマウスの不死化脳毛細血管内皮細胞株(TM-BBB細胞)※6を用いて、エストロゲンとアセチルコリンのNO産生能力を調べました。その結果、エストロゲンとアセチルコリンは、同様のMAPキナーゼ※7の活性化を介したNO産生を引き起こすことが分かりました(図1)。すなわち、マウスのTM-BBB細胞では、エストロゲンとアセチルコリンが、同様のシグナル経路を活性化して、NOの放出を促進していました。
アセチルコリンやエストロゲンは、記憶改善効果を持つ薬剤として長く研究のターゲットとなってきました。今回、この2つの化合物が共通のメカニズムで脳血管を拡張することで、脳循環を保ち、神経細胞活動を維持していることを明らかにしました。
(2)脳循環低下によるアストロサイトの細胞容積の膨張と神経突起萎縮
研究ユニットは、オスM5受容体遺伝子欠損マウスの脳アストロサイトにおいて、Na+/H+交換輸送体(NHE1)のタンパク発現が、正常脳より亢進していることを観察しました。このタンパク質の活性化は、脳循環の低下に伴う低酸素やグルコース欠乏状態で起こると考えられます。そこで、研究ユニットは、アストロサイトが脳循環の低下に反応していると考え、電子顕微鏡画像を3次元構築してアストロサイトの細胞容積を検討しました。その結果、脳循環低下が見られる組織では、アストロサイトの細胞容積が膨張し(図2)、さらに神経細胞の神経突起萎縮が起きていること(図2)を観察しました。電子顕微鏡画像から、シナプス形成の顕著な減少が確認できました。研究ユニットは、このようなシナプスの減少を伴う神経細胞の形態的変化が、海馬錐体細胞での自発発火頻度の減少といった神経回路網の伝達障害を生じることを、電気生理学的手法により確認しています(Neurobiol Dis. 24: 334-344, 2006)。また、「Y迷路」や「物体の認知テスト」における海馬依存の短期記憶学習試験でも、空間学習能力が低いことが示されています。
(3)エストロゲン投与による脳機能および記憶の回復
脳循環低下が見られる組織中では、膨張したアストロサイトが脳内の空間を埋めてしまうために、神経細胞のシナプス結合が阻害される可能性が考えられました。研究ユニットは、エストロゲンがアセチルコリンの機能を代償するという仮説を検証するために、エストロゲンをオスのM5受容体遺伝子欠損マウスに投与して、脳循環を改善するとともに、神経突起萎縮の修復が可能であるかを検討しました(図2)。生きたマウスに対して非侵襲的に脳循環を測定するために、磁気共鳴血管画像(MRA)を用いました。オスM5受容体遺伝子欠損マウスの皮下に外科手術で埋め込んだエストロゲンタブレットからは、持続的に一定の量のエストロゲンが放出します。このエストロゲン投与により、脳血管の拡張能の回復、膨張したアストロサイトの細胞容積の回復、および神経突起萎縮の回復(図2)とシナプス数の回復が見られ、短期記憶学習試験においても脳循環障害による海馬依存の空間学習能力低下の回復が確認できました。つまり、シナプス形成の回復が記憶学習能力の回復を促したと考えられます。
今後の期待
本研究成果は、脳循環と脳アストロサイトの細胞容積との関係が、脳環境が神経細胞へ与える影響を解明する鍵となる可能性を示しました。アストロサイトの細胞容積の変化は、脳循環低下という外界刺激に対する脳組織の反応と考えることができます。動脈硬化の進行など脳循環を低下させる因子は数多く知られています。脳循環の低下によるアストロサイトの細胞容積の変化を、非侵襲的に観察する技術を開発することで、脳機能を新たな視点で検証することが可能になると考えます。
従来、神経細胞萎縮は、細胞死へのステップであると考えられていました。しかし、脳内では、脳循環の回復により可逆的に細胞の状態を変えることが可能であることが分かりました。今後、アストロサイトの細胞容積の膨張がシナプス形成に与える分子メカニズムを解明する方針です。この成果から、エストロゲン投与による女性化や乳がんのリスクといった副作用を引き起こさない脳機能改善薬の開発が期待されます。
発表者
理化学研究所
脳科学総合研究センター 山田研究ユニット
ユニットリーダー 山田 真久(やまだ まさひさ)
Tel: 048-467-7648 / Fax: 048-467-7648
お問い合わせ先
脳科学研究推進部 鈴木 一郎(すずき いちろう)Tel: 048-467- 9654 / Fax: 048-462- 4914
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.エストロゲン
女性ホルモンの一つで、主に卵巣の顆粒膜細胞で作られる。エストロゲン受容体は、核内エストロゲン受容体を介してさまざまな遺伝子発現を調節している。一方、Gタンパク質共役型受容体であり細胞膜貫通型エストロゲン受容体GPR30は、活性化によってMAPキナーゼ(※7参照)が活性化される。血管内皮細胞は、ERKの活性化を介して血管拡張作用を持つ一酸化窒素(NO)を産生する。 - 2.アセチルコリン
神経伝達物質の一つで、脳内アセチルコリンはアルツハイマー病との関連で、古くから脳機能改善薬として着目されてきた。近年、アセチルコリンを分解する酵素の阻害剤がアルツハイマー病治療に使用されている。脳底動脈は、アセチルコリンによって拡張することが知られており、この効果がM5ムスカリン性アセチルコリン受容体によって担われていることが分かっている(Yamada M, et al. Proc Natl Acad Sci USA 2001; 98: 14096-14101)。 - 3.脳アストロサイト
神経系において、神経細胞の間を埋めて神経組織の形態維持に働き、脳血管からエネルギーを受け取り神経細胞へ与える支持細胞と考えられてきた。アストロサイトは細胞数にして50%、体積にして20%を占めているといわれており、その体積変化は神経系における細胞間スペースに大きく影響すると考えられる。 - 4.ニコチン性アセチルコリン受容体
イオンチャンネル型受容体で、運動神経終末に存在しているニコチン性アセチルコリン受容体は、筋肉の運動に関与すると考えられている。 - 5.ムスカリン性アセチルコリン受容体
Gタンパク質共役型受容体で、5種類(M1-M5)のサブタイプがあり、中枢および末梢に広く分布していることが知られる。ムスカリン性受容体を介したコリン作動性神経伝達経路は、脳高次機能の主要な役割を担っていると考えられている。 - 6.不死化脳毛細血管内皮細胞株(TM-BBB細胞)
温度感受性SV40 T抗原遺伝子導入動物から樹立された脳毛細血管内皮細胞の条件的不死化細胞株。脳の血管内皮細胞と末梢の血管内皮細胞は、血液脳関門を作るか否かという違いがある。 - 7.MAPキナーゼ(mitogen-activated protein kinase)
広く真核生物に保存されたセリン/スレオニンキナーゼであり、活性化に伴い細胞外の情報を核に伝える細胞内分子。
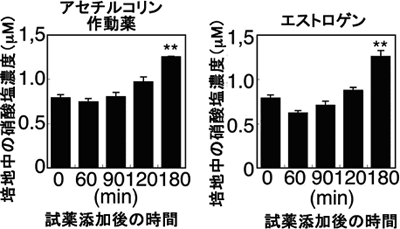
図1 脳血管内皮細胞に対するアセチルコリンとエストロゲンの効果
アセチルコリン作動薬(100μM bethanechol)とエストロゲン(10nM E2)は共に、マウス脳血管由来の細胞株であるTM-BBB細胞から一酸化窒素(NO)を産生させる能力があった。TM-BBB細胞から培地中へ放出されたNOは、硝酸塩濃度の変化で測定した。
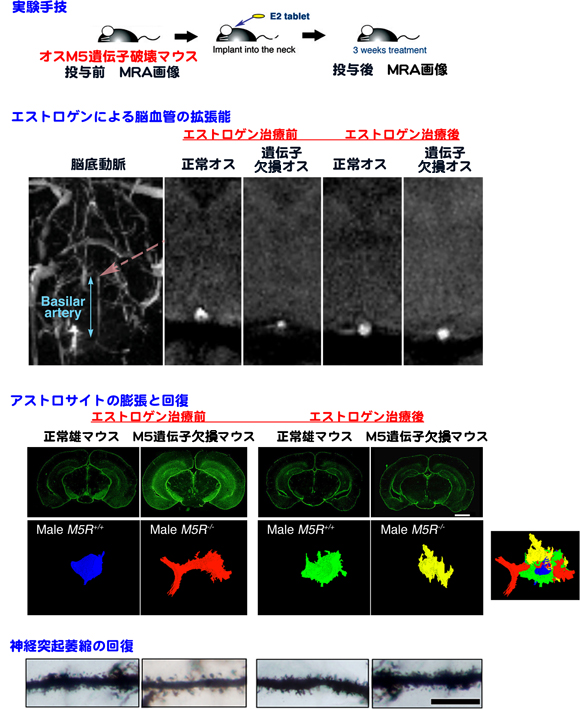
図2 脳循環低下によるアストロサイトの膨張とエストロゲンの効果
(実験手技)
脳循環障害モデルマウスに、持続投与型のエストロゲンタブレットを埋め込む手術を施した。
(エストロゲンによる脳血管の拡張能)
MRAで、エストロゲン投与による脳底動脈の拡張を確認した。
(アストロサイトの膨張と回復)
慢性脳循環障害は、脳アストロサイトの膨張を引き起こす。エストロゲンによる脳循環の回復により、アストロサイトの膨張も回復した。
(神経突起萎縮の回復)
アストロサイトの膨張は、シナプス形成の場を奪うことが考えられる。アストロサイトの膨張の回復が、神経突起萎縮の回復を促した可能性がある。
