2009年4月20日
独立行政法人 理化学研究所
細胞の分化などの状態を支配する分子ネットワークを解明
-自在に細胞をコントロールする「夢の技術」に向けて一歩前進-
ポイント
- 理研独自技術と次世代シーケンサーで分子ネットワーク解明にブレークスルー
- 遺伝子発現データを解析する汎用的な方程式を導き、白血病由来細胞で実証
- iPS細胞などの細胞分化・機能発現の様子を理論的に制御する技術の開発へ貢献
要旨
独立行政法人理化学研究所(野依良治理事長)と、理研オミックス※1基盤研究領域(OSC、林崎良英領域長)が主催する「国際FANTOMコンソーシアム※2」(統括:林﨑良英、科学コーディネーター:鈴木治和)は、文部科学省ゲノムネットワークプロジェクト※3と連携し、大規模データ解析により細胞の分化状態(表現形質)を支配している一群の転写因子※4と、その制御関係を解明し、解析のパイプラインの基礎の構築に成功しました。本成果は、FANTOM4の活動と文部科学省ゲノムネットワークプロジェクトの活動による研究成果です。
理研OSCでは、マウスエンサイクロペディアプロジェクト※5で収集した完全長cDNAのアノテーション(機能注釈)を行うことを目的に、2000年に国際FANTOMコンソーシアムを結成しました。これまでにFANTOM1~3の3つの段階※6の活動を行い、新たなFANTOM4※6では、転写因子のネットワークを解明することを目指しました。
研究グループは、白血病由来のヒト免疫細胞株(THP-1)が、単芽球※7様から単球※7様の状態に分化する過程を、時間を追ってゲノムワイドなデータを収集しました。特に、OSCが独自に開発した技術(CAGE法※8)と次世代シーケンサー※9を組み合わせ、転写因子の発現データを収集し、新たな概念に基づき汎用的な方程式を構築し、コンピュータで解きました。その結果、解析した約200種類の転写因子の中で、単芽球から単球への分化の過程を支配している30種類の転写因子を抽出し、それらのネットワークを明らかにしました。本成果は、既存の情報を用いることなく、実験データのみに基づいて分子ネットワークの全体像を解明した初めての例となりました。今回の成果により、細胞の分化状態をつかさどる分子ネットワークを解明するには、「どのようなデータを集め、どのように処理・解析すればよいのか」という、解析のパイプラインの基礎が構築されたことになります。
海外では、米国のENCODEプロジェクト※10などを中心に、ゲノム上の機能単位を詳細に解明するプロジェクトが進んでいますが、大規模な分子ネットワークの解明の試みはなされていません。わが国のユニークな発想と技術力に加えて、国際共同研究が結実した今回の成果は、特定の細胞の状態を支配している一群の重要な遺伝子の抽出に応用できるため、今後のライフサイエンスに不可欠な研究基盤になると考えられます。
今回の成果は、この解析のパイプライン構築の成果と、新たな種類のRNA発見の成果を含め、3報が米国の科学雑誌『Nature Genetics』の特集号に同時掲載されるに先立ち、4月19日(日本時間4月20日)にオンライン掲載されます。さらに米国の科学雑誌『Genome Biology』のFANTOM特集号にも、同時に多数の関連論文が掲載されます。
背景
FANTOMとは、理研のマウスエンサイクロペディアプロジェクトで収集した完全長cDNAのアノテーション(機能注釈)を行うことを目的に、2000年に結成された国際研究コンソーシアムで、参加国数が15カ国、参加機関が51機関に上ります。
FANTOMは、これまでにFANTOM1~3の3つの段階の活動を行ってきました。アノテーションパイプラインの確立を目指したFANTOMの活動は、急速に発展・拡大し、FANTOM3では、トランスクリプトーム解析からRNA新大陸※11の発見をもたらし、大きな反響を与えました。RNA新大陸の発見は、FANTOM3の活動と文部科学省ゲノムネットワークプロジェクトの活動で得た成果です。
今回、FANTOMコンソーシアムは、DNAやRNA、タンパク質などの生体分子が細胞内で、どのような分子ネットワークにより生命現象を成立させているのか、の解明を最終目標として研究を進めてきました。しかし、これまで分子ネットワークを描く方法は、一つ一つの遺伝子に関する研究を、過去の論文などの情報と合わせるだけで、複数の転写因子を同時に解析する技術や、得られた実験データからネットワークを読み解くインフォマティクス手法がありませんでした。
新たなFANTOM4では、細胞分化にかかわる転写因子の網羅的な解析を行うとともに、ゲノムワイドな実験データのみから、大規模な分子相互作用のネットワークを描く方法を示すことを目指しました。
研究手法と成果
今回の研究では、「Attractor Basin」という概念を提案し、細胞の状態と分子ネットワークの解析に取り組みました。これは、「細胞の分化とは、ある安定状態から別の安定状態への遷移で決められており、そこでは分子ネットワークが、特定の安定状態を維持したり、あるいは変化させたりするカスケード(相互作用の連続)を制御するために働いている」とするものです(図1)。具体的には、分子ネットワークのうち最も基本的な「転写制御ネットワーク※12」に着目しました。これを解析することで、細胞の状態を規定する中心的な分子ネットワークが明らかになると考えられます。
研究グループは、白血病由来のヒト免疫細胞株(THP-1)を転写制御ネットワークの解析のモデルとして採用しました。この細胞は、PMA(Phorbol Myristate Acetate)という試薬で刺激すると、単芽球(丸い形状)から単球(扁平な形状)へと分化します。そこで、単芽球の状態の細胞を、PMAで刺激した時点から96時間後までの間の10回の時点で、発現しているmRNAやタンパク質などのさまざまなデータを測定しました(図2)。その際、CAGE法と次世代シーケンサーを組み合わせることによって得た、全ゲノムにわたる遺伝子プロモーターの発現頻度を調べたデータが、重要な役割を果たしました。この方法では、約10個の細胞の中で1分子しか発現していないような、極めてまれな遺伝子プロモーターも、99.995%の確率でとらえることができました。
こうして得たデータを解析するため、新たな概念を導入し、転写因子の発現を定量的に説明する方程式を構築しました。この方程式に実測データをあてはめてコンピュータで解いたところ、約200種類の転写因子の中で、単芽球から単球への分化の過程で重要な役割をしている30種類の転写因子を抽出し、互いにどのように制御しているかを明らかにすることに成功しました(図3)。その結果、細胞の分化状態の変化や維持において、多くの転写因子が協奏的に働き合っていることが分かりました。特に、単芽球で支配的な転写因子が制御する遺伝子には、細胞分裂など分化に関係する遺伝子が多く、一方、単球で支配的な転写因子が制御する遺伝子には、細胞の接着や免疫応答など細胞の機能にかかわる遺伝子が多いことが分かりました。
この成果は、「どのようなデータをとり、どのような方針で解析すれば、信頼できる分子ネットワークが描けるか」という解析のパイプラインを構築したという意味で重要なものです。理研OSCでは、このパイプラインをライフサイエンスアクセラレーター(LSA)※13の基礎と位置付けています。また、これまで転写因子について記述するには、「強い」、「弱い」など定性的に表現するしかありませんでした。しかし今回、これを定量的に記述する汎用的な方程式が導かれたことで、細胞状態でどの転写因子がどれだけ支配力を持っているかを数値で示すことができるようになりました。
加えて、今回の報告のように、次世代シーケンサーによるRNA発現データなど、大規模なデータの網羅的な解析によって、細胞を支配する重要な転写因子とその分子ネットワークの全体像を明らかにしたのは世界で初めてです。
さらに、今回の一連の実験から、tiRNA※14という新しい種類の非タンパクコードRNA(Non-coding RNA; ncRNA)※15など数々の新しい発見を同時に得ました。
今後の期待
現在、バイオ医学研究分野では、インフォマティクス手法の開発や次世代シーケンサーの高度化を目指した競争が世界中で激化しています。特に、次世代シーケンサーの活用という観点では、単にシーケンスを読み取るだけでなく、理研独自のサンプル調製技術と解析技術を含めたパイプラインの一環として活用することで、高次の情報を抽出するというわが国の強みを顕著に示すことができました。
今回構築した分子ネットワーク解読のパイプラインは、細胞について分子レベルで理解する基礎となることから、研究分野に不可欠の研究基盤になると期待できます。
今後、ある分化状態にある細胞を規定する重要な一群の遺伝子を抽出し、その遺伝子を細胞に導入することにより、目的とする状態に分化させる技術への展開が期待されます。例えば現在、iPS細胞により、病気などで機能を失った細胞を再生する研究が、わが国の重要研究分野として推進中ですが、分子ネットワークの情報が得られると、試行錯誤に多くの時間を費やすことなく、iPS細胞を目的とする細胞に、効率よく誘導することが可能になると期待されます。オミックス基盤研究領域では、今回の成果をもとに、iPS細胞や皮膚の細胞を、目的とする細胞に分化させる技術の開発に着手し、日本の研究開発力を世界にアピールしていきたいと考えています。
文部科学省では、2009年4月から次世代シーケンサーを活用して、生命の基本単位である細胞について、増殖・分化、機能制御などの細胞・生命プログラムの解明を目指す新規プロジェクト「革新的細胞解析研究プログラム(セルイノベーション)」を開始し、理研OSCも密接に連携しています。本成果は、文部科学省ゲノムネットワークプロジェクトとFANTOM4との連携による研究成果であり、文部科学省革新的細胞解析研究プログラム(セルイノベーション)につながる最初のものとなります。今後、本研究で構築した分子ネットワーク解読のパイプラインをさまざまな細胞へ応用し、同プログラムへ貢献していきたいと考えます。
発表者
理化学研究所
オミックス基盤研究領域
領域長 林﨑 良英
Tel: 045-503-9222 / Fax: 045-503-9216
お問い合わせ先
横浜研究推進部 企画課Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.オミックス(Omics)
生体のもつあらゆる分子情報を解析・解明しようとする研究のこと。ゲノム(genome)は遺伝子(gene)の総体(gene+ome)であり、ゲノムの分子情報を解明しようとする研究を語尾に-omicsをつけ、ゲノミクス(genomics)と呼ぶ。同様に、遺伝子からの転写物の総体であるトランスクリプトーム(transcriptome)、タンパク質の総体のプロテオーム(proteome)、表現型の総体のフェノーム(phenome)までのすべてを網羅する学問をオミックス研究と呼ぶ。 - 2.国際FANTOMコンソーシアム
2000年に、理研ゲノム科学総合研究センター 遺伝子構造機能研究グループ(現・オミックス基盤研究領域)が中心となって結成した。哺乳動物(マウス)の遺伝子を網羅的に機能注釈することを主眼とする国際的研究コンソーシアム共同集団(Functional ANnoTation Of Mammalian cDNA)の略称。現在は活動範囲を拡大し、遺伝子ネットワークの解明に取り組んでいる。オーストラリア、シンガポール、スウェーデン、南アフリカ、イタリア、ドイツ、ギリシャ、スイス、英国、米国などを含む全世界の15カ国から、51の研究機関などが参加している。 - 3.文部科学省ゲノムネットワークプロジェクト
2004年度から文部科学省(笹月健彦推進委員会主査、榊佳之実施会議議長、林﨑良英中核機関研究課題代表者、五條堀孝中核機関研究課題代表者)によって開始された。今後のポストゲノムシーケンシング研究の発展を目指して、国際レベルにある研究ポテンシャルを活用しつつ、遺伝子の発現調節機能やタンパク質等の生体分子間の相互作用の網羅的な解析に基づき、生命活動を成立させているネットワークを明らかにすることを目的とした。 - 4.転写因子
DNA上のプロモーターと呼ばれる、転写開始を促す活性を持つ特定の領域・塩基配列に特異的に結合し、RNAへの転写の過程を促進または抑制する一群のタンパク質。iPS細胞を作成する際に、導入される遺伝子も転写因子である。 - 5.マウスエンサイクロペディアプロジェクト
1995年から理研が進めてきた完全長cDNA計画。マウスで実際に遺伝子として発現している全部のRNAの配列(遺伝子配列)を読むプロジェクトで、このためにRISA system(Riken Integrated Sequence Analysis System)、包括的完全長cDNAライブラリー作製などの一連の技術開発を展開してきた。 - 6.FANTOM1~3の3つの段階、FANTOM4
FANTOM1
遺伝子の機能注釈のルールや方法について取り決めを行い、遺伝子の機能注釈を効率的に行なうシステムを開発した。FANTOM2
60,770セットのマウス完全長cDNAの塩基配列および機能注釈を行った。この活動は、世界で初めて哺乳類の完全長cDNAの標準化を行ったもので、成果論文はマウスゲノム解読の報告とともに、Nature特集号に掲載された。FANTOM3
2005年、米国の科学雑誌『Science』のRNA特集号(9月2日号)に、ライフサイエンスの転機となる2報の成果を報告し、「RNA新大陸の発見」として大きな反響を与えた(2005年9月2日プレス発表)。FANTOM4
FANTOM3までの活動で、分子ネットワークの要素となる遺伝子や、非タンパクコードRNA(Non-coding RNA; ncRNA ※14参照)などを収集したことから、FANTOM4では、特に転写制御ネットワークの解明を目指して、2006年にスタートした。生命活動を分子レベルで明らかにすることが究極の目標。 - 7.単芽球、単球
単球(monocyete)は白血球の一種で,最も未熟なものは単芽球(monoblast)と呼ばれる。単球は最終的にマクロファージへと分化し、老廃物や細菌の処理などさまざまな役割を発揮する。 - 8.CAGE法
Cap Analysis of Gene Expressionの略。理研オミックス基盤研究領域が開発した方法で、耐熱性逆転写酵素やcap-trapper法を組み合わせて、5'末端から20塩基のタグ配列を切り出し、塩基配列を決定する実験技法。この塩基配列を読み取ってゲノム配列と照らし合わせ、どの部分がコピーされているかを調べることができる。 - 9.次世代シーケンサー
米国を中心に、従来のDNAシーケンサーが採用していたサンガー法とは異なる原理を採用することで、短いDNA配列をきわめて高速に解読する技術が開発され、活用できるようになった。シーケンサー開発分野は発展が目覚ましく、同じ次世代と言っても大きな性能差があるため、第2世代、第3世代と細分化するようになってきた。 - 10.ENCODEプロジェクト
ポストゲノム戦略として米国で立ち上げられたプロジェクトで、米国NIH(衛生研究所)の国立ヒトゲノム解析研究所 (National Human Genome Research Institute)を中心として、2003年9月から正式に開始された計画。‘ENCODE’とは、Encyclopedia of Human DNA Elements(ヒトDNAの百科事典)から命名されており、完全解読されたヒトゲノム上に、遺伝子の機能を担う領域をすべて書き込んで、全ヒトゲノム(DNA)の百科事典を作成することを目指している。 - 11.RNA新大陸
多様な細胞内RNA集団の莫大(ばくだい)な可能性を示す比喩的表現。2005年9月のプレス発表で、遺伝子の定義を新たに提案した際に用いた新用語。細胞が生産するRNAに関し、今までにない大規模なスケールで調べたところ、従来100個ぐらいしか知られていなかった非タンパクコードRNA(Non-coding RNA; ncRNA)が、実は23,000個以上、つまり、全遺伝子の半分以上(53%)を占めているという新しい事実を示したものだった。このことは、タンパク質がゲノムにコードされている最終生理活性物質であるというこれまでの常識を覆し、予想を凌ぐトランスクリプトームの複雑さを認識させるもので、哺乳動物ゲノムの情報内容に対するこれまでの理解(「遺伝子」という領域が散在しているゲノムのイメージ)を根幹から変えてしまうものだった。 - 12.転写制御ネットワーク
ある遺伝子から発現した転写因子が、別の転写因子遺伝子の発現を制御し、これにより発現した転写因子がさらに別の遺伝子発現を制御するという一連の相互作用。 - 13.ライフサイエンスアクセラレーター(LSA)
理研OSCが構築する、遺伝子ネットワーク解析のパイプライン。その要素技術には、CAGE法をはじめとするサンプル調製法、次世代シーケンサーを活用する技術、バイオインフォマティクスなどが含まれる。このパイプラインがライフサイエンスの研究を加速することを願い、「アクセラレーター(加速器)」と名付けた。 - 14.tiRNA
FANTOM4の活動の一環として新たに発見されたTranscription initiation RNA(tiRNA)は、転写開始点の―60から+120塩基の部分に多く存在する18塩基の短いRNA。とくに、活発に転写されている部位やRNAポリメラーゼが結合する部位に多く見いだされる。 - 15.非タンパクコードRNA(Non-coding RNA; ncRNA)
ncRNAからはタンパク質は翻訳されない。しかし、主に遺伝子発現制御に関して生物学的に重要な機能を持つncRNAも多くも示され、ほ乳類の発生や他の生物学的機能において重要な役割を担っている。
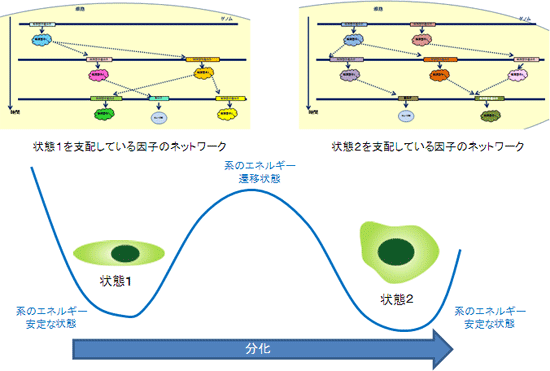
図1 Attractor Basinの概念図
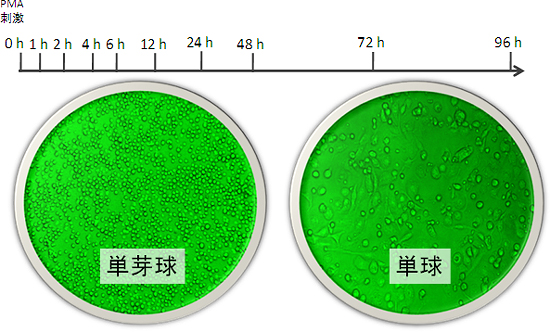
図2 THP-1細胞の分化と今回のデータ測定
THP-1細胞をPMAという試薬で刺激することにより、単芽球(左)から単球(右)に分化する。今回はこの過程の10回の時点でCAGEなどのゲノムワイドなデータを収集した。
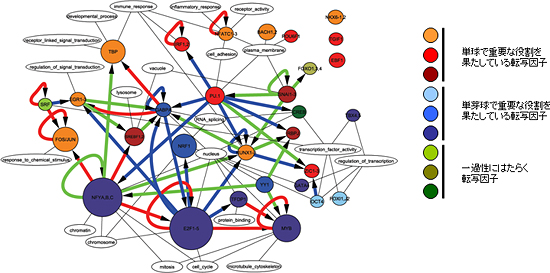
図3 今回の研究で解明された、単芽球から単球への分化を支配する転写因子ネットワーク
色のついた丸で示されているのが、200種類の転写因子から抽出された30種類の転写因子。大きな丸で示されているものはより支配的な役割を果たしている。矢印は制御の関係を示す。
