2009年5月1日
独立行政法人 理化学研究所
タンパク質の架橋反応が細胞死を招き、アルコール性肝障害に
-アルコール性障害の肝臓で繰り広げられる新しい肝細胞死のメカニズムを発見-
ポイント
- アセトアルデヒドが肝細胞に働くと、酵素トランスグルタミナーゼは細胞核に移動
- トランスグルタミーゼが、転写因子Sp1を架橋させ不活性化
- アルコール性肝障害における肝細胞死誘導に新経路
要旨
独立行政法人理化学研究所(野依良治理事長)は、過度のアルコール摂取時に、トランスグルタミナーゼ(TG2)※1と呼ばれるタンパク質同士を結びつける酵素が、細胞質から細胞核に移動し、細胞が生存するのに大事な遺伝子の発現に欠かせない転写因子Sp1※2を架橋させ、肝細胞死を引き起こすという、アルコール性肝障害の新たな分子メカニズムを解明しました。基幹研究所(玉尾皓平所長)分子リガンド生物研究チームの小嶋聡一チームリーダーと辰川英樹特別研究員、東京慈恵会医科大学、カルフォルニア大学、南カルフォルニア大学、ニューサウスウェールズ大学などによる研究成果です。
アルコール性肝障害は、肝細胞死、脂肪肝、肝炎を伴い、肝硬変や肝がんにつながる生活習慣病です。分子リガンド生物研究チームは、アルコールの代謝産物であるアセトアルデヒドが肝細胞に働くと、通常細胞質に存在するTG2が細胞核に移動し、肝細胞増殖因子受容体c-Met※3の遺伝子発現をつかさどる転写因子Sp1が過度に架橋結合※4し、その機能が失われることでc-Met発現量が低下し、肝細胞が死に至ることを見いだしました。TG2遺伝子欠損マウスやTG2阻害剤を投与したマウスでは、肝障害が起こりにくく、機能を失ったSp1の生成やc-Met発現低下は見られませんでした。アルコール性脂肪性肝炎マウスモデルやアルコール性脂肪性肝炎の患者の肝細胞では、機能を失ったSp1が多量に生成していることが分かりました。この細胞死誘導経路は、従来よく知られているカスパーゼ※5を介する細胞死誘導経路とは独立していることを見いだしました。
今後は、アルコール性肝障害の発症メカニズムの理解や、新しい診断法、治療・予防法の開発に大きく寄与することが期待できます。
本研究成果は、米国の科学雑誌『Gastroenterology』(5月1日号)に掲載されます。
背景
トランスグルタミナーゼ(TG2)は、タンパク質のグルタミン-リシン残基間に共有結合を形成する翻訳後架橋修飾酵素です。生体構造の構築や安定化を行う一方、細胞の増殖・分化、アポトーシス(細胞死)に働き、多様な生命現象、ならびに動脈硬化、肝疾患、神経変性疾患、魚りんせんなど、さまざまな病態形成に深く関係しています。TG2の細胞死誘導への関与を報告している論文は数多く見受けられますが、その誘導機構については、ほとんど報告がありませんでした。TG2は、細胞死誘導時に、通常存在している細胞質から細胞核へ移動しますが、核内でのTG2の働きについてはまったく分かっていませんでした。
研究手法と成果
(1)TG2による転写因子の架橋反応
初めに、野生型マウスとTG2遺伝子欠損マウスから肝細胞を単離し、アルコール処理を行い、細胞死に至る様子を観察しました。野生型の肝細胞では、アルコール処理による細胞死の誘導を確認しましたが、TG2遺伝子欠損マウスでは、細胞死を確認することができませんでした。次に、アルコール処理によって、TG2の活性上昇や、TG2が細胞核に集まる様子が観察されることから、TG2の基質について検討したところ、グルタミン残基を多く持つ転写因子Sp1が標的になっていることが分かりました。TG2とSp1とを試験管内で37℃で保温すると、Sp1はTG2の作用で架橋され、高分子量の不活性型Sp1を産生しました。そこで研究チームでは、この機能を失ったSp1架橋体を特異的に認識する抗体を作製し(特許申請中)その様子を観測しました。その結果、アルコール処理した肝細胞ではSp1架橋体が生成し、Sp1の活性・不活性が肝細胞の生死を決定する重要な因子であることが分かりました。
(2)肝細胞増殖因子受容体c-Metの発現低下による肝細胞死
さらに、アルコール処理した肝細胞を用いて、どの遺伝子が影響を受けて変化しているのかを網羅的に調べました。その結果、細胞死や肝機能障害に関連する遺伝子の発現が変化していることが分かり、中でも肝細胞増殖因子受容体c-Metの発現が最も低下していました。c-Metは、Sp1によりその遺伝子発現が調節されており、アルコール処理した肝細胞では、Sp1の活性喪失と相関してc-Metの発現が低下することが分かりました。このため、c-Metに結合するタンパク質リガンドである肝細胞増殖因子を過剰に添加すると、c-Met下流の生存シグナル量が上昇し、アルコール処理をしても肝細胞は死にませんでした。このことは、肝細胞増殖因子とその受容体のシグナルが、肝細胞の生存に必要であるということを示しています。
(3)生体内での検証
TG2によりSp1が架橋し、その活性が消失することで、Sp1が調節しているc-Metの発現が低下し、肝細胞死が起こるという一連の過程(図1)が、実際に生体内で起きているのかどうかを、劇症肝炎モデルマウスおよびアルコール性脂肪性肝炎モデルマウス(図2左)、アルコール性脂肪性肝炎患者(図2右)の肝組織を用いて検討しました。その結果、病気になった肝臓では、TG2が細胞核に存在することや、Sp1架橋体の生成が検出されました。さらに、TG2の阻害剤を投与したマウスや、TG2遺伝子欠損マウスでは、肝障害になりにくいという結果を得ました。こうして細胞レベルで見られた一連の現象が、生体内でも起こっていることを示唆する結果を得ました。
今後の期待
本研究の成果は、TG2により転写因子Sp1が架橋修飾反応を起こし、細胞増殖因子受容体の発現が低下することにより引き起こされるという、新しい細胞死経路の解明に貢献しました。
今後、アルコール肝障害時の肝細胞死以外に、どのようなケースでこの経路が働いているかを明らかにすることが重要です。
また、架橋酵素TG2の阻害剤やTG2遺伝子の欠損により肝障害を改善できることは、アルコール性肝障害の発症メカニズムの理解につながり、今回明らかにした新しい標的の検出や制御が、肝疾患の新しい診断法、治療・予防法の開発に大きく寄与することが期待されます。
発表者
理化学研究所
基幹研究所 分子リガンド生物研究チーム
チームリーダー 小嶋 聡一(こじま そういち)
Tel: 048-467-7938 / Fax: 048-462-4675
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.トランスグルタミナーゼ(TG2)
酵素の1種で、タンパク質同士を共有結合で結びつける(架橋する)作用を示す。タンパク質のグルタミン-リシン残基間に共有結合を形成し、生体構造の構築や安定化を行う一方、細胞の増殖・分化、アポトーシス(細胞死)に働く。 - 2.転写因子Sp1
転写因子はDNAの転写を制御する領域に特異的に結合するタンパク質の仲間で、転写を活性化したり、逆に不活性化したりする。Sp1は発生や分化の過程で重要な役割を担っており、生命の維持に欠かせない代表的転写因子の1つである。 - 3.肝細胞増殖因子受容体c-Met
増殖因子とは生体内において特定の細胞の増殖や分化を促進するタンパク質の総称。さまざまな細胞学的・生理学的過程の調節を行い、細胞表面に存在する受容体タンパク質に特異的に結合することで、生命の維持に必要なシグナルを伝える細胞間の信号物質として働く。この受容体が増殖因子受容体である。肝細胞増殖因子の最も主要な受容体がc-Metである。 - 4.架橋結合
化学反応において、複数の分子が橋を架けたように結合すること。この結合により、生体構造の安定化やタンパク質の機能変換が行われる。 - 5.カスパーゼ
アポトーシスの実行部隊となるタンパク質分解酵素。タンパク質を切断する「はさみ」のような役割を持ち、細胞の生死にかかわる多くのタンパク質を切断することによって、アポトーシスを実行する。
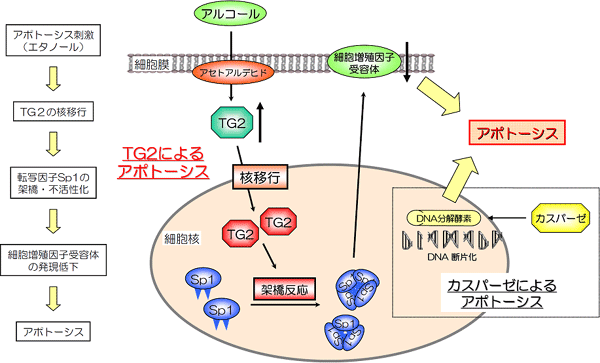
図1 転写因子Sp1の架橋・不活性化を伴うアルコールによる肝細胞死(アポトーシス)
アルコールによる肝細胞死は、架橋酵素TG2により転写因子Sp1が架橋修飾反応を受け、失活する結果、細胞増殖因子受容体c-Metの発現が低下するために起こる、という新しい細胞死経路を解明した。アポトーシスを引き起こすタンパク質であるカスパーゼとは、別の経路で働いていることが分かった。
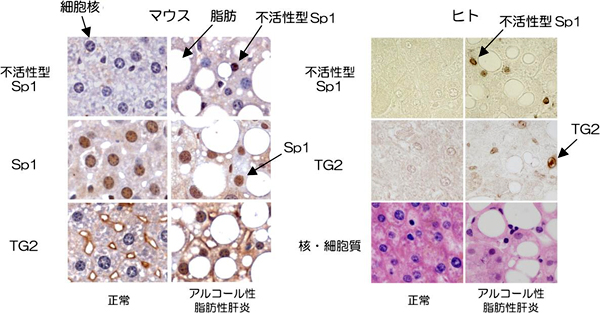
図2 アルコール性脂肪性肝炎のモデルマウスと患者の肝組織
(左)アルコール性脂肪性肝炎のモデルマウス
アルコール性脂肪性肝炎に陥ったマウスの肝臓を厚さ5μmでスライスして染色を行った。細胞核は青色で、それぞれのタンパク質(不活性型Sp1、Sp1、TG2)の量は茶色のシグナル(濃淡)で示した。アルコール投与マウス(アルコール性脂肪性肝炎を発症したマウス)では、Sp1総量の変化は見られないが、不活性型Sp1の量は顕著に増加した。また、TG2が核に多量に存在することを検出した。
(右)アルコール性脂肪性肝炎の患者
アルコール性脂肪性肝炎の患者の肝臓を厚さ5μmでスライスし染色を行った。核における不活性型Sp1とTG2の蓄積が観察できた。
