2009年9月14日
独立行政法人 理化学研究所
国立大学法人東京大学大学院理学系研究科
遺伝情報を正しく読み解くための新規な制御機構を解明
-転移RNAの正しい立体構造を保障する酵素が存在-
ポイント
- 転移RNAの成熟化にかかわる酵素と転移RNAとの複合体の立体構造を決定
- 転移RNAのL字型構造の完成度をチェックする機構の存在を初めて発見
- 転移RNAがかかわる疾患メカニズムの解明に貢献
要旨
独立行政法人理化学研究所(野依良治理事長)と国立大学法人東京大学(濱田純一総長)は、遺伝暗号をアミノ酸へと変換するアダプターとして働く転移RNA(tRNA)※1の成熟化プロセスにおいて、tRNAのL字型構造が正しく構築されていることを見極めた上で、正確な遺伝情報解読を促進するという制御機構が存在することを初めて明らかにしました。これは、理研生命分子システム基盤研究領域の横山茂之領域長(東京大学大学院理学系研究科生物化学専攻教授)、伊藤(後藤)桜子特別研究員、東京大学大学院理学系研究科生物化学専攻の伊藤拓宏助教らによる研究成果です。
生体内では、遺伝情報である核酸配列をタンパク質へと変換する際に、tRNAと呼ばれる一群の分子が、アダプターとして働きます。tRNAは、まだ機能を持たない前駆体として生成され、その後、多くの酵素がかかわる複雑な成熟化プロセスを受けて初めて機能を発揮することが知られています。しかし、多くの酵素反応からなる成熟化プロセス全体が、どのような制御によって進行しているのかということは分かっていませんでした。
研究グループは、tRNAの成熟化にかかわる酵素「aTrm5」とtRNAの複合体の立体構造を決定し、aTrm5が、tRNAに正確な遺伝情報解読を促進する修飾を導入する機能を持つとともに、tRNAの立体構造が正しく構築されているかどうかを見極める機能を持つことを見いだしました。不完全な立体構造を持つtRNAは、遺伝情報を正しく解読することができず、タンパク質を合成できなかったり、誤ったタンパク質を生成したりします。従って、立体構造が正しく構築されたtRNAを選択して遺伝情報解読に用いることで、遺伝情報の正確な解読が保障されると考えられます。これまで、遺伝情報をタンパク質へと変換する過程でのさまざまな制御機構が知られていましたが、今回見いだした制御機構は、遺伝情報をタンパク質へと変換する際に、アダプターとして働くtRNAの立体構造をチェックすることで、正確な変換を保障するという、まったく新しい制御機構といえます。また、この研究成果は、tRNAがかかわる疾患メカニズムの解明にも貢献すると期待できます。
本研究成果は、「ターゲットタンパク研究プログラム」の一環として行われたもので、米国の科学雑誌『Nature Structural & Molecular Biology』(10月1日号)に掲載されるに先立ち、オンライン版(9月13日付け:日本時間9月14日)に掲載されます。
背景
ほとんどの生体内反応は、タンパク質によってつかさどられています。従って、生命の本質である遺伝情報に基づいてタンパク質を合成する反応は、生命活動の根幹をなす重要な反応といえます。タンパク質合成の際には、tRNAと呼ばれる一群の分子が、遺伝情報である核酸配列に書き込まれた情報を、タンパク質を構成するアミノ酸へと変換するアダプターとして働きます。
tRNAは、まず前駆体tRNAとして生成され、その後、多くの酵素がかかわる複雑な成熟化プロセスを経て、初めてアダプターとしての機能を持つことが知られています。成熟したtRNAはL字型立体構造をとっており、L字の片方の末端(アンチコドン※2)で遺伝情報を解読し、もう一方の末端(CCA末端※3)に、その遺伝情報に対応するアミノ酸を結合することで、遺伝情報からアミノ酸への変換を行っています(図1)。tRNAの成熟化プロセスには、tRNAの大きさを整えるための切断反応や、tRNAに対する化学修飾基の付加などが含まれます。付加される化学修飾基は、100種類以上あり、tRNA上のさまざまな位置に付加されることが知られています。それらの修飾は、tRNAのL字型立体構造を安定化するために必要な修飾と、アンチコドンによる遺伝情報解読のために必要な修飾とに大別されます。しかし、それらの必要な修飾が、どのような制御のもとでtRNAに導入され、成熟したL字型tRNAを作り出しているのかは謎のままでした。
今回、研究グループは、アンチコドンの隣の位置にメチル化修飾を導入する酵素「aTrm5」を対象として研究を行いました。aTrm5によって導入されるメチル化修飾は、アンチコドンによる遺伝情報解読を促進的かつ正確に制御するために重要であること、すべての生物において存在すること、特に真核生物と古細菌では多くの種類のtRNAに導入されること、また、aTrm5はL字型を構築しているtRNAに限って修飾できることが知られていました。そこで研究グループは、aTrm5による修飾が、L字型構造を完成しているtRNAだけに選択的に導入されることに着目し、aTrm5のtRNA認識機構について研究しました。
研究手法
研究グループは、古細菌Methanocaldococcus jannaschii由来のaTrm5と、アミノ酸のロイシンに対応するtRNA(tRNALeu)を用い、メチル基の供与体※4であるS-アデノシル-L-メチオニン(AdoMet)という低分子の存在下で複合体を形成させた時に、X線結晶構造解析に適した複合体結晶が調製可能であることを見いだしました。また、この複合体結晶の形成条件を応用することで、アミノ酸のシステインに対応するtRNA(tRNACys)を用いた場合でも、X線結晶構造解析に適した複合体結晶を調製することに成功しました。
これら2種類のaTrm5-tRNA-AdoMet複合体結晶について、大型放射光施設のSPring-8と高エネルギー加速器研究機構(KEK)のPhoton Factoryを用いてX解回折実験を行い、立体構造を決定しました。得られた立体構造から、aTrm5がこれまでには知られていないユニークな方法でtRNAのL字型立体構造を認識することを見いだし、この認識機構について生化学的な方法で検証を行いました。
研究成果
決定したaTrm5-tRNA-AdoMet複合体の立体構造(図2)から、aTrm5が立体構造上3つの部分(D1、D2、D3)で構成されていることが分かりました。メチル化反応の活性中心※5は、D2とD3の境界にあり、D2とD3が協同して、tRNAのメチル化を受ける部位(アンチコドン隣位)を活性中心に配置しています。一方、D1は、一定の構造を取らないリンカー配列によってD2とつながっており、D2-D3部分とは独立な機構でL字型の角の部分の立体構造を認識していることが分かりました。L字型の角にあたる部分は、修飾が不十分なtRNAでは最も不安定な箇所です。L字型の角がきちんと形成されていることは、tRNAの成熟化プロセスが完了し、L字型が完成している指標になると考えられています。生化学的な方法で検証したところ、D1が、L字型の角の立体構造を指標としてtRNAの完成を確認すると、aTrm5とtRNAとの親和性が上昇し、D2-D3によるメチル化修飾が達成されるという、aTrm5のtRNA認識機構の詳細が判明しました。
これらの結果から、aTrm5は、tRNAの成熟化プロセスで、tRNAのL字型立体構造が正しく構築していることを見極めた上で(D1による機能)、遺伝情報解読を促進する修飾を導入する(D2-D3による機能)という制御を行っており、L字型立体構造が完成したことをチェックする役割を担っていると考えられます(図3)。
今後の期待
今回、tRNAの複雑な成熟化プロセスにおいて、aTrm5がL字型構造を正しく構築したtRNAを選択し修飾反応を行う、という分子機構を初めて見いだしました。これまで謎であった、tRNAの成熟化プロセスの制御機構を初めて明らかにしたという点で、非常に重要な成果といえます。また、今回明らかにした“tRNAのL字型の保障機構”という観点で、既知のtRNA成熟化酵素とtRNAの複合体の立体構造を見直すと、aTrm5以外にも複数の酵素が本来の修飾反応を行うと同時に、tRNAのL字型構造を認識している可能性が指摘できます。すなわち、今回の研究成果は、ある1つの酵素によるtRNA認識機構にとどまらず、tRNA成熟化プロセス全体の制御機構について、ひいては、正確な遺伝情報の解読に基づく正確なタンパク質合成を保障するための制御機構について、新規な機構を提唱したといえます。さらに将来的には、tRNAがかかわる疾患メカニズムの解明にも貢献すると期待できます。
発表者
理化学研究所
生命分子システム基盤研究領域 領域長
国立大学法人東京大学大学院理学系研究科
生物化学専攻 教授
横山 茂之(よこやま しげゆき)
Tel: 045-503-9196 / Fax: 045-503-9195
報道担当
独立行政法人理化学研究所 広報室 報道担当Tel:048-467-9272 / Fax:048-462-4715
国立大学法人東京大学大学院理学系研究科・理学部
広報室 横山 広美(よこやま ひろみ)
Tel: 03-5841-8856 / Fax: 03-5841-1035
補足説明
- 1.転移RNA(tRNA)
遺伝情報は、3つの核酸が1組の暗号(遺伝暗号)となって、1つのアミノ酸を規定する。tRNAは、遺伝暗号をアミノ酸へと変換する際にアダプターとして働く分子である。これらのアミノ酸は、生体におけるタンパク質合成工場であるリボソームにおいて、互いに連結されてタンパク質となる。 - 2.アンチコドン
タンパク質を構成するアミノ酸は、主に20種類ある。生体内には、それぞれのアミノ酸に対応するtRNAが存在しており、それらは、対応するアミノ酸を規定する遺伝暗号に相補的な核酸配列を内在している。この核酸配列をアンチコドンと呼ぶ。 - 3.CCA末端
tRNAにおいて、アミノ酸が結合する3'末端には共通の配列CCAが存在し、これをCCA末端と呼ぶ。アミノ酸は、対応するtRNAのCCA末端に可逆的に結合しており、リボソーム上でCCA末端から外れてタンパク質の構成因子となる。 - 4.供与体
AdoMetには、反応性に富むメチル基がある。生体内で起こる多くのメチル化反応において、このメチル基が、メチル化を受ける分子に転移する。AdoMetのように、メチル基を与える分子のことをメチル基の供与体と呼ぶ。 - 5.活性中心
酵素において、触媒する化学反応を行う部位のこと。
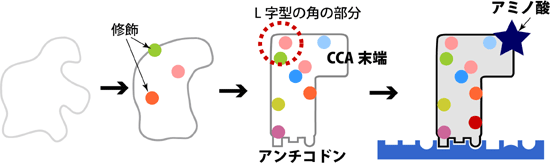
図1 tRNAの成熟化プロセス
前駆体tRNAは、種々の修飾の付加などによって安定なL字型構造を取るようになる。L字型の一方の末端(アンチコドン)で遺伝暗号を解読し、もう一方の末端(CCA末端)にはアンチコドンに応じたアミノ酸を結合している。赤い点線で囲んだL字型の角の部分は、修飾が不十分なtRNAにおいては最も不安定であり、従って、この部分がきちんと形成されていることは、L字型構造が完成していることの指標となると考えられる。
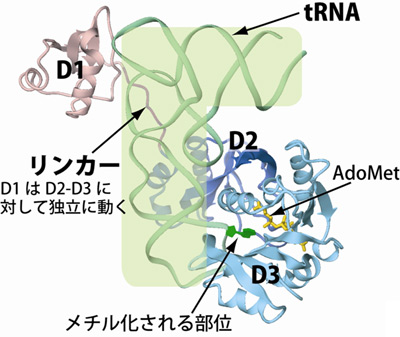
図2 aTrm5-tRNA-AdoMet複合体の立体構造
L字型構造のtRNA(緑のリボン)をaTrm5が認識している様子が明らかになった。aTrm5は、立体構造上3つのドメインD1(ピンク)、D2(青)、D3(水色)からなり、D1とD2の間は一定の構造をとらないリンカー(紫)によってつながれている。メチル化を受けるtRNA部位(アンチコドンの隣位)を緑で、メチル基の供与体であるAdoMetを黄色で示した。
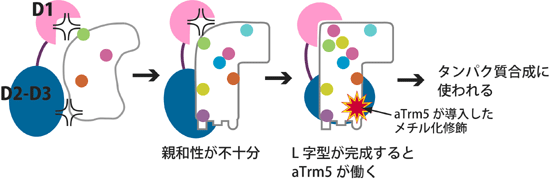
図3 aTrm5によるtRNAのL字型構造のチェック機構
tRNAの成熟化が不十分でL字型になっていない段階では、aTrm5はtRNAに結合することができない。L字型に近い構造が形成されても、まだ修飾が不十分でL字型の角の部分がきちんと形成されていない段階では、D1がtRNAに結合できず、結果としてaTrm5全体がtRNAに結合できない。L字型構造が完成してL字型の角の部分がきちんと形成されると、D1はtRNAに結合できるようになり、aTrm5とtRNAとの親和性が上昇し、初めてaTrm5がtRNAに修飾を導入(メチル化)することができる。すなわちaTrm5は、L字型構造が完成しているtRNAにだけ修飾を導入するという制御を行っている。
