ポイント
- 日本人のゲノムワイド関連解析で同定
- 人種を超えて2型糖尿病患者の腎症発症に関与
- アセチルCo-Aカルボキシラーゼベータの阻害薬が、糖尿病腎症の新たな治療薬候補に
要旨
独立行政法人理化学研究所(野依良治理事長)は、日本人2型糖尿病※1患者のゲノムワイド関連解析※2の結果から、遺伝子「ACACB(エーシーエーシービー)」が糖尿病腎症※3の関連遺伝子であることを発見しました。理研ゲノム医科学研究センター(中村祐輔センター長)内分泌・代謝疾患研究チームの前田士郎チームリーダーらによる研究成果です。
糖尿病患者は、世界的に増加しており、日本人でも40歳以上の3人に1人が糖尿病、あるいはその予備軍であるといわれています。糖尿病腎症は、糖尿病患者の寿命を左右する最も重要な合併症です。糖尿病腎症が原因で腎不全となり、透析療法が必要となる人は年々増加し、現在は年間16,000人以上となっています。糖尿病患者のうち腎症が進行するのは3~4割にも及び、その発症には遺伝的な要素(なりやすい体質)が関係していると考えられていますが、これまで詳しいことはまったく分かっていませんでした。
研究チームは、1,312人の2型糖尿病患者の血液から抽出したDNAを用いて、ケース・コントロール関連解析※4を行い、ACACB遺伝子内のわずかな違いである一塩基多型:SNP(スニップ)※5が、糖尿病腎症と関係していることを突き止めました。ACACB遺伝子は、アセチルCo-Aカルボキシラーゼベータという酵素を作る遺伝子ですが、糖尿病腎症との関係は不明でした。解析の結果、このSNPの危険対立遺伝子頻度※6は、一般人口では約15%で、この危険対立遺伝子を持つと、糖尿病腎症を発症するリスクが約1.6倍に高まると推測される結果でした。さらに、シンガポールの国立シンガポール大学やデンマークのステノ糖尿病センター、米国のウェインフォレスト大学との共同研究の結果、このACACB遺伝子は日本人だけでなく、人種を超えて2型糖尿病患者の腎症発症に強くかかわる遺伝子であることが分かりました。また、培養細胞を使用した実験結果から、ACACB遺伝子の危険対立遺伝子ではACACB遺伝子の発現量が多くなると考えられ、アセチルCo-Aカルボキシラーゼベータの作用を阻害するような薬剤が新たな治療薬となる可能性もあります。これまで、ACACB遺伝子が糖尿病腎症とかかわることはまったく知られておらず、今後、糖尿病腎症発症メカニズムの解明とともに、新たな治療法や予防法の開発につながることが期待できます。
本研究成果は、米国の科学雑誌『PLoS Genetics』オンライン版(2月12日付)に掲載されます。
背景
糖尿病患者は、世界的に増加しており、厚生労働省2007年度国民健康・栄養調査によると、日本人でもその患者数は890万人、予備軍を含めると2,210万人となり、40歳以上の3人に1人は糖尿病あるいはその予備軍であるといわれています。糖尿病腎症(図1)は糖尿病の代表的な合併症で、糖尿病腎症が原因で腎不全となり、透析療法が開始される人は年々増加しており、現在年間16,000人以上となっています(図2)。
糖尿病腎症は、心筋梗塞などの危険も高くなることから、糖尿病患者の寿命を左右する重大な合併症と考えられています。しかし、現時点では確実な治療法が無く、その発症のメカニズムも十分に解明されていません。一方、糖尿病腎症の発症には遺伝的な要素(なりやすい体質)が関係していることも分かっていますが、糖尿病腎症の発症にかかわる遺伝子については、これまでほとんど知られていませんでした。
研究手法と成果
研究チームは、国立大学法人滋賀医科大学や東京女子医科大学など、日本国内の複数の施設で収集した1,312人の2型糖尿病患者の血液から抽出したDNAを用いて、76,767カ所のSNPsを解析した結果、ACACB遺伝子内のSNP(図3)と糖尿病腎症が強く関連することを突き止めました(図4、P値※4 = 1.4 × 10-6)。このSNPとの関連を、別の日本人2型糖尿病2集団(200人+264人、合計464人)、シンガポール人2型糖尿病集団(411人)、欧米人2型糖尿病2集団(157人+908人、合計1,065人)で検証したところ、すべての集団で同じ結果が得られ、ACACB遺伝子は人種を超えて2型糖尿病の強力な関連遺伝子であることが分かりました(図5、P値(全体)= 2.27 × 10-9)。さらに、ヒトの腎臓の培養細胞を使用した実験では、ACACB遺伝子内のSNPが糖尿病腎症の危険対立遺伝子型の場合、そうではない遺伝子型に比べて、ACACB遺伝子の発現量が約1.8倍多くなることも分かりました(図6)。
今後の期待
今回、ACACB遺伝子内のSNPが糖尿病腎症と強く関連することを発見しました。ACACB遺伝子から作られるアセチルCo-Aカルボキシラーゼベータは、脂肪組織などで脂肪からできる遊離脂肪酸の代謝にかかわる酵素で、その働きが強くなると脂肪酸の燃焼が低下することが知られています(図7)。この遊離脂肪酸は、活性酸素の働きなどにより、さまざまな組織障害の原因になることも知られており、今回の成果は、糖尿病腎症発症メカニズムの解明につながるとともに、新たな糖尿病腎症の治療薬開発に貢献することが期待できます。
さらに今回の成果と、今後新たに発見される関連遺伝子を組み合わせることで、糖尿病腎症になりやすいハイリスクの人を診断することが可能となります。ハイリスクの人に積極的な予防対策を講じることで、より効率的な糖尿病腎症予防が可能になると考えられます。
発表者
理化学研究所
ゲノム医科学研究センター 内分泌・代謝疾患研究チーム
チームリーダー 前田 士郎(まえだ しろう)
Tel: 045-503-9595 / Fax: 045-503-9567
お問い合わせ先
横浜研究推進部 企画課Tel: 045-503-9113 / Fax: 045-503-9117
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.2型糖尿病
糖尿病は血糖値が持続的に高くなる病気だが、代表的な糖尿病として若年者に急激に発症する1型糖尿病と、成人になってから緩徐に発症する2型糖尿病(成人糖尿病)がある。国によって差はあるが、糖尿病の80~90%以上は2型糖尿病であり、肥満などによりインスリンが効きにくくなること(インスリン抵抗性)と、膵臓(すいぞう)のランゲルハンス島からのインスリン分泌が低下すること(インスリン分泌低下)で引き起こされると考えられている。欧米人では肥満の程度が強く、2型糖尿病の発症にはインスリン抵抗性が強くかかわっていると思われるが、日本人をはじめとした東アジア人では肥満の程度は欧米人に比べて軽いため、インスリン分泌低下が、より深くかかわっているのではないかと考えられている。 - 2.ゲノムワイド関連解析
糖尿病などのありふれた病気とかかわりのあるSNPを、全ヒトゲノムの中から見つけ出すために、全ヒトゲノム上の代表となるSNPs(数十万カ所以上といわれている)についてケース・コントロール関連解析( ※4参照)を行うこと。 - 3.糖尿病腎症
糖尿病の3大合併症(網膜症、腎症、神経障害)の1つ。高血糖が持続することにより腎臓の糸球体という組織が主に障害を受け( 図1参照)、タンパク尿の出現に始まり、やがて腎不全となり透析導入に至る難治性の腎臓病である。現在日本をはじめ世界的にも増加しており、透析導入の原因の第1位となっている。 - 4.ケース・コントロール関連解析、P値
疾患の感受性遺伝子を見つける方法の1つ。疾患を持つ群と疾患を持たない群とで、遺伝子多型の頻度に差があるかどうかを統計学的に比較する解析方法。検定の結果得られたP値(偶然にそのようなことが起こる確率)が低いほど、関連が強いと判定できる。 - 5.一塩基多型:SNP(スニップ)
ヒトの染色体にある全DNA情報(ヒトゲノム)は、30億にもおよぶ文字の並び(塩基配列)で構成されている。この文字の並びは暗号(遺伝情報)となっており、その99.9%は全人類で共通だが0.1%程度に個人差(遺伝子多型)のあることが分かっている。多くの遺伝子多型は違っていても影響は無いが、一部は病気のなりやすさなどに関係していると考えられている。一塩基多型(SNP)とは、その文字の並びが1つだけ異なっているもので( 図3参照)、30億塩基の並びの中におよそ1,000万カ所ある。 - 6.危険対立遺伝子頻度
SNPなどの遺伝子多型における各々のタイプを、対立遺伝子(アレル)と呼ぶ。一般人口で多く認められるものをメジャーアレル、少ない方をマイナーアレルと呼び、疾患の発症リスクを高めるものをリスクアレル(危険対立遺伝子)と呼ぶ。例えば、病気と関連するあるSNPがあり、対立遺伝子がA(アデニン)とC(シトシン)で一般人口におけるAの頻度が60%、Cの頻度が40%であると、AがこのSNPのメジャーアレル、Cがマイナーアレルとなる。もし疾患群でA対立遺伝子の頻度が一般集団よりも有意に高くなっていれば、Aが危険対立遺伝子となる。各個人は2本の染色体を持っていることから、危険対立遺伝子頻度は以下の式で計算される。
危険対立遺伝子頻度=(2a+b) ÷ 2n
a:危険対立遺伝子を2つ持つ(ホモ接合体)人の数
b:危険対立遺伝子とそうでない対立遺伝子を1つずつ持つ(ヘテロ接合体)人の数
n:全体の人数
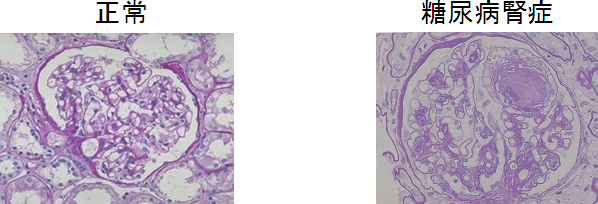
図1 糖尿病腎症の腎臓
腎臓組織の一部である糸球体は、毛細血管が糸球のように丸く束ねられた構造をしている。血液をろ過して尿の元(現尿)を作る働きを持っており、障害を受けるとタンパク質がもれたり(タンパク尿)、毒素の排泄が低下したり(尿毒症=腎不全)する。糖尿病腎症の糸球体(右)では、細胞外基質(コラーゲン)が蓄積し、毛細血管構造が破壊されている。
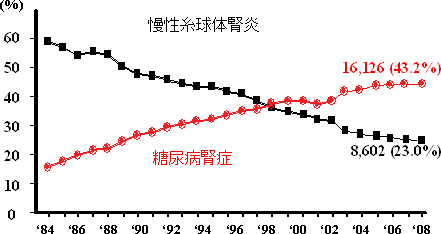
図2 透析導入原疾患の年次推移
かつては慢性糸球体腎炎が透析導入の最大原因であったが、糖尿病腎症の増加が著しく、1998年以降は糖尿病腎症が透析導入原因のトップとなった。2008年は、1年間に糖尿病腎症が原因で透析導入された人は16,126人であった。(日本透析医学会、わが国の慢性透析療法の現況、2008年末より)
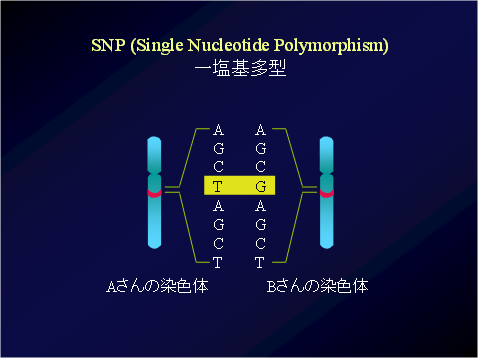
図3 一塩基多型(SNP)
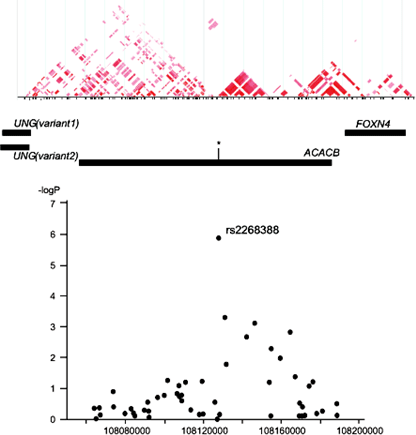
図4 ACACB遺伝子内のSNPと糖尿病腎症との関連
日本人2型糖尿病患者1,312人での解析結果。縦軸はP値の対数表示で、糖尿病腎症と最も強い関連があったのはrs2268388でP=1.4×10-6。
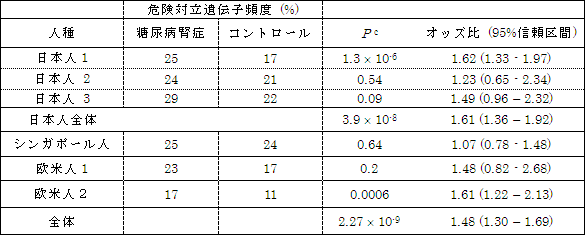
図5 ACACB遺伝子のSNPと糖尿病腎症との関連(複数の民族による検証結果)
すべての2型糖尿病集団において、糖尿病腎症を発症した集団は、コントロール(2型糖尿病で糖尿病腎症を発症していない人の集団)に比べて、危険対立遺伝子頻度が高くなっていた。オッズ比:危険対立遺伝子を持つ場合の危険度の指標。
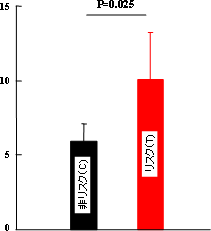
図6 各対立遺伝子の転写活性増強効果
危険(リスク)対立遺伝子型(赤)では、非リスク(黒)に比べ、遺伝子mRNAの転写活性が約1.8倍高くなっている。
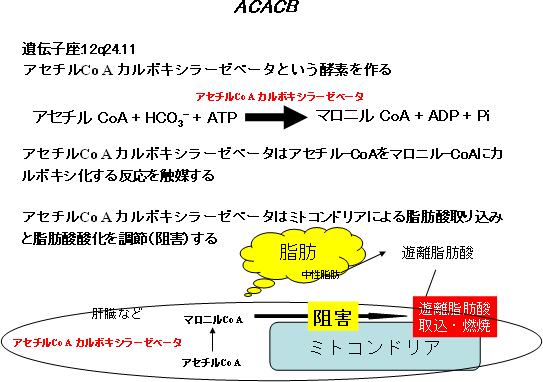
図7 ACACB遺伝子の働き
