2010年2月18日
独立行政法人 理化学研究所
異常糖タンパク質の分解モデルに新しい機構を発見
-糖鎖の構造から品質管理を高める糖タンパク質分解のメカニズムを探る-
ポイント
- 出芽酵母の細胞質から遊離糖鎖の構造を解析する手法を確立
- 遊離糖鎖は、異常糖タンパク質の分解だけで作られることが判明
- 遊離糖鎖の構造を詳細に解析し、糖タンパク質分解の新規メカニズム解明が可能に
要旨
独立行政法人理化学研究所(野依良治理事長)は、パン酵母として知られる出芽酵母※1を用いて、細胞質に蓄積しているN型糖鎖※2由来の糖鎖(遊離糖鎖※3)の構造を決定する方法の開発に成功しました。これは、理研基幹研究所(玉尾皓平所長)糖鎖代謝学研究チームの鈴木匡チームリーダー、平山弘人特別研究員と独立行政法人 産業技術総合研究所・糖鎖医工学研究センター(地神芳文招聘研究員)らによる共同研究の成果です。
生物の構成成分であるタンパク質が合成される際には、正しい構造を持つ機能的なタンパク質を選別するとともに、出来損ないのタンパク質(異常タンパク質)を正しい構造に戻したり、分解したりする“品質管理機構”が働いています。このタンパク質品質管理や分解機構の破綻は、細胞の変性や死を引き起こし、アルツハイマー病をはじめとしたさまざまな重篤な疾患をもたらすことが知られています。タンパク質が受ける修飾反応の中で、糖鎖の付加は、生物の最も普遍的な反応の1つですが、最近の研究によると、細胞は、タンパク質上のN型糖鎖の構造の微小な違いを利用して、異常糖タンパク質の分解を制御するなど、糖タンパク質の品質管理を行っていることが明らかになってきました。
今回、出芽酵母の細胞質に蓄積する遊離糖鎖を解析したところ、すべての遊離糖鎖は、品質管理機構によって選別された異常糖タンパク質から切り出されたものであることが分かりました。また、細胞質で遊離糖鎖を分解する唯一の酵素のマンノシダーゼ※4Ams1pを欠損させた変異株では、遊離糖鎖が異常糖タンパク質上に存在する糖鎖の構造をそのまま反映していることが分かりました。この遊離糖鎖を精密に構造解析した結果、分解される異常糖タンパク質の糖鎖構造は、現在考えられているよりも多様性があることを明らかにしました。さらに、糖タンパク質の構造異常を引き起こす処理(ERストレス処理※5)を細胞に施したところ、これまで糖タンパク質を分解するための目印として重要とされていたM7C※6と呼ぶ糖鎖構造は増えず、ほかの糖鎖構造が増加することを見いだしました。これらの糖鎖構造を解析した結果、ERストレスのような状況下の細胞では、既知の糖鎖認識経路に依存しない分解経路や、糖鎖修飾を行うゴルジ体※7への輸送経路を増強させて、結果的に異常タンパク質の蓄積を防ぐ、という新規な分解機構が存在する可能性を示すことができました。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』(4月号)に掲載されるに先立ち、オンライン版(2月11日付け:日本時間2月12日)に掲載されました。
背景
ヒトをはじめとする真核生物では、遺伝情報を基に生み出したタンパク質に、糖鎖の付加という翻訳後修飾が広く起こることが知られています。この修飾は、細胞の発生・分化、細胞間相互作用、組織形成、タンパク質自体の折り畳み(フォールディング)の促進など、さまざまな生体内のプロセスに関与することが知られています。特に、N型糖鎖は、正しくフォールディングしたタンパク質と異常タンパク質を判別するための目印(タグ)としても機能するなど、細胞小器官の1つ小胞体(ER)※8で営まれる糖タンパク質(糖鎖が結合したタンパク質)の小胞体品質管理機構(ERQC)※9や小胞体関連分解(ERAD)※10において重要な役割を果たしています。
一方、出芽酵母からヒトにいたるまでの真核細胞の細胞質には、タンパク質や脂質などと結合しない“遊離”状態の糖鎖(遊離糖鎖)が存在することが古くから知られています。しかし、遊離糖鎖が生成、分解される分子メカニズムや、遊離糖鎖の代謝に対する生物学的重要性については不明な部分が多く、その解明が待たれています。
出芽酵母は、遺伝子の導入・破壊などの発現制御が容易で、小胞体におけるN型糖鎖の生合成経路や糖タンパク質のERQCが、高等生物との間で非常に良く保存されていることが知られています。このため研究グループは、遊離糖鎖の代謝機構の解明や機能研究のモデル系として出芽酵母を選択し、出芽酵母が生成する遊離糖鎖の構造と生成・分解経路を解析する手法の開発に取り組みました。
研究手法と成果
(1)遊離糖鎖の単離に成功
研究グループは、マウスなどの動物細胞ですでに用いられている遊離糖鎖の単離と蛍光ラベルの手法を用いて、出芽酵母の細胞質から遊離糖鎖の単離を試みました。その結果、取得した糖鎖のほとんどは、細胞壁※11成分の生合成中間体と予測できる糖鎖で、その成分は、β-1,6グルカン※12と呼ぶ多糖成分であること、さらにエンド-β1,6-グルカナーゼという酵素でβ-1,6グルカンを処理することで、遊離糖鎖だけを単離できることを見いだしました。出芽酵母は、すでにさまざまな変異株が確立されているため、今回の手法で取得できる遊離糖鎖の質的、量的変化を、株間や培養条件の違いで比較して、遊離糖鎖の生成機構や糖タンパク質の分解機構を解明することに挑みました。
(2)異常糖タンパク質を分解する唯一の酵素
まず、異常糖タンパク質から糖鎖を切り出すPng1p※13 という酵素を欠損した出芽酵母の変異体を用いて糖鎖解析を試みました。哺(ほ)乳動物細胞では、Png1pによらない遊離糖鎖の生成機構の存在が知られているので、Png1pを欠損しても遊離糖鎖は検出できます。しかし出芽酵母の場合、遊離糖鎖はまったく検出されず、Png1pだけが、遊離糖鎖を切り出す酵素であることが分かりました。また、この切り出した遊離糖鎖の分解に関与する酵素は、マンノシダーゼの1つAms1pだけであることも見いだしました。従って、Ams1pを欠損させた出芽酵母では、異常糖タンパク質から切り出された糖鎖構造が、分解されることなくそのまま保たれることが分かりました(図1)。
さらに、Ams1pが遊離糖鎖を分解するには、これまで細胞質から液胞に移動する必要があるとされてきましたが、この移動を不可能にした変異体を用いて解析したところ、細胞質でもAms1pは機能することが明らかとなりました。
(3)異常糖タンパク質の分解経路の多様性
これまで、異常糖タンパク質を異常と認識するには、Htm1pというマンノシダーゼとYos9pというレクチン※14が重要であることが知られています。具体的には、Htm1pによって糖鎖上の特定のマンノースが削られると、M7Cと呼ばれるYos9pが認識する際の鍵となる糖鎖構造が露出し、Yos9pがこれを認識して異常タンパク質を小胞体の外へ促す、というメカニズムがいくつかの例で示されています(図2A)。そこで、Ams1p欠損株の遊離糖鎖が、異常糖タンパク質上に存在する糖鎖の構造をそのまま反映していることを利用して、Ams1p欠損株に存在する9種の主要な遊離糖鎖の構造を精密に構造解析したところ、M7Cは遊離糖鎖全体の23%であるのに対し、M7Cの前駆体(M8B)は全体の47%を占めることが分かりました。この結果は、(1)糖タンパク質が異常と認識されるためには、糖タンパク質が持つ複数の糖鎖の一部にM7Cがあれば十分であるか、(2)糖タンパク質によっては、Htm1p-Yos9pに依存しない経路が存在するか、どちらかの可能性によるものと考えられます。さらに、ゴルジ体に特異的に局在する酵素で修飾された遊離糖鎖も21%も見つかったため、異常糖タンパク質の一部は、分解される前に小胞輸送※15によってゴルジ体に到達していることが分かりました。糖鎖の多様性を生み出す一因には、ゴルジ体での糖鎖の修飾があることを発見するとともに、一様とされてきた異常糖タンパク質の分解経路が、実は多様であることが分かりました(図2B)。
(4)ストレス下での異常糖タンパク質の分解経路の多様性
細胞にさまざまなERストレスと呼ばれる処理を施すと、小胞体で異常糖タンパク質の生成が引き起こされます。出芽酵母にESストレスとして、小胞体でのタンパク質の正しいフォールディングを阻害するジチオスレイトールという薬剤で処理すると、M8Bを含むさまざまなM7Cの前駆体や、ゴルジ体で糖鎖修飾を受けた遊離糖鎖が顕著に増加することが明らかになりました(図3)。この結果は、異常タンパク質が大量に生産するような特殊条件下では、従来知られていたHtm1p-Yos9pの経路による異常糖タンパク質認識機構だけでなく、精密な糖鎖の認識を経ずにタンパク質を小胞体外へ搬送し、無差別に分解したりする機構が存在し、異常糖タンパク質の細胞内の蓄積を防いでいることを示すことができました(図2C)
今後の期待
これまで小胞体における糖タンパク質の分解機構の解析は、モデルの糖タンパク質を利用したものがほとんどですが、使用している糖タンパク質に特異的な反応を見ている可能性もあり、見いだされていた経路がどれだけ一般性を持つのかは不明でした。今回、糖鎖全体を解析する手法を確立したことによって、さまざまな状況における糖タンパク質分解の質的、量的変化の全体を解析することが可能となり、これまで明らかにできなかった経路の一般性や、新たな分解機構の解明に威力を発揮することが期待できます。
タンパク質の品質管理や分解機構の破綻は、細胞の変性や死を引き起こし、アルツハイマー病やプリオン病などフォールディング病と総称される重篤な疾患の原因になりえることが知られています。N型糖鎖は、タンパク質品質管理や分解機構に重要な役割を果たしていることが知られていますが、そのメカニズムの詳細はいまだ明らかではありません。今回、出芽酵母を用いて遊離糖鎖の詳細な構造解析の手法を初めて確立し、これらの糖鎖がすべて異常糖タンパク質から切り出されてきたものであることを明らかにしました。今後、出芽酵母のさまざまな変異体を用いて糖鎖構造を解析することで、糖タンパク質分解機構の詳細を明らかにできると期待できます。特に、ERストレス条件下では、未知の糖タンパク質分解機構が働いていることを示したことで、新規な分解機構の解明に貢献できます。
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究領域
システム糖鎖生物学研究グループ
糖鎖代謝学研究チーム
チームリーダー 鈴木 匡(すずき ただし)
Tel: 048-467-9628 / Fax: 048-467-9626
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.出芽酵母
パン酵母やビール酵母などさまざま酵母が知られているが、出芽によって増えるのでこの名がある。特にパン酵母は、細胞生物学や遺伝学実験のモデル生物として広く使われている。 - 2.N型糖鎖
タンパク質中のアスパラギン残基に結合する糖鎖。 - 3.遊離糖鎖
タンパク質や脂質に結合していない糖鎖。ここでは、N型糖鎖からPNGaseによって遊離された糖鎖をいう。 - 4.マンノース、マンノシダーゼ
マンノースは、糖鎖を形成する単糖構成成分の1つ。N型糖鎖のコア構造を形成する。
このマンノースを加水分解する酵素がマンノシダーゼ。マンノースを糖鎖から切断する。 - 5.ERストレス
小胞体(ER)において、正常な高次構造をとれないタンパク質が蓄積し、それによって細胞にかかるストレス状態を指す。 - 6.M7C
Htm1pによって作られる主要な糖鎖構造。 - 7.ゴルジ体
細胞小器官の1つ。数多くの糖転移酵素が存在し、タンパク質の糖鎖修飾に大きな役割を果たしている。 - 8.小胞体(ER)
細胞小器官の1つ。分泌経路にのるタンパク質を合成する場で、N型糖鎖の付加やタンパク質の正しい折り畳みが行われる。 - 9.小胞体品質管理機構(ERQC)
小胞体で生合成された糖タンパク質は、正しい高次構造(折り畳みや、ほかの糖タンパク質との複合体形成)をとったときだけ分泌経路にのることができ、その過程がうまくいかない糖タンパク質は小胞体にとどめおかれる。この機構を、工場での品質管理に例えて名づけられた。 - 10.小胞体関連分解(ERAD)
小胞体で生合成された糖タンパク質が正しい高次構造をとれなかった場合、そのような異常糖タンパク質を小胞体から細胞質へ放出し、分解する機構。 - 11.細胞壁
細菌やカビ、植物などの細胞にみられる、細胞を取り囲むように形成している構造。 - 12.β-1,6グルカン
出芽酵母の細胞壁成分の1つ。グルコースがβ-1,6グリコシド結合で連なったポリマー。 - 13.Png1p
出芽酵母に存在する細胞質ペプチド: N-グリカナーゼ(PNGase)。PNGaseは糖タンパク質からN型糖鎖を切り出す脱糖鎖酵素。バクテリア由来の酵素は糖鎖研究用の試薬として重要であるが、ヒトや酵母の細胞質に存在するPNGaseは異常糖タンパク質の分解にかかわっている。 - 14.レクチン
糖鎖に結合するタンパク質の総称。 - 15.小胞輸送
小胞は細胞内に形成される膜に包まれた袋状の構造であり、小胞によるタンパク質を含む物質輸送は小胞輸送と呼ばれる。
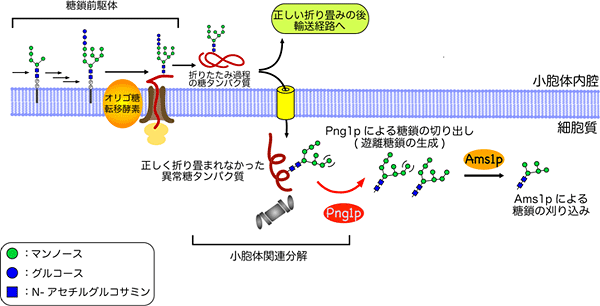
図1 今回明らかになった、出芽酵母の遊離糖鎖生成経路
正しく折り畳まれなかった異常糖タンパク質は、小胞体外へ排出されて、Png1pによって糖鎖が切り離される。さらに遊離糖鎖は、Ams1pにより分解される。
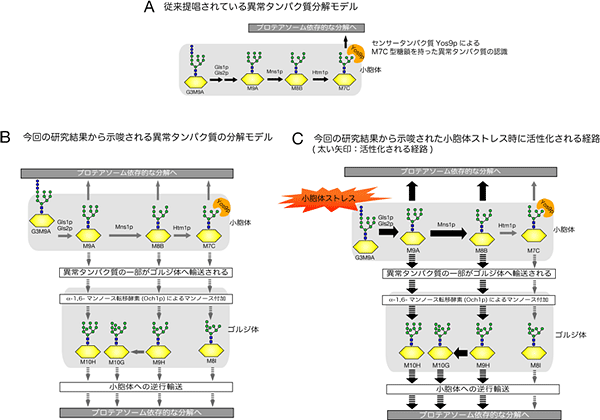
図2 異常糖タンパク質の分解モデルの多様性
A:従来の異常糖タンパク質分解モデル
異常糖タンパク質は、G3M9A、M9A、M8B、M7Cの順に構造が変化した後、プロテアソ-ム依存的な分解へ進む。
B:新しい異常糖タンパク質分解モデル
異常糖タンパク質は、M9A、M8Bの段階でもプロテアソーム依存的な分解へ進むだけでなく、M9A、M8B、M7Cの段階で、ゴルジ体へも運ばれる。
C:ERストレス時の異常糖タンパク質分解モデル
M7Cが関与する分解経路は活性化されないが、M9A,M8Bが関与する経路が活性化される。
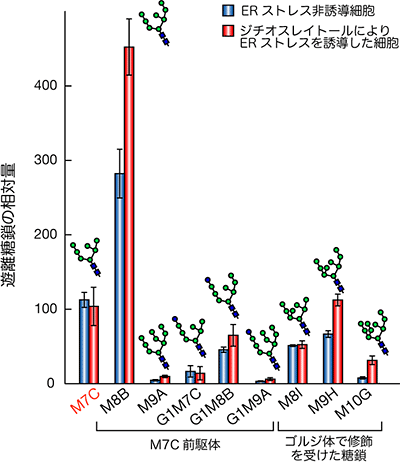
図3 ERストレス誘導時の各糖鎖構造の定量データ
ERストレスを受けると、M7C由来の遊離糖鎖は増加しないが、M7C前駆体やゴルジ体で修飾を受けた糖鎖由来の遊離糖鎖は増加する。
