ポイント
- 「2-アリールプロピオン酸」構造を持つ非ステロイド性抗炎症薬をPET用に標識化
- 薬剤の脳内移行性の改善にも成功、ラットで効果を確認
- 体内における薬剤の可視化により、多くの病態解明や診断応用が期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、風邪薬などで日常的に利用される非ステロイド性抗炎症薬(NSAIDs)※1のうち、「2-アリールプロピオン酸」という共通の化学構造式を持つイブプロフェンなど6種類の化合物に、炭素の放射性同位元素※2(11C)で目印をつける(標識化する)ことに世界で初めて成功しました。NSAIDsをPET(陽電子放射断層画像撮影法)※3に利用するための一般的な合成反応を開発した今回の成果により、体内での動態が謎である薬剤の働きを明らかにする手法の1つが確立されたことになります。これは、分子イメージング科学研究センター(渡辺恭良センター長)分子イメージング創薬化学研究チームの鈴木正昭チームリーダー(兼副センター長)、分子イメージング標識化学研究チーム(土居久志チームリーダー)高島好聖リサーチアソシエイト、分子プローブ機能評価研究チーム(尾上浩隆チームリーダー)宿里充穂リサーチアソシエイトらによる研究成果です。
PETは、がんの診断などに使われている分子イメージング技術※4で、薬剤などに放射性同位元素である炭素11(11C)やフッ素18(18F)などを導入し、生体内での分子の位置や量、動きを可視化する手法です。11Cは約20分、18Fは約110分と半減期※5が短いため、薬剤にこれらの元素を導入するためには、すばやく合成作業(例えば11Cは5分以内が理想)を行う必要があります。一方、2-アリールプロピオン酸という構造を持つNSAIDsは、実用薬として用いられる解熱・鎮痛・抗炎症作用以外に、アルツハイマー病やパーキンソン病などの神経変性疾患との関連も知られていますが、詳細な作用機序についてはいまだ解明されていません。
研究グループは、2-アリールプロピオン酸に11Cを2分以内で導入することに成功し、ラットのPET画像の解析から、脳への移行性が低いことを確かめることに成功しました。また、神経変性疾患とのかかわりを解明するには、この脳への移行性を改善させることが鍵になると考え、カルボン酸(-COOH)という構造をメチルエステル体(-COOCH3)へと変換し、ラット静脈に投与したところ、脳への移行性を向上させることができました。続いて左脳に炎症を発生させたラットにメチルエステル体を投与したところ、炎症部位に薬剤が集積することをPET画像解析から確認することができました。
今回成功した11C標識-2-アリールプロピオン酸とそのエステル体を利用することにより、末梢・中枢を問わず、多くの病態解明や診断に応用できることが期待されます。
本研究成果は、ドイツの科学雑誌『Chemistry-A European Journal』に近く掲載されます。
背景
生体内の分子の動きを、生きたまま体外から見ることができる「分子イメージング技術」の1つとして、陽電子放射断層画像撮影法(PET)が活用されています。この技術は、治療薬をはじめとする薬剤や病巣の状態を知る試薬などに、放射性同位元素である炭素11(11C)やフッ素18(18F)などを組み込んで利用します。11Cは約20分、18Fは約110分と半減期が短いため、薬剤にこれらの放射性同位元素を導入するには、すばやく合成作業(11Cは5分以内)を行わなくてはならず、高度な化学力が必要とされます。
今回、研究グループは、非ステロイド性抗炎症薬(NSAIDs)の標識化(PETトレーサー※4化)に注目しました。NSAIDsは解熱・鎮痛・抗炎症作用を示す薬で、広く使用されていますが、これらの薬剤を常用している患者はアルツハイマー病やパーキンソン病のリスクが低いという報告もあります。NSAIDsと炎症や神経変性疾患とのかかわりについては多くの研究が行われていますが、作用機序の詳細についてはいまだ解明されていません。生体を丸ごと調査できる機能を持つPETという分野から新たに研究を行うことにより、神経変性疾患を含む多くの病態の解明や診断などに利用できるのではないかと考えました。
研究手法と結果
NSAIDsには多くの種類があります。研究グループは、この中から「2-アリールプロピオン酸(Ar-CH-(CH3)-COOH)」という共通の化学構造式を持つ化合物への標識化(放射性炭素11Cの導入)を計画し、たった2分以内の反応で11C標識されたメチル基を導入することに成功しました(図1)。
具体的には、
(1)2-アリールプロピオン酸の原料には、対応するアリール酢酸メチルエステルと放射性同位元素の11Cを導入したヨウ化メチル(11CH3I)を用いました。
(2)アリール酢酸メチルエステルのベンジル位と呼ばれる位置にある水素は、水素化ナトリウム(NaH)や炭酸カリウム、テトラブチルアンモニウムハイドライドなどの塩基によって容易に引き抜かれ、「エノラート」と呼ばれる構造を形成します。(図1b)
(3)エノラートは、11CH3Iと瞬時に反応し、11Cの導入により標識化された2-アリールプロピオン酸メチルエステルが生成することを発見しました。(図1c)
(4)その後の加水分解もたった1分で完結し、反応混合物を高速液体クロマトグラフィー(HPLC)という技術を用いて精製することで、目的物である11C標識2-アリールプロピオン酸を合成することができました。(図1d)
この方法を用いることによって、イブプロフェン、ナプロキセン、フルルビプロフェン、フェノプロフェン、ケトプロフェン、ロキソプロフェンの化合物とそれらのメチルエステル体(-COOCH3)、計12個の化合物に11Cを導入することに成功し、この反応が共通の化学構造式を有する多くの薬剤の11C標識に応用できることを証明しました(図2)。
次に、薬剤として利用している2-アリールプロピオン酸は、通常脳へ移行しにくいことが知られていますが、この事実を、11Cを導入したケトプロフェンを用いて得たPET画像の解析からも確かめることができました(図3-a)。
一方で、神経変性疾患とのかかわりを解明するためには、この脳への低い移行性を改善することが鍵になると考え、脳へ移行しやすくするためカルボン酸(-RCOOH)をメチルエステル体(-COOCH3)に変換し、ラット静脈に投与したところ、高い移行性を実現できました(図3-b)。
また、脳へ移行したエステル体は、脳内でカルボン酸に変換されることも代謝物解析から裏付けました。代表的な例として、[11C]含有ケトプロフェンメチルエステル体は、脳へ入った後すぐに代謝され、[11C]含有ケトプロフェンに変わりました(図4)。同様に、左脳に炎症を発生させたラットに11C含有メチルエステルを投与したところ、イブプロフェンを除いたナプロキセン、フルルビプロフェン、フェノプロフェン、ロキソプロフェンのエステル体が、ケトプロフェンと同様に炎症部位に集積し、類似のPET画像を得ることができました(図5)。
今後の期待
11C標識したNSAIDsを用いるPETイメージングの活用により、さまざまな病気のもとになっている炎症の有無を的確に診断して適切な治療法を選択したり、新しい治療薬の開発などに活用できると期待されます。また、今回の実験から、炎症部位に集積した薬剤について、さらに効果などの評価を進める予定です。
今後、さらに選択性や特異性が高い分子イメージングプローブの開発を目指してPET研究を進めていく予定です。
発表者
理化学研究所
分子イメージング科学研究センター
分子イメージング標識化学研究チーム
リサーチアソシエイト 高島 好聖(たかしま みさと)
Tel: 078-304-7130 / Fax: 078-304-7131
分子プローブ機能評価研究チーム
リサーチアソシエイト 宿里 充穂(しゅくり みほ)
Tel: 078-304-7121 / Fax: 078-304-7123
お問い合わせ先
神戸研究推進部企画課Tel: 078-306-3007 / Fax: 078-306-3039
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.非ステロイド性抗炎症薬(NSAIDs)
アスピリンやイブプロフェン、インドメタシン、ジクロフェナクなどに代表される解熱・鎮痛・抗炎症作用を示し、日常的に実用薬として利用される。これらの薬剤を常用している患者には、アルツハイマー病やパーキンソン病のリスクが低いことなど、炎症以外に神経変性疾患とのかかわりも知られている。 - 2.放射性同位元素
原子番号が同じでも質量数が異なる元素を同位体と呼び、それらの中でも放射線を出して崩壊するものを放射性同位元素(放射性核種)と呼ぶ。通常の炭素(C)や窒素(N)、酸素(O)、フッ素(F)は、安定に存在する元素なので放射線は出ていない。 - 3.PET(陽電子放射断層画像撮影法)
Positron Emission Tomographyの略で、ごく微量の放射線を出す原子を薬などの分子に導入し、そこから出る放射線を測定することで、薬が体内のどこにあるかを見る方法。PETで見ることができる放射線を出す原子は、炭素や窒素、酸素、フッ素など、体内にある普通の原子を用いる。 - 4.分子イメージング技術、PETトレーサー
生体内の分子の動きを生きたまま外から見る技術。がん診断に使われているPETや脳診断に使われるMRIなどがある。PETを用いて分子の動きを追跡するために標識化した分子を「PETトレーサー」といい、放射性同位元素が崩壊する際にガンマ(γ)線を放出する11Cや18Fを組み込んだ分子を指す。PETトレーサーを動物やヒトに投与し、そこから出るγ線をPETカメラで検出した後、演算処理することにより、体内のどこに薬物があるかを見ることができる。 - 5.半減期
放射性同位元素(あるいは素粒子)が崩壊して別の同位元素に変わるとき、元の同位元素の半分が崩壊する期間のこと。PETでは、目印として有効な時間(度合い)を表すことになる。放射性同位元素の崩壊は自然に起き、元素により半減期は異なる。従って、半減期は同位元素の安定度を示す値となり、半減期が短ければ短いほど不安定な同位元素ということになる。がん診断のPETでは半減期110分のフッ素18を用いた薬剤、18FDGが利用されている。
![エノラートの高速C-[11C]メチル化反応の一般式の図](/medialibrary/riken/import/jp/research/results/2010/100309/image/01.gif)
図1 エノラートの高速C-[11C]メチル化反応の一般式
前駆体となるアリール酢酸エステル(Ar-CH2-COOCH3)(a)に、塩基(水素化ナトリウム:NaH)を反応させてエノラート(b)を形成したDMF反応溶液に、11Cが導入されたヨウ化メチル(11CH3I)を加えると、瞬時に反応した後2-アリールプロピオン酸メチルエステル(Ar-CH-(CH3)-COOCH3)(c)が形成される。その後、同じ反応容器に水酸化ナトリウム(NaOH)水溶液を加え、50°Cで1分放置すると加水分解が完全に進行し、11Cの導入により標識化された2-アリールプロピオン酸(Ar-CH-(CH3)-COOH)(d)が形成される。
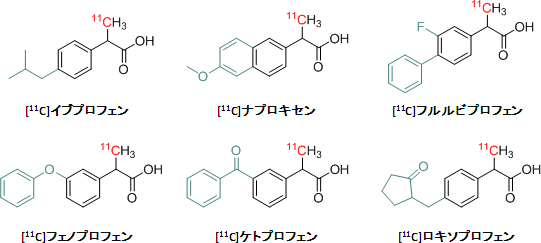
図2 開発した方法により標識した2-アリールプロピオン酸
上記6種類の薬剤と、それぞれのメチルエステル体を合成した。
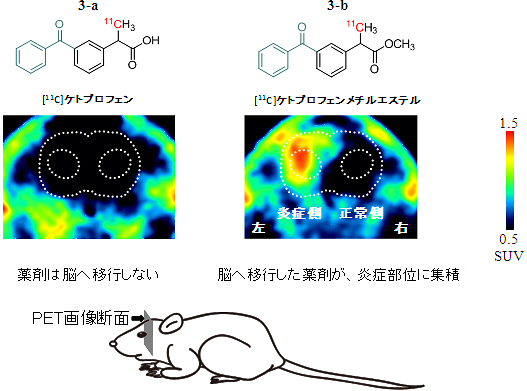
図3 脳内炎症ラットを用いたPETイメージング
左脳にリポポリサッカライド(LPS)を注入して炎症を引き起こしたラットに、[11C]ケトプロフェンと[11C]ケトプロフェンメチルエステルをそれぞれ投与したところ、aのケトプロフェンは、脳への移行が非常に少なく、集積が見られなかった。一方、bのエステル体では、炎症が起こっている左側に薬剤の集積が見られた。時間経過とともに、左右の薬剤の蓄積の差が大きくなる。
(SUV:分子の集積度合い)
![ラット脳と血中の[11C]ケトプロフェンメチルエステルの代謝物解析の図](/medialibrary/riken/import/jp/research/results/2010/100309/image/04.gif)
図4 ラット脳と血中の[11C]ケトプロフェンメチルエステルの代謝物解析
[11C]ケトプロフェンメチルエステルをラットに投与し、時間ごとに代謝物解析を行った。血液中(右)では、2分後にほとんどのエステル体がケトプロフェンへ変換されており、脳(左)では5分後におよそ9割以上がケトプロフェンへと代謝されていた。
![[11C]2-アリールプロピオン酸メチルエステルの評価の図](/medialibrary/riken/import/jp/research/results/2010/100309/image/05.jpg)
図5 [11C]2-アリールプロピオン酸メチルエステルの評価
[11C]ケトプロフェンメチルエステル(e)と同様にそれぞれのメチルエステル体をラットに投与し、炎症部位への集積を調査した。イブプロフェンメチルエステル(a)以外のすべての薬剤について炎症部位への集積が見られた。
