2010年5月28日
独立行政法人 理化学研究所
細胞の測定データから細胞分化を引き起こす分子回路を同定
-自己の運命を決定づける細胞中のシステム構造を引き出すことに成功-
ポイント
- 分化に向かう細胞は、制御工学で用いられる分子回路の理論を持つ
- 負のフィードバックやANDゲートなど、工学的なシステム構造を生物も所有
- 分子回路の理論は、がん・神経・免疫細胞などの生物現象も解明すると期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、細胞分化や細胞増殖など、異なる形態を決定する細胞内の分子回路を、測定データに基づいたコンピュータ計算によって理論的に明らかにしました。その結果、分化に向かう細胞が、制御工学分野でよく知られている頑強なシステム構造を利用して、安定な信号出力を出す仕組みを獲得していることが分かりました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)細胞システムモデル化研究チームの岡田(畠山)眞里子チームリーダー(兼 基幹研究所先端計算科学研究領域計算科学研究協力グループ:泰地真弘人グループディレクター)とアイルランドのダブリン大学ボリス・コロデンコ教授らによる共同研究の成果です。
細胞は、親から与えられた同一の遺伝子セットを持ちながら、生育条件に応じて生存、増殖、分化、細胞死など自己の進むべき道を決定していきます。しかし、このような細胞の運命を決定していく仕組みは今までよく分かっていませんでした。研究グループは、異なる成長因子※1の投与により、増殖と分化という違う形態を表すMCF-7乳がん細胞※2を使って、細胞の実測データを基にコンピュータモデルを作成し解析を行ったところ、分化過程だけに働いている分子回路があることを同定しました。さらに、この回路が制御工学の分野でよく知られている負のフィードバック※3、フィードフォワード※3、ANDゲート※3などのシステム構造を採用していることが分かりました。負のフィードバックとANDゲートのシステム構造は、細胞にとって望ましくないノイズを除去し、安定な信号出力を出す仕組みとして働いていることが考えられます。また、今回明らかにした分子回路は、がん細胞、神経細胞、免疫細胞の分化過程にも存在することが示唆されており、細胞の持つ普遍的なシステム構造の1つと考えられるとともに、こうした分子回路の概念は、細胞の安定した分化制御を可能にすることが期待されます。
本研究成果は、米国の科学雑誌『Cell』に掲載されるに先立ち、5月27日(日本時間5月28日)にオンライン掲載されます。
背景
細胞は、成長因子の存在や生育条件により、細胞増殖や細胞分化など、自らが選択して進むべき道を定めることが知られています。本来、同じ細胞は同じ遺伝子セットを持っていますが、なぜ外からの刺激や環境条件によって、異なる形態が表れるのかはまだ分かっていません。従来、細胞内の分子の計測は、分子の定性的な性質を明らかにすることに注力され、定量的な測定にはあまり注意が払われていませんでした。今回、細胞の増殖や分化過程の仕組みを明らかにするため、細胞内の複数種類の分子の活性化を時間ごとに定量的に解析し、それを数理的に解析することで、さまざまな分子間の制御関係を表す回路図(分子回路※4)の解明を目指しました。このように、動的で複雑な細胞が引き起こす現象を定量的および網羅的に測定し、そのデータを数理的に解析する研究分野は比較的新しく、「システムバイオロジー」と呼ばれています。
研究手法と成果
研究グループは、細胞増殖を促す上皮成長因子と、細胞分化を促すヘレギュリンという2種類の成長因子を、MCF-7乳がん細胞へ別々に投与し、細胞内のタンパク質のリン酸化や転写因子※5の遺伝子発現量などを、免疫学的手法や遺伝子増幅法などを用いて、定量的に時系列を追って測定しました。具体的には、タンパク質リン酸化酵素であるERK※6が出力するシグナルによって、FOSタンパク質※7という細胞運命決定に重要な転写因子が活性化するまでの回路を設定し、ERKからFOSタンパク質活性化までの反応に関与する複数の分子のリン酸化データや遺伝子発現データを、数分~数十分ごとに定量的に取得しました。その結果を基に、微分方程式をモデルにしたコンピュータシミュレーションを行ったところ、乳がん細胞の分化を説明するネットワークの構造と、カギとなる重要な制御分子を同定することに成功しました(図1)。
このネットワークの解析の結果、FOSタンパク質の活性化には、FOSタンパク質の遺伝子発現(c-fos mRNA)シグナルと脱リン酸化酵素であるppERKの安定化シグナルの2つの入力を伴うANDゲート構造を回路として採用していることが分かりました(図1)。つまり、遺伝子発現シグナル1の入力と安定化シグナル1の入力があるときだけ、出力としてFOSタンパク質が活性化し、その細胞を分化へと導くことを明らかにすることができました(図2)。また、ERKの活性持続性は細胞分化へ影響を及ぼすことが指摘されていましたが、具体的な分子ネットワークは明確に分かっていませんでした。今回、ERKからFOSタンパク質活性化へのフィードフォワード、そしてFOSタンパク質活性化により引き起こされる転写活性化からERKを不活性化へ導く負のフィードバックなど、制御工学の分野で知られるシステム回路が細胞反応系に何層にも埋め込まれ、FOS活性化のデジタル変換を行っていることが判明しました。これらの回路は、分化過程だけで働いており、分化が非常に安定な分子ネットワーク構造によって進められていることが示唆できました。
今後の期待
複雑な分子回路を単純化することで、その制御機構を明らかにし、細胞種にかかわらず普遍的な細胞分化の分子回路の基本原理を見いだすことができました。従って、この分子回路を人為的に変更すると、細胞の制御が可能になると考えられます。例えば、安定化シグナルをなくすとFOSタンパク質の発現がゼロになり、それ以降のFOS依存的な遺伝子発現が起こらないという理由で、細胞が分化から増殖に変化する可能性があります。また逆に、安定化シグナルを細胞に与えることで、逆の制御が可能になります。このような分子回路の概念は、再生医療における細胞の安定な構築にも応用できることが期待できます。
明らかにした分子ネットワークの回路構造は、ERKによって分化が誘導される細胞に共通していると考えています。すなわち、シミュレーションによって、理論的な細胞分化制御が多くの細胞で可能になると考えられます。
発表者
理化学研究所
免疫・アレルギー科学研究センター
細胞システムモデル化研究チーム
岡田 眞里子(おかだ まりこ)
Tel: 045-503-9302 / Fax: 045-503-9613
お問い合わせ先
横浜研究推進部 企画課Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.成長因子
細胞を活性化し増殖させるペプチド性因子。細胞に存在する受容体に結合して作用を発揮する。上皮成長因子(EGF)受容体はErbB1受容体、ヘレギュリン(HRG)はErbB3受容体とErbB4受容体に結合し、受容体の活性化を通して細胞を活性化する。ErbB受容体の変異や過剰発現は、ヒトのさまざまながんの発生に関与することが知られている。 - 2.MCF-7乳がん細胞
乳がんの研究に最も一般的に使われている培養細胞系。エストロゲン受容体のほかに、EGFR、ErbB2などの膜受容体を持つため、乳がんの抗がん剤の評価によく使われている。 - 3.フィードバック、フィードフォワード、ANDゲート
フィードバックは、出力の結果を入力側に戻して入力を制御すること。負のフィードバックは系の安定化に働く。フィードフォワードは、フィードバックの逆で、連続反応におけるある1つの出力がその後に起こる出力を制御すること。ANDゲートは、入力A、Bの両方に1の入力があって初めて出力1が生じる回路のこと。ノイズに強く、確実な出力を出せるという利点がある。フィードバックとフィードフォワードは時間差を利用した制御が可能になる。 - 4.分子回路
分子活性のつながり方の関係図。細胞内の情報の伝達は、工学ではすでに親しみのある制御回路と類似している。しかし、生物の分子回路は構成要素の数が多いため、工学の制御回路より複雑で、その主回路を同定するためには、実験とともに計算シミュレーションが有効である。 - 5.転写因子
特定のDNA配列に結合して遺伝子の発現を制御するタンパク質。 - 6.ERK
細胞外シグナル制御キナーゼ。細胞質に存在し、さまざまな信号を受けると、細胞核に移行し、転写因子を活性化するMAPキナーゼという酵素群の1つ。MAPキナーゼは進化的によく保存されており、酵母からほ乳類まで存在している。 - 7.FOSタンパク質
DNAに結合し、遺伝子の発現を制御する転写因子の1つ。FOSはAP-1複合体を形成し、非常に多くの遺伝子の発現を制御すると考えられている。
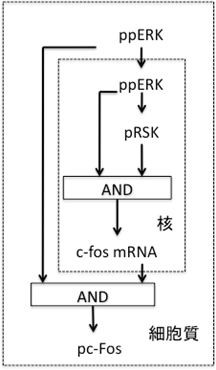
図1 同定した分子回路図
FOSタンパク質の遺伝子発現(c-fos mRNA)とタンパク質活性化(pc-Fosの生成)が、二重フィードフォワードANDゲートを形成していることを示す。遺伝子発現は核膜内、タンパク質活性化の反応は核膜外(細胞質)で別々に起こるので、これらの回路はよく整理されており、混線することはない。
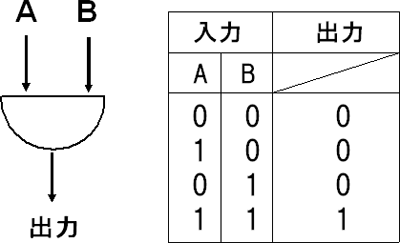
図2 ANDゲート構造
工学理論における制御構造。本研究の場合、遺伝子発現シグナル1の入力(A)と安定化シグナル1の入力(B)があるときだけ、シグナル1が出力してFOSタンパク質が活性化し、その細胞を分化へと導くと説明できる。
