2010年5月31日
独立行政法人 理化学研究所
出来損ないの異常糖タンパク質の分解機構に多様性を発見
-RTLという新モデルタンパク質を用いたアッセイが画一的な定説を覆す-
ポイント
- 出芽酵母の遺伝学を用いて小胞体関連分解の新しい解析手法(RTL法)を確立
- モデルタンパク質のRTLは植物タンパク質のRTAと同様のメカニズムで分解
- しかし、RTLでは、分解に必須とされていたマンノシダーゼMns1が不要と判明
要旨
独立行政法人理化学研究所(野依良治理事長)は、パン酵母として知られる出芽酵母※1を使って、異常糖タンパク質の分解に必須とされていたマンノシダーゼ※2の作用が不要な新しい分解機構を発見しました。これは、理研基幹研究所(玉尾皓平所長)糖鎖代謝学研究チームの鈴木匡チームリーダー、細見昭特別研究員と国立大学法人大阪大学、米国・テキサス大学などによる共同研究の成果です。
生体を構成し、生命現象をつかさどるタンパク質が、体内で正しく合成されて機能を発揮するために、生物では、正しい構造を持つ機能的なタンパク質を選別するとともに、出来損ないのタンパク質(異常タンパク質)を正しい構造に戻したり、分解したりする“品質管理機構”が働いています。このタンパク質品質管理に重要なタンパク質分解機構の破たんは、細胞の変性や死を引き起こし、アルツハイマー病をはじめとしたさまざまな重篤な疾患をもたらすことが知られています。
タンパク質が受ける修飾反応の中で、糖鎖の付加は、生物の最も普遍的な反応の1つです。最近の研究から、細胞は、タンパク質上のN型糖鎖※3の構造の微小な違いを活用して、異常糖タンパク質の分解を制御し、糖タンパク質の品質管理を行っていることが明らかになってきました。研究グループはこれまで、この品質管理プロセスに、糖鎖を脱離する酵素であるペプチド:N-グリカナーゼ(PNGase)※4が関与していることを明らかにしています。さらに、効率よい分解のために、PNGaseを必要とする糖タンパク質の1つとして、植物の毒素タンパク質であるリシンA鎖の変異体(RTA)を初めて見いだしました。
研究グループは、このRTAの認識分解機構を詳細に調べるために、遺伝的手法を活用してRTLという新しいモデルタンパク質を作り、タンパク質の分解機構を解析する手法を確立しました。この方法を用いてさまざまな実験を行ったところ、作製したRTLは、RTAと同じ異常タンパク質の認識システムを利用して分解されることが分かりました。一方、これまで異常糖タンパク質の認識に必須とされてきたマンノシダーゼ(Mns1)の作用が不要ということを初めて明らかにしました。この結果から、異常糖タンパク質糖鎖の認識過程は、現在信じられているような画一的なものではなく、分解されるタンパク質に依存して多様であることが判明しました。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』(8月号)に掲載されるに先立ち、オンライン版(5月28日付け:日本時間5月29日)に掲載されました。
背景
生体を構成し、生命現象をつかさどるタンパク質が、体内で正しく合成されて機能を発揮するために、生物では、正しい構造を持つ機能的なタンパク質を選別するとともに、出来損ないのタンパク質(異常タンパク質)を正しい構造に戻したり、分解したりする“品質管理機構”が働いています。この品質管理機構は、小胞体(ER)※5で行われ、「小胞体品質管理機構(ERQC)」※6と呼ばれています。具体的には、翻訳後修飾※7によりN型糖鎖がタンパク質に付加して糖タンパク質が生合成され、小胞体品質管理機構(ERQC)において、正しくフォールディング(折り畳み)したタンパク質と異常タンパク質とを判別します。ERQCの中でも特に重要なERAD(小胞体関連分解機構)※8では、N型糖鎖の微小な違いを認識することで分解が制御されています。
これまでの研究によって、ERADにおけるN型糖鎖の認識は、糖鎖の順序立った切り出しが重要であると考えられてきました。しかし、これらの定説は、限られたモデルタンパク質を用いた研究で得られてきた結論で、普遍性を持つかは明らかではありませんでした。一方、研究グループは、ERADにおいてタンパク質から遊離する糖鎖(“遊離糖鎖※9”)を一斉に解析する手法を開発し、その遊離糖鎖の構造解析から、これまで画一的に順序良く切り出されるという定説が、必ずしもすべての異常糖タンパク質の認識・分解に当てはまるわけではない可能性を提唱してきました(J. Biol. Chem. 285, 12390-12404(2010); 2010年2月18日研究成果)。さらに、その効率よい分解に糖鎖脱離酵素PNGase (Png1) を必要とするタンパク質として、RTAという植物由来のタンパク質を初めて見いだしてきました(J. Cell Biol. 172, 211-219 (2006))。今回、このタンパク質RTAの認識分解機構を詳細に調べることで、Png1に依存したERADの詳細を明らかにしようと試みました。
研究手法と成果
(1)ERADの新しい解析手法、RTL法の確立
Png1に依存して分解するタンパク質RTAは、その細胞内での分解が非常に早いことから、正確に安定性を解析するのが困難でした。そこで、分解速度を細胞の増殖に置き換えて検出できるような実験系を確立することにしました。まず、遺伝学的改変によりRTAの誘導体である新たなモデルタンパク質RTLを作製しました(図1)。RTLは、内腔タンパク質※10であるRTAに、アミノ酸の一種であるロイシンの合成に必須の酵素であるLeu2を融合させたキメラタンパク質です。次に、ロイシン欠損培地で出芽酵母を培養しました。ERADが正常な出芽酵母株は、Leu2を含むRTLを分解することができるため、ロイシンが合成され、生育できません。一方、ERADが異常な酵母株は、RTLを分解することができないため、ロイシンが合成され、生育できます。従って、出芽酵母株が生育できるか否かを観察することで、RTLの分解の有無を解析することができます。
(2)RTLは、RTAと同じ認識機構で分解する
新たに作製したモデルタンパク質RTLが、本当にRTAと同様のメカニズムでERADによって分解されるかを確かめるため、RTLの分解を詳細に解析しました。その結果、RTLの分解は、RTAと同様にPng1に依存的であり、またその依存性は、糖鎖付加部位を欠損させることで解消することが明らかとなりました。さらに、RTLの分解に必要なタンパク質は、RTAの分解に必要なタンパク質と共通であることが分かりました。これらの結果から、RTLがRTAと同様な認識機構によって分解されていることを強く示唆することができました。
(3)RTLの効率よい分解にはマンノシダーゼMns1は必要でない
ERADが異常糖タンパク質を異常と認識するには、Htm1というマンノシダーゼとYos9というレクチン※11が重要であることが知られています(図2A)。一方で、マンノシダーゼHtm1が作用するには、まず、マンノース1分子を分解する酵素の1つであるマンノシダーゼMns1の作用により、特定のマンノースが脱離することが必要だと考えられてきました(図2B)。モデルタンパク質RTLを用いて分解過程を解析したところ、これまでの異常糖タンパク質の分解と同様にHtm1、Yos9の存在が必須である一方、Mns1の作用はまったく必要でないことが判明しました(図2C、図3)。このことから、これまでHtm1に先立ってMns1の作用が必要とされてきましたが、それは一部の異常糖タンパク質の分解に必要なだけで、RTLの分解では、Mns1に依存しない糖鎖の切り出しが行われていることが分かりました。実際、RTA上の糖鎖構造を解析すると、Mns1の欠損株でHtm1の作用だけを受けた糖鎖構造を見いだしたことから、糖タンパク質の種類によって、Htm1はMns1に依存せず作用することが可能であることが確認できました。
今後の期待
タンパク質の品質管理やタンパク質分解機構の破たんは、細胞の変性や死を引き起こし、アルツハイマー病やプリオン病などフォールディング病と総称される重篤な疾患の原因になりえることが知られています。タンパク質品質管理機構では、N型糖鎖が重要な役割を果たしていますが、その詳細なメカニズムはいまだ明らかではありません。今回、研究グループは、出芽酵母を用いて、異常糖タンパク質糖鎖の認識過程が、現在信じられているような画一的なものではなく、分解されるタンパク質に依存して多様であることを明らかにしました。今後、RTA/RTLが、これまで調べられてきたモデル糖タンパク質の品質管理機構・分解機構となぜ異なるのかについて、その分子レベルの詳細な解析を行い、異常糖タンパク質認識のメカニズムの詳細をさらに明らかにすることが期待できます。
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究領域
システム糖鎖生物学研究グループ
糖鎖代謝学研究チーム
チームリーダ 鈴木 匡(すずき ただし)
Tel: 048-467-9628 / Fax: 048-467-9626
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.出芽酵母
パン酵母やビール酵母などさまざま酵母が知られているが、出芽によって増えるのでこの名がある。特にパン酵母は、細胞生物学や遺伝学実験のモデル生物として広く使われている。 - 2.マンノース、マンノシダーゼ
マンノースは、糖鎖を形成する単糖構成成分の1つ。N型糖鎖のコア構造を形成する。 このマンノースを加水分解する酵素がマンノシダーゼ。マンノースを糖鎖から切断する。Mns1は小胞体に存在するマンノシダーゼの1つで、正常、異常にかかわらず特定のマンノースを切断する (図2参照)。一方Htm1も小胞体に存在するマンノシダーゼであるが、異常糖タンパク質上の別の特定のマンノースを切断する (図2参照)。 - 3.N型糖鎖
タンパク質中のアスパラギン残基に結合する糖鎖。糖タンパク質の品質管理機構などにおいて、目印(タグ)として機能する。 - 4.ペプチド:N-グリカナーゼ(PNGase)
出芽酵母に存在する細胞質ペプチドで、糖タンパク質からN型糖鎖を切り出す脱糖鎖酵素。バクテリア由来の酵素は糖鎖研究用の試薬として重要であるが、ヒトや酵母の細胞質に存在するPNGaseは異常糖タンパク質の分解にかかわっている。Png1は出芽酵母の細胞質PNGaseのタンパク質名。 - 5.小胞体(ER)
細胞小器官の1つ。分泌経路にのるタンパク質を合成する場で、N型糖鎖の付加やタンパク質の正しい折り畳みが行われる。 - 6.小胞体品質管理機構(ERQC)
小胞体で生合成された糖タンパク質は、正しい高次構造(折り畳みや、ほかの糖タンパク質との複合体形成)をとったときだけ分泌経路にのることができ、その過程がうまくいかない糖タンパク質は小胞体に留め置かれる。この機構を、工場での品質管理に例えて名付けられた。 - 7.翻訳後修飾
ヒトをはじめとする真核生物では、遺伝情報を基に生み出したタンパク質に、糖鎖の付加という翻訳後修飾が、広く起こることが知られている。この修飾は、細胞の発生・分化、細胞間相互作用、組織形成、タンパク質自体の折り畳み(フォールディング)の促進など、さまざまな生体内のプロセスに関与している。 - 8.小胞体関連分解(ERAD)
小胞体で生合成された糖タンパク質が正しい高次構造をとれなかった場合、そのような異常糖タンパク質を小胞体から細胞質へ放出し、分解する機構。 - 9.遊離糖鎖
タンパク質や脂質に結合していない糖鎖。ここでは、N型糖鎖からPNGaseによって遊離された糖鎖をいう。 - 10.内腔タンパク質
小胞体などの細胞小器官の内側に存在する、膜貫通領域を持たない可溶性タンパク質。 - 11.レクチン
糖鎖に結合するタンパク質の総称。
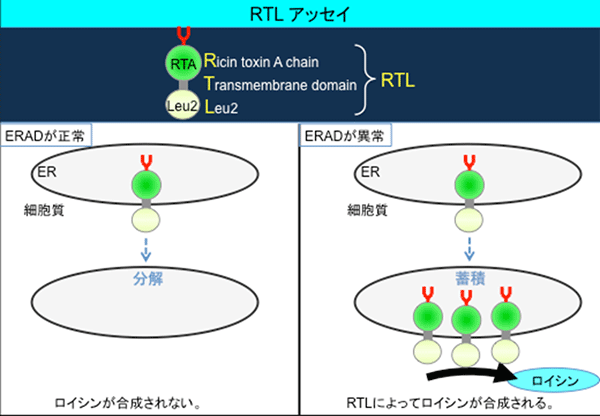
図1 RTL法の原理
RTLは、RTA、膜貫通領域(Transmembrane domain)、Leu2で構成されたキメラタンパク質。Leu2がアミノ酸の一種であるロイシンの合成に必須のタンパク質であるため、RTLを分解できない(ERADが異常)酵母だけがロイシン欠損培地で生育できる。この原理を活用してERADが正常か異常を正確に観測する。異常の場合にはRTLが分解できずロイシンが合成され出芽酵母(細胞)が生育する。
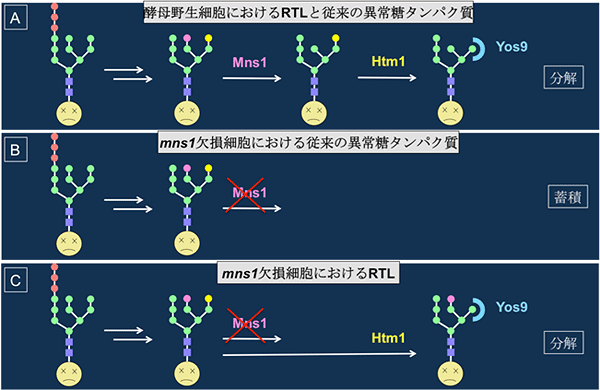
図2 Mns1欠損細胞における従来の異常タンパク質の分解とRTL分解
A:従来の異常糖タンパク質分解モデル
ERの中で異常糖タンパク質の糖鎖のマンノースが段階的に除かれる。最終的にレクチンのYos9に認識されて分解される。
B:Mns1欠損細胞における従来の異常糖タンパク質分解モデル
異常糖タンパク質は、Mns1によるマンノース切除が起こらないため分解されない。
C:Mns1欠損細胞におけるRTL分解モデル
RTLはMns1が無くても分解される。RTLの糖鎖はMns1によるマンノース切除が無くてもHtm1によるマンノース切除が起こる。
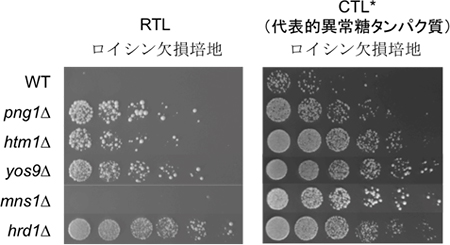
図3 RTL法(Mns1はRTLの分解に関与しない。)
ERADの解析で最も使われている異常糖タンパク質の1つCTL*の分解にはMns1が必要である(右)。一方、RTLの分解にはMns1は必要でない(左:分解が進みロイシンの生産が確保できずに出芽酵母は死滅する)。スポットは、左から右に向って酵母の濃度を希釈しており、従って細胞の増殖が遅れる株は見えるスポットの数が減少する。
