2010年9月24日
独立行政法人 理化学研究所
免疫応答を抑制する分子メカニズムにミクロクラスターが関与
‐T細胞を抑制する補助刺激受容体CTLA-4のミクロクラスターが存在‐
ポイント
- CTLA-4ミクロクラスターが、T細胞の過剰な活性化を制御し、免疫応答を抑制
- 免疫応答を分子イメージングで可視化、免疫抑制を行う細胞内の場所を同定
- 免疫抑制の分子メカニズムを活用した新たな免疫治療や画期的な創薬の可能性に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、免疫応答を制御する分子メカニズムに、T細胞の補助刺激受容体※1CTLA-4(Cytotoxic T-lymphocyte-associated protein 4)※2を含む「ミクロクラスター」の存在を発見し、T細胞の過剰な活性化を抑制していることを明らかにしました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫シグナル研究グループの斉藤隆グループディレクター、横須賀忠上級研究員と、東京工業大学大学院生命理工学研究科、大阪大学免疫学フロンティア研究センター、順天堂大学との共同研究の成果です。
免疫応答は、ウイルスや花粉などの異物(抗原)が体内に侵入したのを察知し、生体を守る働きをします。T細胞は、最初に抗原を感知して活性化し、増殖・外敵への攻撃・サイトカインの放出などの免疫応答を起こします。この際、T細胞は、抗原を取り込んで処理した抗原提示細胞※3と会合し、その接着面に「免疫シナプス※4」を形成して抗原の情報を受け取ります。
研究グループはこれまでに、免疫シナプス形成の前に作られる、T細胞受容体を核とする種々のシグナル伝達分子の集合体「ミクロクラスター」を発見し、これがT細胞の抗原認識とその活性化情報を伝える“ユニット”で、免疫応答の開始点であることを明らかにしています。この免疫応答は、補助刺激受容体による活性化や抑制といった正負の制御を受けており、研究グループは、正の補助刺激受容体CD28※5と特殊なリン酸化酵素※6プロテインキナーゼCθ(PKCθ)がミクロクラスターを形成して、T細胞の活性化を強めることを明らかにしてきました。
今回、研究グループは、最新の生体分子イメージング※7技術を用い、T細胞の活性化を負に制御する補助刺激受容体CTLA-4もミクロクラスターを形成し、免疫シナプスの中心に集まり、活性化を担うCD28/PKCθの集合を阻害して、活性化シグナル伝達を時間的空間的に抑制することを発見しました。さらに、このCTLA-4ミクロクラスターによる抑制が、制御性T細胞※8の不応答※9の要因であることも突き止めました。
CTLA-4は、その遺伝子欠損マウスが全身性の自己免疫反応により早期に死亡することなどから、T細胞の活性化の抑制に重要であることが知られています。CTLA-4による抑制を調節することで、T細胞の活性化を調節することができるため、がんに対する免疫応答を強めたり、逆に、移植拒絶、アトピー性皮膚炎、リウマチなどの自己免疫疾患の過剰な免疫応答を緩和したりすることが可能です。そのため、CTLA-4抗体はすでにがん治療に応用されています。今回、CTLA-4による新たなT細胞の抑制メカニズムが明らかになったことで、さらなる免疫治療への進歩をもたらすと期待されます。
本研究成果は、米国の科学雑誌『Immunity』(9月23日付け:日本時間9月24日)にオンライン掲載されます。
背景
生体を外敵から防御するために、その中心的役割を果たす免疫系は、まずウイルスや花粉などの異物が体内に入り込んだことを知ることから始まります。樹状細胞などの抗原提示細胞は、異物の侵入を察知してそれを取り込み、抗原として提示します。T細胞は、抗原を認識して活性化し、種々のサイトカインを放出したり、がん細胞や感染細胞を殺したり、抗体産生を促すなど、より高度な免疫応答を起こします。
T細胞は、T細胞受容体を介して抗原提示細胞上の抗原を認識しますが、この情報は、T細胞と抗原提示細胞が接着することで受け渡されます。その接着面には、細胞表面のさまざまな受容体や細胞内のシグナル伝達分子が同心円状に規則正しく並んでおり、この構造が神経系のシナプスに似ていることから「免疫シナプス」と呼んでいます(図1)。
研究グループは、免疫シナプスの形成より早い時期に、すでにT細胞受容体と下流のシグナル分子による小さな集合体「ミクロクラスター」が形成され、これがT細胞活性化の開始点であり、「免疫シナプス」はそのミクロクラスターの集まりであることを発見しました(2005年11月7日プレス発表)。さらに、T細胞を最も強く活性化する正の補助刺激受容体CD28もミクロクラスターを形成し、プロテインキナーゼCθ(PKCθ)を誘い込んで会合することで、T細胞の活性化を誘導することを明らかにしています(2008年10月10日プレス発表)。
一方、免疫応答の過剰な反応を抑制し免疫系全体のバランスを調節するため、T細胞活性化を抑制する負の補助刺激受容体も存在します。CTLA-4は、最初に同定された負の補助刺激受容体で、正の補助刺激受容体であるCD28とリガンド※10(CD80、CD86)が同じですが、CD28より結合の親和性が高いため、少しでも発現していればCTLA-4はリガンドを奪い取ることができます。CTLA-4遺伝子欠損マウスが、全身性の自己免疫疾患を発症し、生後2カ月で死亡することから、CTLA-4は、生体においても強力な免疫抑制機能を持つと考えられています。さらに、近年、制御性T細胞の免疫制御機序にもCTLA-4が重要であることが明らかとなりました。これらのことから、CTLA-4阻害抗体や可溶化CTLA-4を用いた臨床応用がすでに始まっており、ますますその重要性が高まっていますが、シグナル伝達など詳しい抑制のメカニズムはいまだ判明していません。
研究手法と成果
研究グループは、CTLA-4が負の補助刺激受容体として、T細胞受容体/CD28ミクロクラスターをどのように制御するのか、ミクロな視点から研究を進めました。これまでの研究は、マウスによる個体レベルでの解析や、細胞を用いた生化学的解析が中心で、分子レベルの解析は今回が初めてになります。
正常なT細胞でのリアルタイムな分子の動きを、最新の生体分子イメージング技術を用いて解析しました。まず、抗原提示細胞が発現しているT細胞受容体のリガンドとCD28/CTLA-4のリガンド(CD80、CD86)を、自由に動けるような形でガラス平面上の人工の細胞膜(人工脂質二重膜)に加え、抗原提示細胞の細胞膜の機能を持つ「プレイナーメンブレン」を開発しました(図2)。次に、このプレイナーメンブレン上にT細胞を載せたときに接着面で起きる現象を、T細胞受容体、CD28やCTLA-4、シグナル伝達分子などの分子にGFPなどの蛍光タンパク質を付加して、1分子レベルの分解能で解析が可能な高感度全反射蛍光顕微鏡で観察しました。
観察の結果、T細胞は、プレイナーメンブレンに接着し抗原を認識すると同時に、直ちにT細胞受容体ミクロクラスターを形成していました。CD28もT細胞受容体と共にミクロクラスターを形成し、免疫シナプスの中心に移動しました。その後、CD28は、T細胞受容体から離れ、T細胞受容体の周囲に輪状構造を構築し、PKCθを呼び寄せ、T細胞活性化を持続させる活性中心を作りました。一方、細胞内のリソソームに蓄えられていたCTLA-4は、T細胞受容体からの活性化シグナルを受けると、免疫シナプスに出現し(図3)、CD28/PKCθからなる持続活性中心を占拠してCD28を排除し、活性化を抑制することが分かりました(図4、5)。この抑制のメカニズムは、CTLA-4による細胞内シグナルの制御ではなく、主に、リガンドとの結合力や分子の大きさなど細胞外の分子構造によって調整されています。また、CTLA-4を常に高発現している制御性T細胞でも、CTLA-4がCD28の持続活性中心への誘導を阻害するため制御性T細胞が不応答の状態になることも明らかになりました。
これまでに、CTLA-4がCD28と同じリガンドに結合することは知られていましたが、今回初めてこの両者の競合の可視化に成功しました。また、結晶構造解析から、大きな円盤状構造を形成すると考えられていたCTLA-4が、ミクロクラスターという小さな集合体を形成し、T細胞受容体/CD28ミクロクラスターの形成を阻害していることも明らかとなりました(図6)。これらの結果は、ミクロクラスターが、T細胞の活性化だけでなく、活性化の抑制をも担っていることを示しています。この研究は、活性化と抑制の現場での分子の動きを観察することで、分子のダイナミックな動態を明らかにし、免疫応答の活性化と抑制の分子メカニズムを解明した画期的な研究成果といえます。
今後の期待
今回の研究から、T細胞活性化が、T細胞受容体と補助刺激受容体からなる正と負のミクロクラスターのバランスによって制御されていることが分かりました。CD28やCTLA-4のようなT細胞の補助刺激受容体は、T細胞活性化や増殖を調節するだけでなく、抑制性T細胞への分化を含めて、細胞の運命決定を制御しています。研究グループは、これら補助刺激受容体を「ミクロクラスター」という新たな視点から捉えたことで、これまでに解析できなかった複雑な補助刺激受容体のシグナル伝達系の解明に可能性を示しました。
CTLA-4は、最初に同定されたT細胞活性化を抑制する分子で、早くから臨床現場での応用が進んでいました。可溶化CTLA-4は、リガンドであるCD80およびCD86と強力に結合し、CD28の活性化シグナルを阻害します。リウマチ、ループス腎炎、I型糖尿病、脳脊髄炎、臓器移植のマウス実験モデルでも症状軽減の効果が認められ、2006年から欧州ではリウマチ患者に対する臨床応用が始まっています。また、CTLA-4阻害抗体も、CTLA-4の機能を抑え免疫系を賦活化させることから、悪性メラノーマなどのがん治療に用いられています。しかし、免疫系のランダムな活性化による二次的自己免疫疾患の発症や、CTLA-4を恒常的に発現している制御性T細胞を逆に刺激してしまうなど、阻害抗体使用による弊害も生じています。
T細胞活性化の制御の分子メカニズムのより詳細な解析が、CTLA-4の動態を制御するなど新しい観点からの創薬とともに、より選択的な免疫抑制剤や免疫賦活剤の開発への可能性を示しており、安全で効果的な免疫治療の進歩につながると期待できます。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫シグナル研究グループ
グループディレクター 斉藤 隆(さいとう たかし)
Tel: 045-503-7037 / Fax: 045-503-7036
上級研究員 横須賀 忠(よこすか ただし)
Tel: 045-503-7039 / Fax: 045-503-7036
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.補助刺激受容体
T細胞は、T細胞受容体からの刺激で活性化するが、それ単独の刺激だけでは、T細胞は細胞死や不応答を起こしてしまう。T細胞はT細胞受容体以外に、さまざまな補助刺激受容体を発現しており、この補助刺激受容体がT細胞受容体からのシグナルと協力し、第2のシグナルとしてT細胞の機能を多様化する。第2のシグナルによって、T細胞は活性化を持続したり、細胞増殖を起こしたり、特別な働きを獲得した機能細胞(病原体感染細胞を殺すキラーT細胞や、ほかの免疫細胞の働きを助けるヘルパーT細胞など)に分化したりする。補助刺激受容体には、T細胞の活性化に対し正の働きをするものと、負の働きをするものとが知られている。 - 2.CTLA-4(Cytotoxic T-lymphocyte-associated protein 4)
CTLA-4は、最初に同定されたT細胞の負の補助刺激受容体で、T細胞の活性化を抑制する。正の補助刺激受容体であるCD28とリガンド(CD80、CD86)が同じで、CD28より結合の親和性が高い。CTLA-4はT細胞の活性化によって発現し、細胞内のリソソームに貯蔵されるが、次のT細胞の活性化に伴い細胞表面へと移動する。抑制機構としては、CD28とリガンドの結合を拮抗すること、および、CTLA-4の細胞内部位に脱リン酸化酵素が会合し、活性化を抑制することなどが考えられてきた。一方、制御性T細胞では恒常的に発現しており、その免疫抑制機能に重要であることが示されている。 - 3.抗原提示細胞
免疫細胞のうち、外から侵入した病原体や体内で生じた死細胞などを貪食し、抗原として自らの細胞表面上に提示する能力を持つ細胞で、マクロファージや樹状細胞などが代表的。抗原提示細胞は、病原体や死細胞などを感知して、自らが活性化する(自然免疫)と共に、提示した抗原に特異的な免疫応答をT細胞やB細胞に誘導して、高度な免疫応答を起こさせる(獲得免疫)。 - 4.免疫シナプス
T細胞と抗原提示細胞とが接着して抗原に特異的な免疫応答を起こす際、その接着面にある受容体と細胞をつなぐ接着分子は同心円状に再配列する。中心部よりT細胞受容体、接着分子、膜型脱リン酸化酵素からなる直径約10μmの3重構造をしており、神経系のシナプスに似ていることから「免疫シナプス」と呼ばれる。T細胞の抗原認識と活性化に重要と考えられており、B細胞やナチュラルキラー細胞など、免疫細胞の細胞間相互作用に広く見られる構造である (図1参照)。 - 5.CD28
T細胞の正の補助刺激受容体として最初に同定された免疫グロブリンファミリー分子。細胞増殖、生存維持、サイトカイン産生、細胞代謝などを促進する。CD28が同定されて以降、T細胞の活性化を正あるいは負に制御する多くの補助刺激受容体が発見されたが、CD28はこれら分子群の発現調節も行うため、T細胞補助刺激受容体のマスター分子と考えられている。 - 6.リン酸化酵素
リン酸基をほかのシグナル伝達分子に付加する酵素で、キナーゼとも呼ぶ。一般に、リン酸基の付加はシグナルの伝達を意味し、分子中のチロシン/セリン/スレオニン残基がリン酸化される。 - 7.生体分子イメージング
細胞内の分子を可視化する技術。蛍光を用いて、蛍光顕微鏡やレーザー顕微鏡で観察する場合が多い。着目している分子と蛍光タンパク質との融合タンパク質を細胞内で発現させたり、蛍光物質で標識した抗体を用いたりするため、細胞内外の分子の動きを、細胞が生きたまま観察できる。蛍光タンパク質や蛍光物質には、発光波長の違いによりさまざまな色がある。緑色蛍光タンパク質であるGFP(Green Fluorescence Protein)が基本になっているが、複数の色を組み合わせることにより、多数の分子を同時に観察することができる。 - 8.制御性T細胞
免疫抑制機能を有するT細胞サブセットの1つ。T細胞受容体やCD4のほか、インターロイキン2受容体アルファ鎖(CD25)、CTLA-4、マスター転写因子であるFoxp3などを発現している。免疫抑制機能のメカニズムとしては、樹状細胞や活性化T細胞との直接的な相互作用のほか、ベータ型変異増殖因子(TGF-β)やインターロイキン10などの抑制性サイトカインの放出などが考えられている。 - 9.不応答
本来、細胞が活性化する刺激を加えても、反応を示さない状態を示す。生理的には、細胞の過度の活性化を回避するため、細胞自身に備わっている機能と考えられる。 - 10.リガンド
受容体(レセプター)が結合する相手方の分子のこと。受容体はリガンドと結合することで、受容体から、細胞質や核にある次の分子へと情報が伝達される。
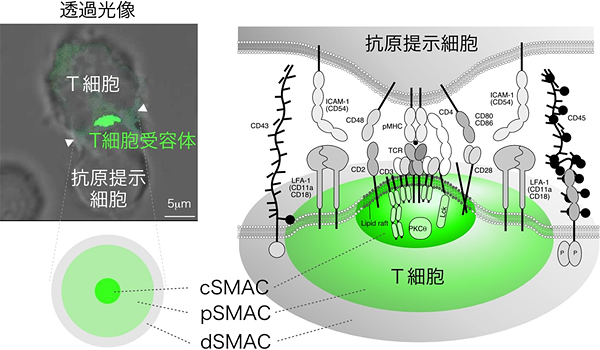
図1 免疫シナプスの構造
T細胞は抗原提示細胞と強固に接着し、提示された抗原情報を獲得する(左写真)。接着面では、それぞれの細胞表面にある受容体や細胞内のシグナル伝達分子が規則正しい同心円状構造を構築する。この構造は、神経のシナプスの構造に似ていることから、「免疫シナプス」と呼ばれている。免疫シナプスは、中心部から、T細胞受容体とシグナル伝達分子が集まるcSMAC(central-Supramoleular Activation Cluster)、接着分子が集まるpSMAC(peripheral-SMAC)、脱リン酸化酵素など背の高い分子が集まるdSMAC(distal-SMAC)の3層構造で構成されている。
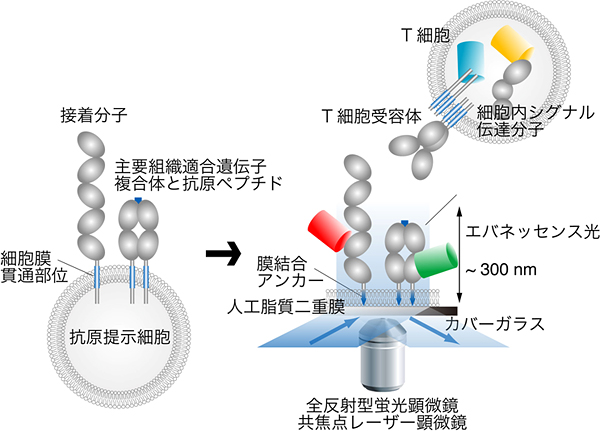
図2 プレイナーメンブレンによるT細胞受容体および細胞内分子の観察方法
実際の細胞は丸く、また細胞膜には複雑な凸凹があり、直接の顕微鏡観察には不向きである。プレイナーメンブレンを用いた方法では、抗原提示細胞に発現している主要組織適合遺伝子複合体や接着分子などの細胞表面分子に膜結合アンカー配列を付加し、カバーガラス上に作製した平らな人工脂質二重膜に導入する。この抗原提示細胞の細胞膜を疑似したプレイナーメンブレン上にT細胞を落下させ、蛍光顕微鏡にて細胞内外の分子の挙動を観察する。観察したい分子は、蛍光ラベルされた抗体で染色したり、直接蛍光物質を付加したり、蛍光タンパク質とのキメラ分子を作製したりする。全反射型蛍光顕微鏡はレーザーの入射角を大きくし微妙に漏れ混むエバネッセンス光を利用するため、カバーガラスから数百ナノメートルといった細胞膜近傍の分子の観察が可能であり、また、このような弱い光を用いることで1分子レベルでの解析まで対応している。また、共焦点レーザー顕微鏡では、細胞表面から細胞内部までの分子の挙動を、幅広い波長の蛍光を用いて観察することができる。
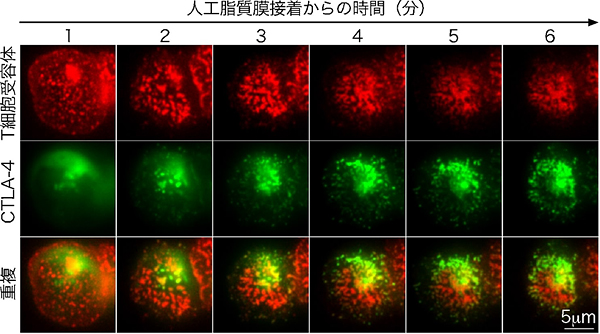
図3 T細胞受容体とCTLA-4ミクロクラスターの蛍光顕微鏡観察
蛍光タンパク質を付加したCTLA-4(緑)をT細胞に遺伝子導入後、プレイナーメンブレン上に落下させ、全反射型蛍光顕微鏡を用いて、CTLA-4とT細胞受容体(赤)のリアルタイム観察を行った。細胞質内に貯蔵されていたCTLA-4は、プレイナーメンブレン接着と同時に細胞表面に移動し、CTLA-4ミクロクラスターを形成する。CTLA-4ミクロクラスターは速やかにT細胞受容体ミクロクラスターと共局在(緑+赤=黄色)し、T細胞受容体ミクロクラスターの中心部への動きと共に移動する。その後もCTLA-4は細胞質から細胞表面への移動を続け、プレイナーメンブレン接着から5分後には、中心部のT細胞受容体を取り囲む輪状構造を形成する。
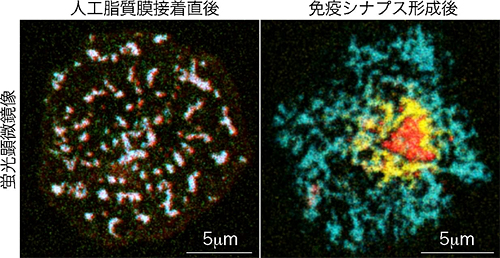
図4 免疫シナプスにおけるCTLA-4とCD28クラスターの競合
蛍光タンパク質を付加したCD28(水色)とCTLA-4(黄色)をT細胞に遺伝子導入後、プレイナーメンブレン上に落下させ、共焦点レーザー顕微鏡を用いてCD28、CTLA-4、T細胞受容体(赤)のリアルタイム観察を行った。
(左)プレイナーメンブレン接着直後、CTLA-4はまだ細胞表面には出現しておらず、T細胞受容体とCD28のみが共局在した(水色+赤=白)ミクロクラスターが形成される。
(右)接着から20分後、T細胞受容体とCD28は分離し、T細胞受容体は免疫シナプス中心に集まるが(赤)、プレイナーメンブレン接着後に細胞表面に現れたCTLA-4がシナプス中心を占拠し(黄色)、CD28は免疫シナプスの外側へ排除されてしまう。
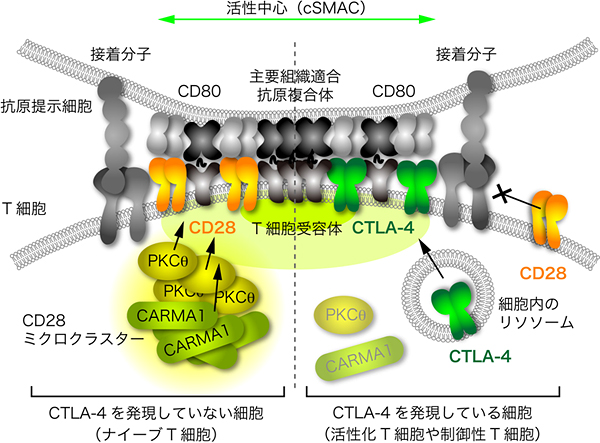
図5 CTLA-4ミクロクラスターによるT細胞活性化の抑制機構
これまで一度も活性化刺激を受けていないナイーブT細胞では、CTLA-4を発現していないため、抗原提示細胞との接着により正の補助刺激受容体であるCD28ミクロクラスターが中心の活性化部位に集まり、PKCθおよびその下流アダプターCARMA1を集めて会合し、持続的な活性化を行う(図左)。一方、活性化T細胞や制御性T細胞では、CTLA-4が細胞内のリソソームに蓄えられており、活性化刺激に伴って、中心の接着部位に誘導される(図右)。一度細胞表面に発現したCTLA-4は、リガンドCD80/CD86と高親和性で結合し、CD28/PKCθを免疫シナプスの外側に追いやることによって、持続的活性化を抑制する。すなわち、CD28/PKCθ/CARMA1およびCTLA-4の集まる細胞内部位は、持続的活性化の活性中心であり、補助刺激の細胞内伝達場所であることが判明した。
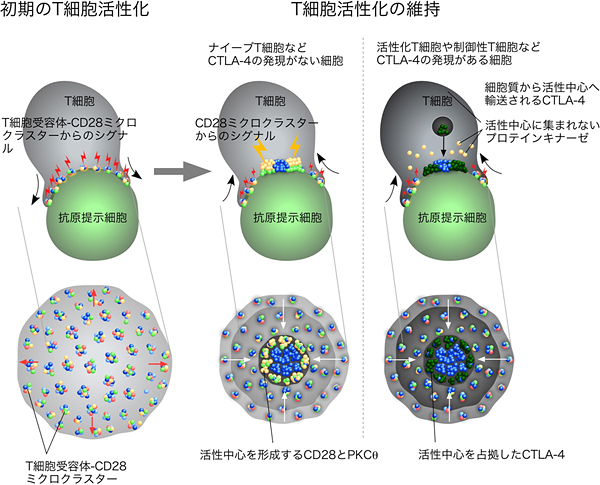
図6 T細胞受容体ミクロクラスターモデル
(左)T細胞が抗原提示細胞もしくはプレイナーメンブレンに接着すると、T細胞受容体が抗原提示細胞上の抗原と結合し、T細胞受容体を核とする分子の集合体「ミクロクラスター」を形成する。このミクロクラスターには、T細胞受容体下流のキナーゼとアダプターが含まれ、シグナル伝達分子のクラスターとしてT細胞の初期の活性化を引き起こす。抗原提示細胞上にCD28のリガンドであるCD80およびCD86が存在すると、CD28がPKCθを呼び寄せ、T細胞受容体/CD28ミクロクラスターを形成し、より強力なシグナルを伝える。
(中)初期の接着から5~10分が経過すると、T細胞受容体は接着面の中央部に移動し、キナーゼとアダプターは解離し、沈静化へと進むが、CD28はT細胞受容体の周囲に輪状構造を構築し、PKCθをとどまらせることにより、T細胞の活性化を維持する。また、接着面の辺縁では、小さいながらもT細胞受容体/CD28ミクロクラスターの形成が続き、これらも、T細胞活性化の維持に寄与していると考えられている。
(右)一方、活性化T細胞や制御性T細胞などCTLA-4を高発現している細胞では、細胞内のリソソームに貯蓄されていたCTLA-4が、T細胞活性化に伴い刺激の強い活性中心に輸送される。細胞膜上に発現したCTLA-4は、CD28とリガンドとの結合を阻害して、活性中心を占拠し、CD28とPKCθを排除する。このCTLA-4による拮抗阻害が、T細胞の過剰な活性化を調節していると考えられている。
