2010年10月21日
独立行政法人 理化学研究所
脳血管内皮細胞特異的なアミロイドβ前駆体タンパク質を発見
-アルツハイマー病関連のアミロイドβ蓄積機構に新たな可能性-
ポイント
- ヒト脳血管内皮細胞が、アミロイドβ前駆体タンパク質770(APP770)を発現
- APP切断産物はニューロン型か脳血管内皮型か判別可能
- ヒト脳脊髄液中に見いだしたAPP770切断産物は、脳疾患マーカーの候補に
要旨
独立行政法人理化学研究所(野依良治理事長)は、ヒトの脳血管内皮細胞に、神経細胞(ニューロン)と異なるユニークなアミロイドβ前駆体タンパク質(APP)が発現していることを初めて発見し、このAPPがアルツハイマー病と深いかかわりを持つ老人斑の主成分であるアミロイドβペプチド(Aβ)※1を産生することを明らかにしました。理研基幹研究所(玉尾皓平所長)システム糖鎖生物学研究グループ(谷口直之グループディレクター)疾患糖鎖研究チームの北爪しのぶ副チームリーダー、立田由里子テクニカルスタッフらと脳科学総合研究センターの西道隆臣チームリーダー、福島県立医科大学の橋本康弘教授、本多たかし教授らとの共同研究による成果です。
アルツハイマー病は、最も代表的な老人性認知症疾患で、脳実質にAβが蓄積することが原因で発症すると考えられています。一方で、実に9割近いアルツハイマー病患者で、脳血管壁にもAβが蓄積することが確認されています。Aβは、APPが2種類のプロテアーゼで切断されて生じることが分かっていますが、脳実質に蓄積するAβは、主にニューロンに発現するAPP(APP695)から生じると考えられる一方で、脳血管壁に蓄積するAβの由来は不明のままでした。
研究グループは、脳血管内皮細胞にニューロンと異なるAPP(APP770)が発現していることを発見しました。APP770もAβを産生することが分かり、このAβが脳血管壁に蓄積し得ることを明らかにしました。さらに、Aβの生成過程でAPP切断産物として生じ、血清やヒト脳脊髄液に分泌されるsAPPβも、ニューロン型(sAPP695β)と脳血管内皮細胞型(sAPP770β)が存在し、相互識別が可能であることも見いだしました。
血管内皮細胞型APP770由来のsAPP770βは、血管内皮細胞が何らかの障害を受けて量的に変化することが考えられるため、今後、アルツハイマー病や脳血管性認知症などの認知障害の新たな診断マーカーとなることが期待されます。 本研究成果は、米国の科学雑誌『Journal of Biological Chemistry』の2011年1月号に掲載されます。
背景
アルツハイマー病は、最も典型的な老人性認知症で、脳実質へのアミロイドβペプチド(Aβ)と神経原繊維変化※2の蓄積が主な病理的特徴となっています。病気が進行すると、神経細胞(ニューロン)の脱落により脳が萎縮して、認知障害が現れることが知られています。現在では、Aβの脳実質への蓄積過程が、アルツハイマー病の主たる原因ではないかと考えられていますが、その一方で、実に9割近いアルツハイマー病患者の脳の病理所見で、脳血管壁にもAβが蓄積すること(脳アミロイド・アンギオパチー)が確認されています。この脳アミロイド・アンギオパチーは、アルツハイマー病との相関性が示されているほか、脳内出血の原因となることも分かっています。
Aβは、アミロイドβ前駆体タンパク質(APP)が2種類の酵素で切断されるステップを経て生じます。まず、BACE1プロテアーゼ※3によってβ部位で切断され、次にプレセニリン複合体※4によってγ部位で切断されます(図1)。また、APPには、その生合成過程で生じるAPP695、APP751、APP770という3種類のスプライシングバリアント※5(変型)が存在することが知られおり、このうちニューロンには、APP695が発現していることが分かっています(図2)。脳実質に蓄積するAβは、主としてニューロン型APP695由来であると考えられていますが、血管壁に蓄積するAβの由来は不明のままでした。
研究手法と成果
研究チームは、脳血管内皮細胞自体にAPPの代謝機構が存在するのでないかと考え、ヒト脳血管内皮細胞の解析を行いました。その結果、ニューロン型APP695とは異なるバリアントであるAPP770を発現していることが分かりました。この脳血管内皮型APP770は、β部位とγ部位で切断され、Aβペプチド40および42を産生することも見いだしました。さらに、APP770には、O型糖鎖が結合しているタイプと結合していないタイプが存在し、O型糖鎖を持つタイプだけがAβ産生経路をたどることも明らかにすることができました。また、APP770特異的な抗体を用いてヒト脳切片の免疫染色を行った結果、脳血管内皮部分が染色されることが分かり、実際にヒトの脳血管にAPP770が存在していることが確認できました。
さらに、Aβ生成過程でAPP切断産物として生じ、脳脊髄液や血清中に分泌するsAPPβを解析したところ、ニューロン型APP695のβ部位切断産物であるsAPP695βに加えて、APP770のβ部位切断産物であるsAPP770βを見出すことにも成功しました。AβはAPP770由来、APP695由来ともに共通の構造を持つため、どちらの由来であるかを見分けることが不可能です。しかし、sAPP770βは、APP770に固有の構造を持つため、脳脊髄液や血清中のsAPPβが、ニューロン型か脳血管内皮細胞型かを判別できることが分かりました(図1)。
今後の期待
2010年の時点で、アルツハイマー病にかかる経済コストは世界のGDPの1%を占めると報告されており、認知症対策の重要性が高まっています。認知症の臨床症状を反映する診断薬の開発は認知症対策の中でも重要な課題の1つです。今回、血管内皮細胞がニューロン型APP695とは異なるAPP770を発現することを初めて見いだし、さらにAPP770由来のβ部位切断産物であるsAPP770βが、ヒト脳脊髄液や血清中に存在することも明らかにしました。脳脊髄液や血清中のsAPP770βは血管内皮細胞が何らかの障害を受けて量的に変化することが考えられるため、アルツハイマー病や脳血管性認知症などの認知障害の早期診断マーカーになる可能性を秘めています。研究グループは現在、sAPP770βを定量するためのサンドイッチELISAシステムを(株)免疫生物研究所と共同で開発し、認知障害の早期診断実用化を目指しています(図3)。
発表者
理化学研究所
基幹研究所 システム糖鎖生物学研究グループ
疾患糖鎖研究チーム
副チームリーダー 北爪し のぶ(きたづめ しのぶ)
Tel: 048-467-9616 / Fax: 048-467-9617
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.アミロイドβペプチド(Aβ)
アミロイドβ前駆体タンパク質(APP)からプロテアーゼ(ペプチド結合加水分解酵素)で切断されて産生されるペプチド。アルツハイマー病患者の脳に蓄積が認められ、この蓄積過程がアルツハイマー病の原因であると考えられている。40アミノ酸残基のAβ40に比べ、42アミノ酸残基のAβ42は、より凝集しやすく毒性が高い。 - 2.神経原繊維変化
リン酸化されたタウタンパク質が繊維構造をとって神経細胞内に蓄積したもの。 - 3.BACE1プロテアーゼ
APPをβ部位で切断するプロテアーゼ。 - 4.プレセニリン複合体
APPをγ部位で切断するプロテアーゼ。プレセニリンと3種類の補助因子であるニカストリン、APH-1、PEN-2の複合体から構成されている。 - 5.スプライシングバリアント
RNA前駆体からイントロンを除去し、前後のエキソンを再結合するスプライシング反応は、残るエキソンに多様性がある。このような多様なmRNAをスプライシングバリアントと呼ぶ。
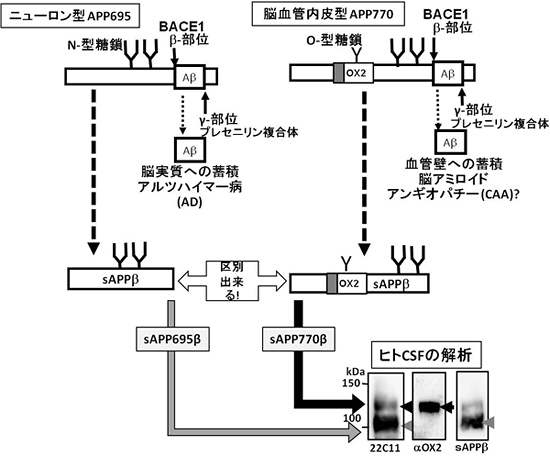
図1 ニューロン由来のAPPと脳血管内皮細胞由来のAPP
ヒト脳脊髄液(CSF)の解析を行った結果、主にニューロン型APP695由来のBACE1切断産物と考えられたsAPP695βと脳血管内皮細胞型APP770由来のBACE1切断産物由来と考えられるsAPP770βを見いだした。AβはAPP695由来、APP770由来とも共通であるため、どちらの由来であるか見分けることができない。しかし、N末端側のAPP切断産物であるsAPPβは、APP770固有の構造を持つため、ニューロン型か、脳血管内皮細胞型かを見分けることができる。
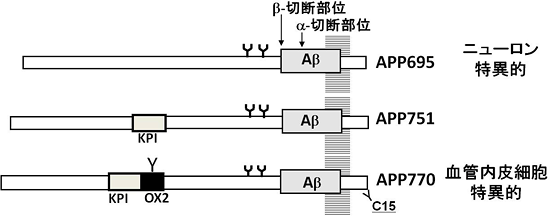
図2 APPのスプライシングバリアント
APPにはmRNAのスプライシングバリアントであるAPP695、751、770が存在する。このうち、APP751にはKPI領域が、APP770にはKPI領域とOX2領域が含まれている。
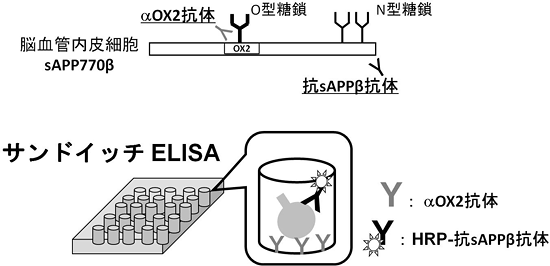
図3 脳血管内皮細胞由来のsAPP770βの定量法
血清や脳脊髄液中のsAPP770βは、脳血管の障害によって量的に変動する可能性がある。sAPP770βを検出するために抗OX2抗体と抗sAPPβ抗体を組み合わせたサンドイッチELISAを(株)免疫生物研究所と共同開発している。
