2010年12月23日
独立行政法人 理化学研究所
異常糖タンパク質を捕まえるレクチンOS-9の立体構造を解明
-糖鎖を目印とするタンパク質の品質管理の仕組みを解く-
ポイント
- 異常型の糖鎖を特異的に認識するWWモチーフを初めて発見
- レクチンOS-9がWWモチーフを介して異常型の糖鎖を見分ける
- 異常タンパク質の分解にかかわるタンパク質群の構造生物学の推進を容易に
要旨
独立行政法人理化学研究所(野依良治理事長)は、細胞の小胞体内で糖鎖を目印にして異常な糖タンパク質※1を捕まえるレクチン※2、OS-9※3の立体構造を、X線結晶構造解析と核磁気共鳴(NMR)解析で初めて解明し、マンノース※4残基が切り取られた異常型の糖鎖を選択的に認識する仕組みを明らかにしました。これは、理研基幹研究所(玉尾皓平所長)糖鎖構造生物学研究チームの山口芳樹チームリーダー、佐藤匡史研究員らと東京大学の山本一夫教授らとの共同研究による成果です。
細胞小器官の1つで、タンパク質の合成工場である小胞体では、タンパク質が正しく機能するための立体構造を持つように折り畳む(フォールディング)などの作業が盛んに行われています。また、立体構造の形成に失敗した異常なタンパク質を正常な立体構造に戻したり、あるいは分解したりする「小胞体品質管理機構※5」と呼ばれるタンパク質合成の監視システムも備えています。この品質管理機構が破綻すると、不要なタンパク質が細胞内に蓄積して細胞の機能不全や細胞死を引き起こし、アルツハイマー病をはじめとしたさまざまな疾患をもたらすことが知られています。
小胞体では、レクチンや糖加水分解酵素などが、小胞体で作られたタンパク質に共有結合したN型糖鎖※1の微細な違い(マンノースやグルコースの数など)を目印としてタンパク質の品質を管理しています。この糖鎖は、DNAとタンパク質に続く「生命の第三の鎖」として注目されており、最近の研究から、小胞体品質管理機構と密接な関係があることが明らかになっています。これまで研究グループらは、輸送レクチン※2の立体構造を解明し、正常な立体構造を獲得した糖タンパク質の糖鎖認識と細胞内輸送の仕組みを解明してきましたが、異常糖タンパク質を捕まえるレクチンの立体構造とその仕組みは明らかにされていませんでした。
研究グループは、異常糖タンパク質の糖鎖を認識するレクチンOS-9に着目し、その立体構造を明らかにしました。解析の結果、異常型の糖鎖(α1,6結合※6したマンノース3糖)と結合するOS-9のWWモチーフ※7を発見し、OS-9がWWモチーフを介して異常型の糖鎖と選択的に結合する仕組みを明らかにしました。
本研究成果は、文部科学省科学研究費補助金・特定領域研究「タンパク質の社会」、大阪大学グローバルCOEなどの支援を受けて行ったもので、米国の科学雑誌『Molecular Cell』(12月23日号)に掲載されるに先立ち、オンライン版(12月22日付け:日本時間12月23日)に掲載されます。
背景
細胞内で糖タンパク質がたどる成熟、輸送、分解といった運命は、タンパク質に結合している糖鎖と、それを認識するさまざまな細胞内レクチンとの相互作用によって決定されています。例えば、高マンノース型糖鎖※1は、小胞体品質管理機構で糖タンパク質の運命を決める“シグナル”としての役割を担っています。小胞体で高マンノース型糖鎖を付加されたタンパク質のうち、正常な立体構造を獲得した糖タンパク質は、VIP36などの輸送レクチンによりゴルジ体(細胞外に分泌されるタンパク質をさらに糖鎖修飾する細胞小器官)へ輸送されます。一方、フォールディングに失敗した異常糖タンパク質は、結合する高マンノース型糖鎖がEDEM(エデム)と呼ばれるマンノシダーゼ※4により5~7糖のマンノースを含む糖鎖まで切り取られた後、MRH(マンノース6リン酸受容体相同)ドメイン※8を持つレクチンOS-9により認識され、細胞質へ逆行輸送され、最終的に分解されます(図1)。
これまで、OS-9の立体構造に関する報告はなく、なぜ異常糖タンパク質とOS-9との結合にマンノース残基の切り取りが必要なのか、またどのようにOS-9は切り取られた糖鎖を特異的に認識するのか、などの詳しい糖鎖認識の仕組みは不明でした。今回研究グループは、ヒトOS-9のMRHドメインと異常型の糖鎖(マンノース5糖)との複合体の立体構造解析に挑みました。
研究手法
X線結晶構造解析には、ミリグラム量のタンパク質が必要ですが、特にタンパク質のフォールディングに必要なジスルフィド結合(システイン残基によるS-S結合)を多く持つタンパク質は大量に精製することが困難なため、立体構造解析研究のボトルネックの1つになっています。そこで研究グループは、ドメインの最適化、大腸菌で発現させる融合タンパク質の選択など、さまざまな発現系の設計とリフォールディング法※9の検討を重ね、大量発現系を独自に構築しました。この発現系を用いて、ジスルフィド結合を3個持つ、ヒトOS-9のMRHドメインを、従来法と比較して約5倍量にもなる1L培養当たり4ミリグラムも得ることができました。ヒトOS-9のMRHドメインと異常型の糖鎖(マンノース5糖)からなるマンノペンタオースとの複合体を結晶化することに成功しました。大型放射光施設SPring-8のビームラインBL26B2、台湾放射光施設National Synchrotron Radiation Research Center(NSRRC)のビームラインBL13B1、高エネルギー加速器研究機構(KEK)Photon FactoryのビームラインNE3Aでこの結晶のX線回折実験を行い、MRHドメインとマンノース5糖の複合体の三次元構造を解明しました。また、NMRを用いて、X線回折実験では明瞭に観測できなかったMRHドメインとマンノース5糖との結合部分の一部を解析し、その結合様式の全貌を明らかにしました。
研究成果
構造解析の結果、OS-9のMRHドメインは、扁平なβバレル構造※10を形成しており、マンノース6リン酸受容体とは異なるジスルフィド結合様式とβシート構造を持つユニークな立体構造をしていることが分かりました(図2)。また、興味深いことに、MRHドメインの糖鎖結合部位は、マンノース6リン酸受容体と同様のアミノ酸残基に加え、特徴的な連続する2つのトリプトファン残基から構成されていました(図3A)。研究グループは、この糖鎖結合部位を“WWモチーフ”と名付けました。
結晶構造データと溶液中でのNMR解析およびWWモチーフの変異体を用いた結合実験などを合わせて、OS-9のMRHドメインはWWモチーフを介して、高マンノース型糖鎖のα1,6結合からなるマンノース3糖、Man(B)‐Man(4’)‐Man(3)部分と特異的に結合することを解明しました(図3B)。この研究により、マンノース残基が切り取られた異常型の高マンノース型糖鎖を、OS-9が特異的に認識する仕組みを世界で初めて明らかにすることができました。
今後の期待
OS-9の上流では、異常な糖タンパク質に結合する糖鎖の特定のマンノース残基を分解するマンノシダーゼ活性を持つ酵素が存在し、OS-9に分解シグナルの糖鎖構造を提示します(図3B)。今後、これらの酵素の立体構造解析を進めることで、どのようにして異常なタンパク質を見分けて、分解シグナルをOS-9に提示するのか、など分解シグナルの提示にまつわる疑問を立体構造的な観点から明らかにします。
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究領域
システム糖鎖生物学研究グループ
糖鎖構造生物学研究チーム
チームリーダー 山口 芳樹(やまぐち よしき)
Tel: 048-467-9619 / Fax: 048-467-9620
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.糖タンパク質、N型糖鎖、高マンノース型糖鎖
糖タンパク質とは、タンパク質中のアスパラギン残基の側鎖と結合する N型糖鎖や、セリンおよびスレオニン残基の側鎖と結合する O型糖鎖など、糖鎖が結合したタンパク質の総称である。タンパク質の50%以上が糖鎖修飾を受けることが知られている。高マンノース型糖鎖は、2つの N-アセチルグルコサミン残基と5~9糖のマンノース残基から構成される N型糖鎖の一種。糖タンパク質の品質管理機構などにおいて、目印(シグナル)として重要な機能を担っている。 - 2.レクチン、輸送レクチン
糖鎖と結合するタンパク質の総称。例えば、輸送レクチンは、糖タンパク質の糖鎖部分と結合し、細胞小器官間の糖タンパク質の輸送を行っている。 - 3.OS-9
OS-9の名前はOsteosarcoma amplified 9に由来し、当初骨肉腫で高度に発現される遺伝子として発見された。最近の研究により、OS-9は小胞体内に存在するレクチン (※2参照)で、小胞体品質管理機構 (※5参照)にかかわることが明らかになった。 - 4.マンノース、マンノシダーゼ
マンノースは、糖鎖を形成する単糖構成成分の1つで、 N型糖鎖のコア構造を形成する。このマンノースを加水分解する酵素がマンノシダーゼであり、マンノースを糖鎖から切断する。EDEMは小胞体に存在するマンノシダーゼで、哺(ほ)乳動物では3種類存在し、異常糖タンパク質上の特定のマンノースを切断する。 - 5.小胞体品質管理機構
小胞体で生合成された糖タンパク質は、正しい高次構造(フォールディングや、ほかの糖タンパク質との複合体形成)をとったときにだけ分泌経路に乗ることができ、その過程がうまくいかない糖タンパク質は、小胞体に留め置かれる。この機構を工場での品質管理に例えて名付けられた。 - 6.α1,6結合
糖鎖は、2分子以上の単糖がグリコシド結合したものである。グリコシド結合は、糖構造の平面より下方向に置換基が結合したαグリコシド結合と、平面より上方向に結合したβグリコシド結合とに区別される。α1,6結合とは、糖の1位の酸素ともう片方の糖の6位の炭素がαグリコシド結合したものである。 - 7.WWモチーフ
トリプトファン残基が2つ連続したアミノ酸配列で、糖鎖と結合するアミノ酸配列モチーフとしては初めてのもの。OS-9と類似の機能を有するタンパク質でも保存されていたので、WWモチーフと名付けた。 - 8.MRH(マンノース6リン酸受容体相同)ドメイン
MRHの名前は、Mannose-6-phosphate Receptor Homology(マンノース6リン酸受容体相同)に由来する。マンノース6リン酸受容体とは、 N型糖鎖上に付加するマンノース6リン酸を輸送シグナルとして、さまざまなリソソーム加水分解酵素をゴルジ体および細胞表面から消化器として働いているリソソームへ運ぶ輸送レクチン (※2参照)の1つである。ドメインとはαヘリックス、βシートなどの二次構造がいくつか組み合わさったモチーフが一体となり局所的にコンパクトな半独立のユニットを作ったもの。 - 9.リフォールディング法
生理活性を持たない不溶性タンパク質(インクルージョンボディ)として生産されたタンパク質を、尿素やグアニジン塩酸塩などの変性剤で可溶化させた後、大量の再生用緩衝液に希釈するなどにより、再び活性を持つ立体構造に巻き戻し(リフォールディング)をする方法。 - 10.βバレル構造
βバレル(Beta barrel)はタンパク質の三次構造の1つであり、大きなβシートがねじれて樽状の構造をしている。
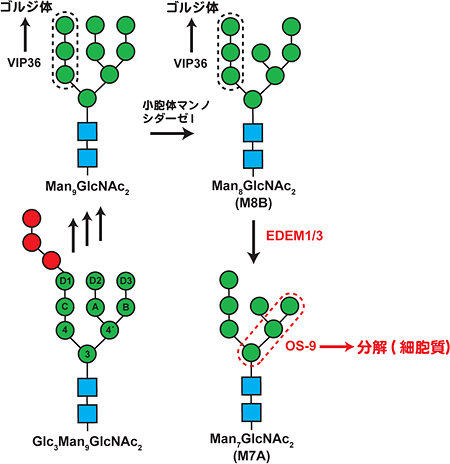
図1 小胞体品質管理機構におけるN型糖鎖のプロセッシングとそれらを認識する細胞内レクチンの一例
小胞体内では、まず2つのN-アセチルグルコサミン残基(■)、9つのマンノース残基(●)、3つのグルコース残基(●)から構成される14糖の糖鎖が、タンパク質中のアスパラギンの側鎖に結合する(左下)。その後、グルコースの脱離や付加などを介して、正しい立体構造を獲得した正常な糖タンパク質のみ、VIP36などの輸送レクチンによりゴルジ体に運ばれる(左上、右上)。一方、フォールディングに失敗した異常糖タンパク質は、EDEMにより5~7糖のマンノースを含む糖鎖まで切り取られ、OS-9との結合を介して細胞質へ輸送され、最終的に分解される(右下)。
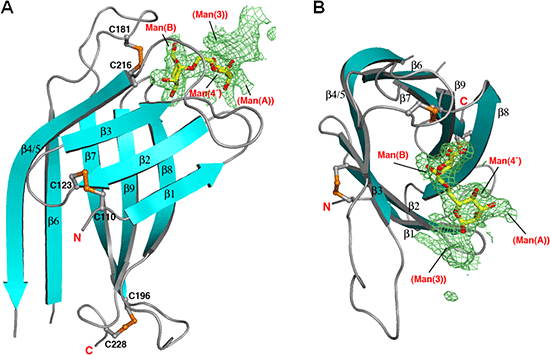
図2 OS-9 MRHドメインとマンノース5糖複合体の構造
(A:横から見た図、B:上から見た図)
OS-9のMRHドメインは、扁平なβバレル構造を形成しており、3カ所のジスルフィド結合を持っている(オレンジ色)。結晶構造解析では、Man(B)‐Man(4’)からなるマンノース2糖の明瞭な電子密度を観測できた。
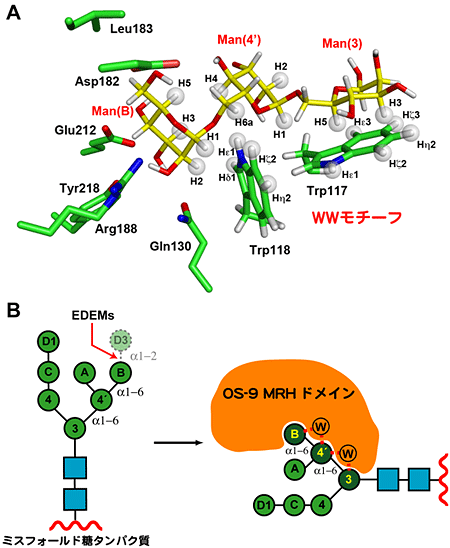
図3 OS-9によるWWモチーフを介した糖鎖認識メカニズム
A:結晶構造データ、溶液中でのNMR解析およびWWモチーフの変異体を用いた結合実験などを合わせて、OS-9のMRHドメインがWWモチーフを介して、α1,6結合からなるマンノース3糖と結合することを明らかにした(NMR解析で相互作用が確認された原子を半透明のボールで示した)。
B:OS-9のMRHドメインは、WWモチーフを介して、異常型タンパク質が持つ高マンノース型糖鎖のMan(B)‐Man(4’)‐Man(3)部分と特異的に結合する。つまり、EDEMによる切り取りを受けていないMan(D3)が結合している正常型タンパク質が持つ高マンノース型糖鎖とは強く結合できない。このように、OS-9は糖鎖を目印にして、タンパク質の品質管理を行っている。
