2011年3月11日
独立行政法人 理化学研究所
4つのケイ素で「ひし形」の新環状化合物を初合成
-正方形の4つのパイ電子はどうなるか?炭素とケイ素の違いを解明-
ポイント
- 4つのケイ素でひし形の化合物「テトラシラシクロブタジエン」を世界で初めて合成
- 4つの炭素では長方形を、4つのケイ素ではひし形を形成
- 分子の結合論に関する基礎科学の新知見が蓄積し、シリコン単体の表面科学などへ寄与
要旨
独立行政法人理化学研究所(野依良治理事長)は、4つのケイ素原子でできた新環状化合物「テトラシラシクロブタジエン※1」の合成に世界で初めて成功し、この化合物が、4つの炭素原子でできた長方形のシクロブタジエンとは異なり、ひし形であることを発見しました。これは、理研基幹研究所(玉尾皓平所長)機能性有機元素化学特別研究ユニットの玉尾皓平ユニットリーダー、松尾司副ユニットリーダー、鈴木克規基幹研究所研究員、先端技術基盤部門連携支援チームの橋爪大輔先任研究員及び京都大学大学院工学研究科分子工学専攻の田中一義教授、笛野博之助教による共同研究の成果です。
6つの炭素原子で構成する芳香族化合物※2の代表格ベンゼンが、正六角形の安定な芳香族性※3の分子であるのに対し、4つの炭素原子で構成するシクロブタジエンは、長方形の極めて不安定な反芳香族性※3の分子です。この炭素と元素周期表では同じ14族に属し、その真下に位置しているのがケイ素です。一般に、同族元素は性質が似ており、ケイ素で炭素を置換したヘキサシラベンゼンやテトラシラシクロブタジエンは、実用化の面だけでなく、化学結合の仕組みを知る基礎科学の面でも多くの知見を与えると期待されています。しかし、ケイ素原子間の不飽和結合の不安定さが原因で、これまで人工的に合成した例がありませんでした。
研究グループは、独自に開発した炭素原子24個と水素原子37個の巨大原子団である、かさ高い置換基「EMind※4」を用いて、ケイ素原子間の不飽和結合を保護した結果、テトラシラシクロブタジエンの合成に世界で初めて成功しました。炭素原子で構成するシクロブタジエンは4つのパイ電子※5を持ちますが、電子が均等に分布する正方形は不安定なため、2本の二重結合と2本の単結合からなる長方形を形成して安定化します。一方、ケイ素原子で構成するテトラシラシクロブタジエンは、このパイ電子が2個ずつケイ素原子上に局在してプラスとマイナスに電荷が分かれるため、ひし形を形成して安定化することを初めて見いだしました。この成果は、分子の結合論に関する基礎的な知見を与え、機能性物質の開発やシリコン単体の表面科学など、幅広い分野に貢献すると期待できます。
本研究成果は、文部科学省科学研究費補助金特別推進研究「革新的な汎用性立体保護基の導入による新奇な有機元素化合物の構築と機能開発(研究代表者:玉尾皓平)」の一環として行われ、米国の科学雑誌『Science』(3月11日号)に掲載されます。
背景
有機化学では、元素周期表の第2周期の元素である炭素、窒素、酸素などが中心的な役割を果たしており、それらの元素の間で二重結合や三重結合などの不飽和結合が安定に形成されます。これらの結合は、シグマ結合※6とそれに直交したパイ電子によるパイ結合※6から構成されます。有機化合物が示す発光や導電性といった物性の多くは、化合物の中で特に動きやすいパイ電子に起因しています。6個の炭素原子からできたベンゼンは、シグマ結合によって正六角形を形成し、6個のパイ電子を有します。この6個のパイ電子は、六角形上を動き回って分子を安定化させるとともに、全ての電子が6個の炭素原子上に均等に分布するため、電荷も均等となっています。これを芳香族性と呼び、ベンゼンは芳香族化合物の代表例です。一方、4個の炭素原子からできたシクロブタジエンは、シグマ結合によって四角形を形成し、4個のパイ電子を有します。この4個のパイ電子が四角形の上を動き回ると、ベンゼンとは逆に不安定化します。これを反芳香族性と呼びます。
一般に、正方形上の4個のパイ電子は、二重結合のペアーを作って長方形に変形する(二重結合は単結合よりも短いために長方形になる)ことが知られています。一方、理論的には、原子上でペアーを作ってひし形に変形する(4本の結合の長さが等しい)ことも予測されていました(図1)。長方形では4個の原子の電荷は均一で安定化しますが、ひし形ではプラスの原子とマイナスの原子に分かれて安定化します。炭素原子で構成するシクロブタジエンの場合には、長方形を形成して安定化することが実験的に確認されており、ひし形の形成は見つかっていません。
ケイ素は、元素周期表では炭素と同じ14族に属しており、炭素の真下(第3周期)に位置します。第3周期以降の高周期元素の不飽和結合は極めて不安定で、長い間存在しないとされてきました。しかし1981年、アメリカのウィスコンシン大学の研究者らが、かさ高い立体保護基を用いて、ケイ素原子間の二重結合を持つ化合物「ジシレン」を初めて安定に合成しました。それ以来、さまざまな立体保護基を用いて、高周期元素による不飽和結合の化合物の合成が試みられてきました。中でも、6個のケイ素原子でできたヘキサシラベンゼンや4個のケイ素原子でできたテトラシラシクロブタジエンは、化学結合の仕組みを探る基礎科学の面から大変注目される分子であるため、世界中の研究者がその合成に挑戦してきましたが、いまだ成功していませんでした。
研究グループは、元素周期表にあるさまざまな元素の特徴を理解し、自由自在に組み合わせることで化学結合の理解を深めるとともに、新しい光・電子物性や機能を持つ物質を生み出すことを目指しています。炭素は生命体を構成する有機物の中心元素であるのに対し、ケイ素はガラス産業やシリコン半導体などのエレクトロニクス産業を支える無機物の中心元素で、2つの元素の役割は大きく異なっています。研究グループは、化学結合の基礎的な知見を蓄積するとともに、同族元素でありながら大きく役割の異なる炭素とケイ素の性質を探るため、シクロブタジエンの炭素原子をケイ素原子に変える新たな化合物の合成に挑みました。
研究手法と成果
研究グループは、独自に開発したかさ高い置換基をケイ素原子につなげることで、不安定なケイ素間の不飽和結合を立体的に保護し、機能性物質の構成単位として利用する研究を進めてきました。今回、かさ高さを適切なサイズに調節して、炭素原子24個と水素原子37個からなる巨大原子団である立体保護基「EMind」をケイ素原子につなげたところ、4つのケイ素原子で構成するテトラシラシクロブタジエンの合成に初めて成功しました(図2)。EMind基は、市販の化成品を出発原料にして2段階の反応で大量合成することが可能で、さらに2段階の反応を経てケイ素原子とつなげることができます。最終的には、EMind基と3つの臭素原子からなるトリブロモシランをリチウム金属イオンにより-80℃で還元反応させ、テトラシラシクロブタジエンを含む混合物を得ました。この混合物から不純物を室温で除去した後、低温(-30℃)の環境下で再結晶させた結果、単離収率は9%とそれほど高くないものの、オレンジ色のテトラシラシクロブタジエンの結晶をきれいに取り出すことができました。
合成した化合物の分子構造をX線で解析したところ、テトラシラシクロブタジエンの形がひし形であることを見いだしました(図3)。4辺の長さは平均2.28Å(1Åは10-10m)でほぼ等しく、一般的なケイ素の単結合(2.34Å)と二重結合(2.14Å)の長さの中間の値でした。また、ひし形の内角の和がちょうど360度であることから、4つのケイ素原子が同一平面上にあることが分かりました。さらに、核磁気共鳴(NMR)分光法で解析したところ、高磁場領域(-50ppm)と低磁場領域(+300ppm)にピークを観測しました。この差(化学シフト値)が非常に大きなことから、4つのケイ素原子は、それらが全く同じ環境下にありながら、2つのプラス原子と2つのマイナス原子に電荷が分かれて構造を安定化している(図4左)ことを示唆できました。
密度汎関数理論により電子の状態を計算すると、テトラシラシクロブタジエンはひし形が最も安定であり、実験結果とよく一致することを確認しました。また、EMindを水素に置換して単純化した分子の静電ポテンシャルを計算すると、プラスとマイナスに電荷が分かれていること(図4右)がよく分かりました。さらに、化学シフト値から計算すると、ひし形の構造は芳香族性と反芳香族性のいずれも有していないことが分かりました。
テトラシラシクロブタジエンのひし形構造と電荷の分離は、ケイ素の二重結合が炭素の二重結合と比べて弱いことなど、ケイ素固有の性質に基づく結果である考えられます。今回発見したテトラシラシクロブタジエンのひし形形成が、従来のシクロブタジエンの長方形形成と相補的な関係にあり、分子が不安定な反芳香族性をどのように避けるかという、化学結合の理解を深める上で極めて重要な成果となりました。
今後の期待
これまで合成することができなかったテトラシラシクロブタジエンを実現したことにより、今後はケイ素原子でできたヘキサシラベンゼンやポリシラポリアセチレンの研究開発が加速すると予想されます。機能性物質の開発といった実用化の面だけでなく、化学結合の仕組みを探る基礎科学の面へも貢献すると期待されます。また、プラスとマイナスに電荷が分かれた構造は、分子の結合論に関する基礎的な知見を与えるもので、シリコン単体の表面科学や電荷移動錯体など幅広い分野に寄与するものと期待できます。
発表者
理化学研究所
基幹研究所 機能性有機元素化学特別研究ユニット
ユニットリーダー 玉尾 皓平(たまお こうへい)
Tel: 048-467-9894 / Fax: 048-467-9895
副ユニットリーダー 松尾 司(まつお つかさ)
Tel: 048-462-4994 / Fax: 048-462-4995
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.テトラシラシクロブタジエン
4つの炭素が環状に結合し、二重結合を2個有する分子がシクロブタジエン。有機化合物の命名法によると、「シクロ」は環状を意味し、「ブタ(ン)」は4つの炭素からなる有機化合物(アルカン)、「ジ」は数字の2、「エン」は二重結合を表す。分子式はC4H4。シクロブタジエンの合成と単離は極めて難しく、未知な部分が多いことから、”有機化学のモナリザ(Mona Lisa of Organic Chemistry)“とも呼ばれている。この炭素をケイ素に置き換えた分子がテトラシラシクロブタジエン。母体化合物の分子式はSi4H4。 - 2.芳香族化合物
ベンゼンをはじめとする環状の共役系化合物。共役系とは二重結合と単結合が交互に繰り返す系のこと。芳香族性を有する化合物。 - 3.芳香族性、反芳香族性
ベンゼンをはじめとする芳香族化合物が有するパイ電子の非局在化に伴う共鳴安定化、反磁性環電流、求電子置換反応など、芳香族化合物固有の性質や反応性、特別な安定化効果などを総じて芳香族性という。これに対して、シクロブタジエンをはじめとする反芳香族化合物が有するパイ電子の非局在化に伴う共鳴不安定化、常磁性環電流など、反芳香族化合物固有の性質や反応性、特別な不安定化効果などを総じて反芳香族性という。 - 4.EMind
1,1,7,7-tetraethyl-3,3,5,5-tetramethyl- s-hydrindacen-4-ylの略。分子式C24H37の巨大な炭化水素の置換基。ベンゼン環を基本とするアリール基の一種。Rind基をつなげるとパイ電子系骨格の平面性が向上する特徴を持つ。これはRind基の内側の置換基がパイ電子系を上下から挟み込んで、ホッチキスのような役割をするため。 - 5.パイ電子
パイ結合上の電子。結合の方向とは直交している。一般に共役系においてはパイ電子が動き回ることで分子が安定化する。 - 6.シグマ結合、パイ結合
シグマ結合は、結合の軸同士を向き合った原子軌道同士による結合。軌道関数の電子密度がゼロとなる節面(ノード)の数はゼロ個と定義される。一方、パイ結合では、節面の数は1個と定義される。
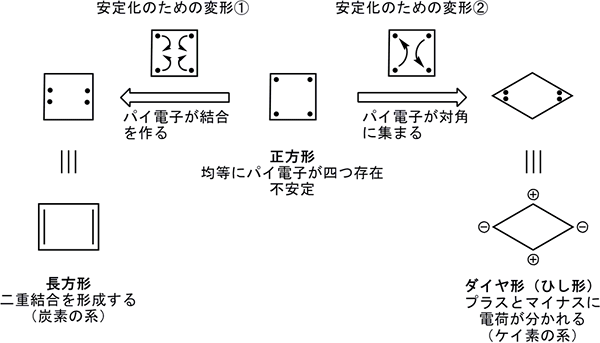
図1 4個の原子で構成する四角形の分子の変形の模式図
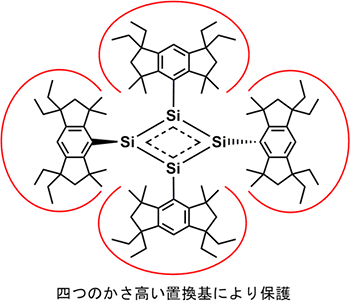
図2 合成したテトラシラシクロブタジエンの化学構造
ケイ素原子(Si)とEMind(赤丸)を結合させて、ひし形のテトラシラシクロブタジエンを合成した。
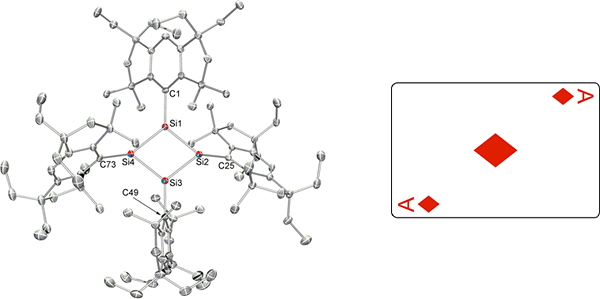
図3 X線解析したテトラシラシクロブタジエンの分子構造とトランプのダイヤのエース
赤の球はケイ素原子の位置、灰色の球は炭素の位置を表す。Si1、 Si2、 Si3、 Si4はそれぞれ1から4番目のケイ素原子、C1、C25、C49、C73はそれぞれ1番目、25番目、49番目、73番目の炭素原子を表す。
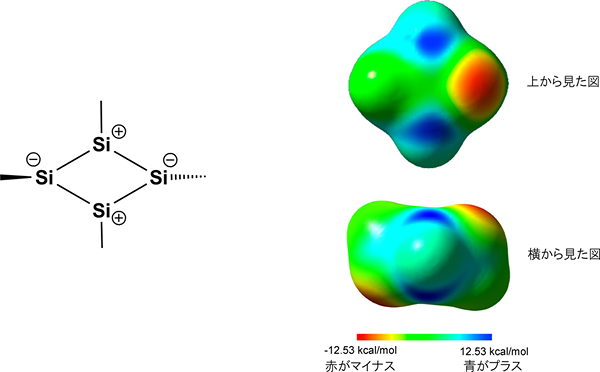
図4 テトラシラシクロブタジエンの電荷の様子
- (左) テトラシラシクロブタジエンのプラスとマイナスに電荷が分かれた化学構造
- (右) テトラシラシクロブタジエンの静電ポテンシャル図
