2011年8月3日
独立行政法人 理化学研究所
がんマーカー「グルタチオン転移酵素」の細胞内蛍光検出法を開発
-がん診断法や投薬前診断法の新手法、基礎から診断まで応用可能-
ポイント
- グルタチオン転移酵素(GST)の触媒反応で保護基を考案
- GSTの反応で蛍光分子の保護基が外れ、無蛍光が蛍光に
- 多色の検出プローブで、細胞内GST量もイメージング
要旨
独立行政法人理化学研究所(野依良治理事長)は、がん診断や投薬前診断に有用なマーカー分子である「グルタチオン転移酵素(GST)」の存在や量を可視化することができるイメージングプローブの開発に成功しました。これは、理研基幹研究所(玉尾皓平所長)伊藤ナノ医工学研究室の阿部洋専任研究員、柴田綾基礎科学特別研究員、伊藤美香ジュニア・リサーチ・アソシエイト、伊藤嘉浩主任研究員らとスウェーデン カロリンスカ研究所のラルフ モルゲンシュテルン(Ralf Morgenstern)教授との国際共同研究による成果です。
グルタチオン転移酵素(GST)は、生体内で異物の解毒機構を担う重要な酵素として知られています。また、がん細胞で高発現することや、異物の解毒機構による薬剤耐性を発揮することも分かってきました。従って、細胞内のGSTを検出する方法は、がん細胞を特定するがん診断法として利用できるだけでなく、その発現量を知ることで、薬剤耐性を考慮した投薬指針を決定する投薬前診断を行うことができます。GSTは、このような重要なタンパク質であるのにもかかわらず、それを検出する有用な蛍光分子が存在しなかったため、医療現場で使用できるような実用的なプローブが求められていました。
研究グループは、アリールスルフォニル保護基※1に着目し、この保護基を市販の蛍光分子に付加して、GSTの触媒反応によってこの保護基が外れるような検出プローブを考案しました。この保護基が蛍光化合物に付加していると無蛍光ですが、GSTが存在すると外れて蛍光を発生することを確認し、多色の検出プローブの開発に成功しました。この成果は、GSTの触媒反応を利用した巧みな検出プローブ設計法を生みだしたことになります。さらに、開発した検出プローブは細胞内のGST量も検出できるため、基礎研究から医療診断まで応用できる画期的な定量判定技術にもなります。
本研究成果は、科学技術振興機構(JST)戦略的国際科学技術協力推進事業「日本-スウェーデン研究交流」における研究交流課題「単一分子レベルの酵素反応解析からがん治療法開発までの複合領域研究」の一環として行われ、米国化学会誌『Journal of the American Chemical Society』に近くオンライン掲載されます。
背景
グルタチオン転移酵素(GST)は、生体内で異物を解毒する機構の一翼を担っている重要な酵素で、異物と細胞内に豊富に存在する3つのペプチド結合からなるグルタチオンを結びつけ、異物‐グルタチオン抱合体を作りだす機能を持ちます。この反応の結果、抱合体は親水性が向上し、多剤耐性タンパク質と呼ばれる薬剤排出ポンプによって生体外に排出され、無毒化します(図1)。一方、がん細胞では、GSTが過剰に発現していることが知られ、がん診断のためのマーカー分子として注目されています。さらに、過剰なGSTは、抗がん薬を速やかに細胞外に排出してしまうため、薬剤耐性の原因にもなっています。従って、がんの投薬治療の方針を決定する上で、細胞のGST量を知ることは非常に重要です。しかし、これまでに報告されているGST検出プローブは、検出感度に問題があるものや、蛍光を発生する際にプローブ自身がグルタチオンと抱合体を形成して細胞外に排出されてしまう問題があり、実用的なGST検出プローブの開発が困難でした。
研究手法と成果
研究グループは、細胞内のGSTを検出するため、市販の蛍光化合物のアミノ基に求電子性のアリールスルフォニル保護基を導入する手法で、検出プローブを合成しました(図2、A)。この検出プローブにGSTとグルタチオンを加えると、GSTの触媒反応によりグルタチオンが検出プローブに対し求核攻撃※2を行います。この反応によりマイゼンハイマー錯体※3が形成された後、検出プローブから保護基が外れると蛍光が発生することを確認しました(図2、B)。この蛍光量から、GSTの量を定量的に測定することができます。今回、蛍光化合物として青色のクマリン※4、緑色のローダミン※4、赤色のクレシルバイオレット※4を用いて行いました。いずれの化合物もアリールスルフォニル保護基を導入することで、ほぼ無蛍光の化合物になりました。このプローブにGSTとグルタチオンを添加すると、アリールスルフォニル保護基が外れてそれぞれの色の蛍光が発生しました(図3)。
次に、GSTとグルタチオン濃度を固定し、合成したクマリン、ローダミン、クレシルバイオレットの各種検出プローブ濃度を変化させて、GSTに対する検出プローブの反応性を検討しました。その結果、それぞれの検出プローブとグルタチオンの反応性は、GSTが存在する場合とGSTが存在しない場合とで比較すると、クマリンプローブは106倍、ローダミンプローブは107倍、クレシルバイオレットプローブは109倍に大きく増加することが確認できました。このことから、開発したプローブがGSTに特異的な基質であることが明らかとなりました。さらにヒトの乳がん細胞株を用いたモデル実験系で、クレシルバイオレットプローブを培地に添加することで細胞内のGST量の検出にも成功しました(図4)。この際、GSTが過剰に発現している細胞では赤色の蛍光が観測できるのに対し、GST量の低い正常細胞では、蛍光はほとんど観測できませんでした。
今後の期待
今回、既存の蛍光剤のアミノ基に保護基を導入することでGST量を検出することができるプローブを得ました。この手法は非常に汎用性が高く、蛍光剤以外の薬剤にも応用が可能です。今後は、この手法を抗がん剤へ応用し、GST量の高いがん細胞に特異的に薬理活性を示すプロドラック※5の開発を進めていきます。
発表者
理化学研究所
基幹研究所 伊藤ナノ医工学研究室
専任研究員 阿部 洋(あべ ひろし)
Tel: 048-467-5749 / Fax: 048-467-9300
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.アリールスルフォニル保護基
芳香環にスルフォニル基(-S(=O2)-)が連結した保護基。 - 2.求核攻撃
電子の豊富な反応基(求核基)が基質の電子不足(求電子的な)部位を攻撃すること。 - 3.マイゼンハイマー錯体
環内の電子密度を減弱させる基(電子求引基)を持つ芳香環に電子の豊富な反応基(求核基)が結合して生じる陰イオン構造。 - 4.クマリン、ローダミン、クレシルバイオレット
クマリンは、塩基性色素の一種。375nm付近の可視光を当てると青色の蛍光を示す。ローダミンは、鮮紅色の塩基性色素の一種。490nm付近の可視光を当てると緑色の蛍光を示す。クレシルバイオレットは、塩基性色素の一種。520nm付近の可視光を当てると赤色の蛍光を示す。 - 5.プロドラッグ
単品では不活性な形態で投与される医薬品。生体内の代謝作用を受けて活性代謝物へと変化し、薬効を示す。
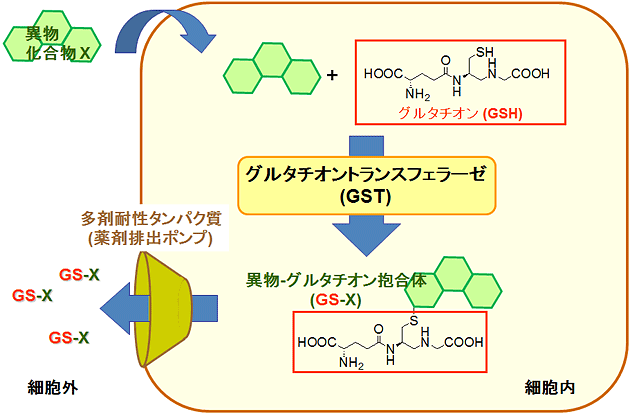
図1 GSTとグルタチオンの異物排出機構
細胞内に取り込まれた異物は、GSTの働きによりグルタチオンとの抱合体になる。この結果、親水性が向上した異物は多剤耐性タンパク質と呼ばれる薬剤排出ポンプにより速やかに細胞外に排出され、無毒化する。
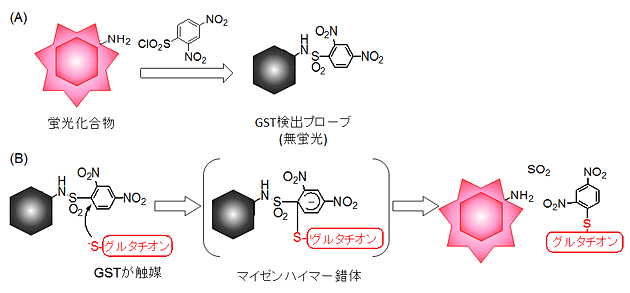
図2 GST検出プローブの合成とGST検出機構
- (A) 市販の蛍光化合物のアミノ基に求電子性のアリールスルフォニル保護基を導入することで無蛍光のGST検出プローブを合成。
- (B) プローブに対するグルタチオンの求核攻撃をGSTが触媒する。この反応の結果、マイゼンハイマー錯体が形成される。次いでこの錯体が分解し、プローブからアリールスルフォニル保護基が外れることで蛍光が発生する。
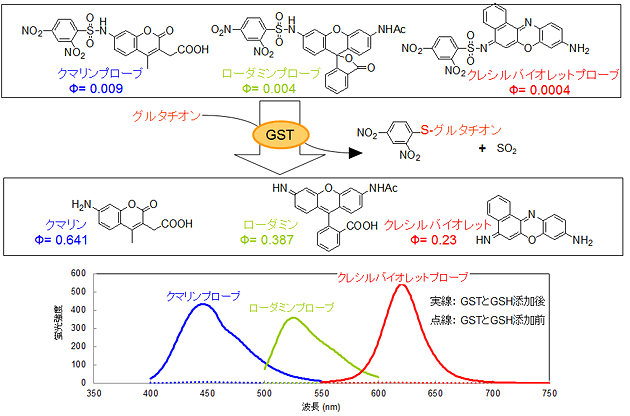
図3 GST検出プローブの構造と各プローブの蛍光スペクトル
いずれの検出プローブもGSTとグルタチオン添加前では無蛍光の化合物である。それに対し、GSTとグルタチオン添加後ではクマリンは450nm、ローダミンは520nm、クレシルバイオレットは620nm付近に蛍光強度が大きく増加した。
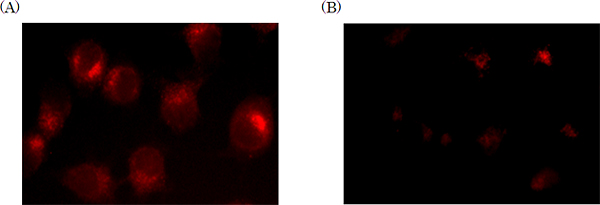
図4 細胞内のGST量の検出
クレシルバイオレットプローブを用いてヒトの乳がん細胞内のGSTの検出を行った。その結果、GSTが過剰に発現している細胞(A)では、クレシルバイオレットの強い赤色の蛍光が見られた。それに対し、正常細胞(B)では、ほとんど蛍光が観測できなかった。
