ポイント
- 膵臓β細胞の血糖認識にはグルコーストランスポーターの糖鎖修飾が必要
- 膵臓β細胞の糖鎖修飾機能を維持することで糖尿病を予防
- ヒト2型糖尿病患者のβ細胞でも、糖鎖修飾機能が低下
要旨
独立行政法人理化学研究所(野依良治理事長)は、膵臓(すいぞう)β細胞※1で起きる多分岐型糖鎖修飾※2が血糖に応じたインスリン分泌機能保持に重要であり、その異常が2型糖尿病※3発症の仕組みの一部であることを明らかにしました。さらに、この多分岐型糖鎖修飾の機能を補うと、高脂肪食の摂取が引き起こす2型糖尿病を予防できることを実証しました。これは、理研基幹研究所(玉尾皓平所長)ケミカルバイオロジー研究領域システム糖鎖生物学研究グループ疾患糖鎖研究チームの大坪和明副チームリーダーと、米国カリフォルニア大学サンタバーバラ校のJamey Marth(ジェミー・マース)博士らとの共同研究による成果です。
肥満や糖尿病などの生活習慣病は、先進国において大きな社会問題となっています。これまでに、2型糖尿病の発症過程については、膵臓β細胞の血糖認識機構に障害が生じ、血糖レベルに応じたインスリン分泌機能が不全になることが知られていましたが、その詳細な仕組みについては不明のままでした。
研究グループは、高脂肪食を摂取させることで糖尿病にしたマウスを用いて解析を行ったところ、膵臓β細胞の機能を調節する転写因子FOXA2※4及びHNF-1α※5が核外に排出されると、細胞表面に発現している血糖認識分子であるグルコーストランスポーターと、その多分岐型糖鎖修飾を担う糖転移酵素GnT-IVa※6の発現が低下し、β細胞の血糖認識機構が損なわれてインスリン分泌機能が不全になることを発見しました。また、この異常は高脂肪食を摂取した糖尿病マウスだけでなく、ヒト2型糖尿病患者の膵臓β細胞でも共通して起きることを確認しました。さらに、マウス膵臓β細胞で糖転移酵素GnT-IVaを強制的に発現させて多分岐型糖鎖修飾機能を補うと、2型糖尿病を予防できることも実証しました。この発見は、ヒト2型糖尿病の発症の仕組みの理解や糖尿病治療につながるものと期待されます。
本研究成果は、科学雑誌『Nature Medicine』オンライン版(8月14日付け:日本時間8月15日)に掲載されます。
背景
膵臓(すいぞう)β細胞から分泌されるインスリンは糖代謝に重要な役割を果たしています。膵臓β細胞は、血糖レベルを認識するために細胞表面にグルコーストランスポーターを発現させ、そこを通過して細胞内に流入したグルコースがインスリンの分泌を引き起こすシグナルを発生させる仕組みになっています。2型糖尿病の発症過程では、β細胞表面でのグルコーストランスポーターの発現が低下するとともに、血糖認識機構が不全となることが知られています。
研究グループはこれまでに、グルコーストランスポーターに対して多分岐型糖鎖修飾を行う糖転移酵素GnT-IVaが欠損すると、グルコーストランスポーターは膵臓β細胞表面で安定的に発現することができず、その結果、血糖認識機構を損ない、糖尿病を引き起こすという研究結果を得ていました(図1)。また、食生活の過度な変化が引き起こす肥満・糖尿病の発症モデルとして、高脂肪食を摂取させたマウスの病態解析を行ったところ、このマウスの膵臓β細胞ではGnT-IVaの発現が著しく低下しており、糖尿病発症過程に深く関与していることを見いだしていました。しかし、その詳細な発症の仕組みやヒト2型糖尿病の病態形成への関与については不明のままでした。
研究手法と成果
研究グループは、マウスとヒトの膵臓β細胞におけるGnT-IVaの遺伝子プロモーターの解析から、その発現が膵臓β細胞の機能維持に不可欠な転写因子FOXA2及びHNF-1αによって制御されていることを明らかにしました。さらに、遊離脂肪酸※7を処理した正常なマウスとヒトのβ細胞や高脂肪食を摂取した糖尿病マウスの膵臓β細胞では、これら転写因子が核外に排出されることを発見しました(図2)。つまり、高脂肪食の摂取により上昇する遊離脂肪酸が引き金となってFOXA2とHNF-1αが核外に排出され、GnT-IVaの発現を低下させていることが分かりました(図3)。これらの知見と符合して、実際の2型糖尿病患者のβ細胞においてGnT-IVaの発現が低下していることも確認できました。
次に、膵臓β細胞でGnT-IVaを強制的に過剰発現させたトランスジェニック(Tg)マウスを作成し、高脂肪食摂取後の膵臓β細胞の性状・機能変化および個体内での糖代謝機能を解析しました。その結果、GnT-IVa Tgマウスは高脂肪食を摂取しても膵臓β細胞表面でのグルコーストランスポーターの発現が保持され、長期間に渡ってβ細胞の血糖認識機構が正常に機能し、血糖レベルに応じてインスリンを分泌、血糖値をコントロールできるという結果を得ました(図4)。
今後の期待
今回、研究グループは糖転移酵素GnT-IVaによるグルコーストランスポーターの多分岐型糖鎖修飾が膵臓β細胞の機能維持に重要な役割を果たし、その機能不全がヒト2型糖尿病発症に深く関与することを明らかにしました。さらに、GnT-IVaの発現をβ細胞で補うことにより、高脂肪食負荷によるβ細胞機能障害を防げることを発見しました。この成果は、膵臓β細胞で発現する糖転移酵素を調節して糖鎖修飾の制御を狙う新しい糖尿病治療薬の開発につながると期待されます。
発表者
理化学研究所
基幹研究所 ケミカルバイオロジー研究領域
システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
副チームリーダー 大坪 和明(おおつぼ かずあき)
Tel: 06-6879-8413 / Fax: 06-6879-8413
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.膵臓β細胞
膵臓の内分泌機能を担うランゲルハンス島に存在するインスリン分泌細胞のこと。細胞表面にはグルコーストランスポーターを発現し、血糖レベルに応じてグルコースを取り込み、それがシグナルとなってインスリン分泌応答が起きる。 - 2.多分岐型糖鎖修飾
細胞内で合成されるタンパク質の多くは、ゴルジ体に存在する糖転移酵素によって糖鎖(単糖分子が鎖状に結合したもの)修飾を受ける。分岐構造を持つ糖鎖はさまざまな分子との結合を可能とし、タンパク質の機能制御を行う。 - 3.2型糖尿病
膵臓β細胞からのインスリン分泌低下および末梢組織でのインスリン感受性の低下に起因する糖尿病であり、わが国の糖尿病全体のおよそ9割を占める。患者数は年々増加の一途をたどり、現在700万人に達し、境界型糖尿病患者を含めると2000万人に及ぶ。 - 4.FOXA2
肝臓、膵臓などの内胚葉由来の臓器の発生に重要な転写因子。肝臓及び膵臓において多くの遺伝子発現を調節し、グルコース代謝・恒常性の維持を行っている。 - 5.HNF-1α
肝臓及び膵臓ランゲルハンス島細胞に発現する転写因子であり、多くの遺伝子発現調節を行う。HNF-1αに欠失や異常が生じるとMODY3 (maturity-onset diabetes young type-3)という若年性糖尿病を発症する。 - 6.GnT-IVa
タンパク質を構成するアスパラギン残基上に形成される糖鎖の分岐鎖合成を決定する糖転移酵素の1つで、 Mgat4a遺伝子にコードされる。 - 7.遊離脂肪酸
脂肪が分解されて生じる脂肪酸。血液中にアルブミンと結合して存在する。飢餓状態や糖尿病のときに、血液中の濃度が極端に上昇する。
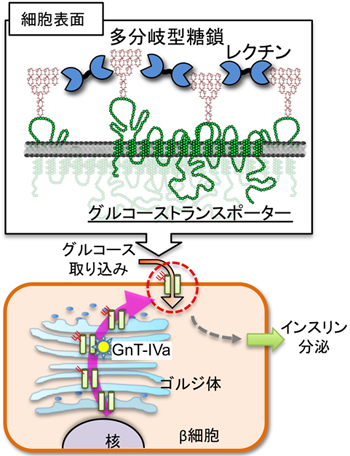
図1 GnT-IVaによるグルコーストランスポーターの糖鎖修飾とインスリン分泌
グルコーストランスポーターは合成後、ゴルジ体を通過する間にGnT-IVaの働きにより多分岐型糖鎖修飾を受け、細胞表面においてはその糖鎖を用いて(糖鎖を認識して結合するタンパク質である)レクチンと結合し、安定的に細胞表面で発現することができる。これによりβ細胞は効率よくグルコースを取り込み、インスリンを分泌することができる。
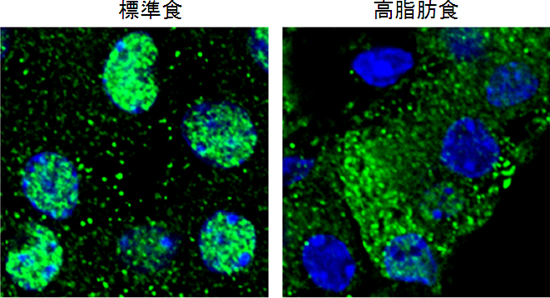
図2 膵臓β細胞内の転写因子FOXA2の局在
(緑:FOXA2、青:核)
標準食を摂取するマウスの膵臓β細胞では、FOXA2は核内に局在するが、高脂肪食を摂取するマウスの膵臓β細胞では、FOXA2が核外に排出される。
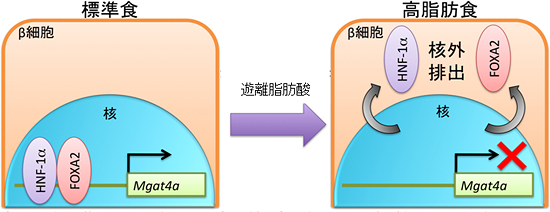
図3 高脂肪食摂取によるGnT-IVa発現低下の仕組み
高脂肪食の摂取などによる膵臓β細胞の遊離脂肪酸暴露が転写因子FOXA2やHNF-1αを核外に排出し、その結果、糖転移酵素GnT-IVaをコードするMgat4a遺伝子の発現が障害される。
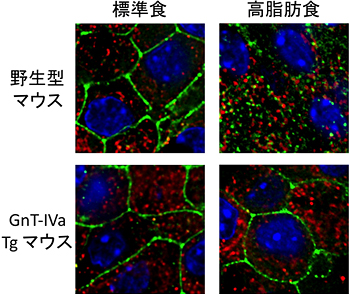
図4 GnT-IVa強制発現によるグルコーストランスポーターの発現維持
(赤:インスリン、緑:グルコーストランスポーター、青:核)
標準食を摂取するマウスにおいて、グルコーストランスポーターは膵臓β細胞の表面に発現しているが、高脂肪食を摂取した野生型マウスにおいて、グルコーストランスポーターは膵臓β細胞内に移行し、表面の発現レベルが低下する。一方、GnT-IVa Tgマウスは高脂肪食を摂取しても細胞表面でのグルコーストランスポーターの発現が維持される。
