2011年12月2日
独立行政法人 理化学研究所
国立大学法人北海道大学
自己免疫疾患を引き起こすT細胞の過剰な分化を抑制するメカニズムを解明
-核内タンパク質「PDLIM2」が、Th17細胞の過剰な分化を抑える働きをもつ-
ポイント
- 核内タンパク質「PDLIM2」が転写因子「STAT3」をユビキチン化で分解
- 転写因子「STAT3」が分解されることで、Th17細胞の過剰な分化を抑制
- 炎症性疾患・自己免疫疾患の有効な治療法への応用に期待
要旨
独立行政法人理化学研究所(理事長 野依良治)と国立大学法人北海道大学(総長 佐伯浩)は、「PDLIM2(ピィーディーリムツー)」と呼ぶ核内タンパク質が、自己免疫疾患を引き起こすT細胞の過剰な分化の抑制に重要な役割を担っていることを明らかにしました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)炎症制御研究ユニットの田中貴志ユニットリーダー、生体防御研究チームの改正恒康チームリーダー(大阪大学免疫学フロンティア研究センター免疫機能統御学教授兼務)、北海道大学大学院薬学研究院衛生化学研究室の松田正教授による研究グループの成果です。
ウイルスや細菌などの病原体が体内に侵入すると、樹状細胞※1が最初にこれらを認識し、その情報をT細胞※2に伝えます。T細胞は、侵入した病原体の種類に応じてTh1、Th2、Th17などの異なる機能を持つ特殊なT細胞にそれぞれ分化することで、効率よく病原体の排除を行います。しかし2005年に、Th17細胞の過剰な分化が炎症性疾患や自己免疫疾患を引き起こす原因であることが明らかになりました。Th17細胞の分化にはSTAT※33という核内の転写因子※4の活性化が重要であることが知られていますが、このTh17細胞の分化を抑制する分子メカニズムについては、不明のままでした。
研究グループは、核内タンパク質のPDLIM2が、このSTAT3にユビキチン※5という目印となる小さなタンパク質を付加してSTAT3を分解に導くことで、Th17細胞の分化を抑制することを発見しました。実際、PDLIM2を欠損させたマウスのT細胞ではSTAT3の分解が妨げられ、正常マウスのT細胞と比べてTh17細胞の分化が2~3倍亢進しました。さらに、PDLIM2を欠損させたマウスに意図的に炎症性肉芽腫を発症させると、正常マウスと比べてより重症化することも分かりました。
今回解明したPDLIM2によるTh17細胞の分化を抑制する分子メカニズムは、炎症性疾患や自己免疫疾患の治療を目的とした、人為的な免疫制御法の開発に役立つことが期待できます。
本研究成果は、米国の科学雑誌『Science Signaling』オンライン版(12月6日付け:日本時間12月7日)に掲載されます。
背景
ウイルスや細菌が体内に侵入すると、私たちの体では免疫システムが働きこれらの病原体を攻撃し排除します。しかし、この反応が過剰になると自分の正常な組織まで攻撃してしまう、自己免疫疾患を引き起こすことがあります。例えば、本来、結核菌などの細胞内細菌※6に対する重要な生体防御機構である肉芽腫という免疫システムは、クローン病やサルコイドーシスなどの自己免疫疾患の場合、肉芽腫の反応が過剰になって全身のさまざまな臓器の障害を引き起こします。
免疫システムの司令塔であるヘルパーT細胞は、細胞内情報伝達物質であるサイトカイン※7の分泌パターンの違いでTh1細胞とTh2細胞の2種類に分類され、感染した病原体の種類に応じて、いずれか一方に優位に分化することで効率よく病原体の排除を行うとされてきました。このバランスが崩れてTh1細胞の分化が過剰になると、自己免疫疾患が発症すると考えられてきましたが、2005年に新しいタイプの「Th17細胞」が同定され、このTh17細胞が過剰に分化することが自己免疫疾患の原因である可能性が示されました。
これまでの研究は、どのようにしてTh17細胞が活性化されるのかということを中心に進められ、TGFβ、IL-6という2種類のサイトカインや転写因子STAT3がTh17細胞の分化・活性化に重要な役割を果たすことが明らかになりました。しかし、Th17細胞への分化を抑制する分子メカニズムについては、不明のままでした。
2005年に理研の田中らは、核内ユビキチンリガーゼ「PDLIM2(PDZ and LIM domain protein 2)」を発見し、PDLIM2が、Th1細胞の分化に必須の転写因子であるSTAT4に、ユビキチンという小さなタンパク質を付加して分解に導くことにより、Th1細胞の分化を抑制することを報告しました。しかし、PDLIM2のTh17細胞に対する働きについては不明でした。
研究手法と成果
研究グループは、まずTh17細胞の分化・活性化におけるPDLIM2の役割を検討しました。プロピオニバクテリウム・アクネス(Propionibacterium acnes:P.acnes)という細胞内細菌を野生型マウスに投与すると、肝臓に肉芽腫を形成しますが、この過程にはP.acnesによって活性化されたTh1細胞が必要であることが知られていました。研究グループは、Th17細胞の分化に必須のサイトカインであるIL-6を欠損させたマウスにP.acnesを投与して肝臓の肉芽腫の形成を調べました。IL-6欠損マウスでは、Th1細胞は正常に活性化しているにもかかわらず、Th17細胞の分化が低下して、肉芽腫の形成が正常マウスと比べて著しく減弱していました。このことから、Th1細胞だけでなくTh17細胞も肉芽腫の形成に重要な役割を果たしていることを見いだしました。一方、PDLIM2を欠損させたマウスにP.acnesを投与したところ、Th1細胞の活性化が進み、正常マウスと比べて肉芽種の形成が明らかに進んでいることを確認しました(図1)。また、この肉芽種を形成したPDLIM2欠損マウスでは、Th1細胞だけでなくTh17細胞も、正常マウスと比較して2~3倍過剰に活性化していることも確認しました。
次に、PDLIM2を欠損させたマウスからヘルパーT細胞だけを取り出して、TGFβとIL-6の存在下でTh17細胞への分化を誘導すると、正常マウス由来のT細胞と比較して、Th17細胞の分化が2~3倍進んでいること(図2)、さらに、正常マウスのT細胞と比較してSTAT3が多く発現していることが、観察できました。以上の結果から、STAT4だけでなくPDLIM2は、STAT3もユビキチン化して分解することで、結果的にTh17細胞の分化を抑制することが明らかになりました(図3)。つまりPDLIM2は、Th17細胞が過剰に分化して、炎症性疾患や自己免疫疾患を引き起こさないようにバランスを保つ働きをしていると考えられます。
今後の期待
今回解明したPDLIM2によるTh17細胞の抑制機構は、炎症性疾患や自己免疫疾患の新たな治療法開発のターゲットとなることが期待できます。
2007年に研究グループは、PDLIM2が樹状細胞において炎症反応の発動に必須の転写因NF-κBを不活性化することで、炎症反応を終息させるように働くことも報告しています。(2007年4月30日プレスリリース(理研))これらのことは、PDLIM2が多段階で免疫反応を抑制できることを示しています。従って、PDLIM2の活性を人為的に制御することができると、炎症性疾患や自己免疫疾患の免疫制御法や強力な治療薬の開発に役立つことが期待できます。
原論文情報
- Takashi Tanaka,Yu Yamamoto,Ryuta Muromoto,Osamu Ikeda,Yuichi Sekine,Michael J. Grusby,Tsuneyasu Kaisho,Tadashi Matsuda.“PDLIM2 Inhibits T Helper 17 Cell Development and Granulomatous Inflammation Through Degradation of STAT3.” Science Signaling.2011,
発表者
理化学研究所
免疫・アレルギー科学総合研究センター炎症制御研究ユニット
ユニットリーダー 田中 貴志(たなか たかし)
Tel: 045-503-9283 / Fax: 045-503-7064
国立大学法人北海道大学
大学院薬学研究院 衛生化学研究室
教授 松田 正(まつだ ただし)
Tel: 011-706-3243 / Fax: 011-706-4990
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel:048-467-9272 / Fax:048-462-4715
国立大学法人北海道大学 総務企画部広報課
Tel: 011-706-2610 / Fax: 011-706-4870
補足説明
- 1.樹状細胞
樹状突起をもつ白血球で、微生物を認識して取り込み、Tリンパ球に異物の情報を伝える細胞(抗原提示細胞)として働く。 - 2.T細胞
免疫制御の中心的役割を果たすリンパ球。胸腺(Thymus)で形成されるためT細胞と呼ぶ。各細胞(クローン)が異なる抗原特異的な受容体(T細胞抗原受容体:TCR)を発現し、抗原を認識する。機能により、種々のサイトカインを産生したり、B細胞からの抗体産生の調節をしたりするもの(ヘルパーT細胞)や、標的細胞の傷害を担うもの(キラーT細胞)などがある。 - 3.STAT
サイトカイン、増殖因子、ホルモンなどのシグナルを細胞膜上の受容体から核まで伝達する細胞内情報伝達分子であるが、核に入った後は、転写因子としてDNAに結合して遺伝子の発現を制御する。「STAT:Signal Transducers and Activators of Transcription」とあるように、1つの分子がこれら2つの機能を兼ね備えていることから、このような名前がついている。7種類のSTATが報告されており、それぞれ異なった刺激により活性化される。本研究で対象としたSTAT3は、IL-6ファミリーのサイトカインや、EGFなどの増殖因子の刺激で活性化される。 - 4.転写因子
特定のDNA配列に結合して遺伝子の発現を制御するタンパク質。 - 5.ユビキチン
ユビキチンは76個のアミノ酸からなる小さなタンパク質で、標的となるタンパク質に多数のユビキチン分子が鎖状に結合すると、標的タンパク質はプロテアソームというタンパク分解酵素により分解される。ユビキチンリガーゼは、標的タンパク質に選択的に結合し、これにユビキチン分子を連結するという役割を担っており、ユビキチンを付加する反応の特異性を生み出している。 - 6.細胞内細菌
樹状細胞やマクロファージなどの食細胞に感染し、細胞内で生存できる細菌の総称。細胞内細菌が樹状細胞に感染すると、IL-12やIL-6などの炎症性サイトカインの産生が誘導され、さらにこれらのサイトカインはヘルパーT細胞に働いてTh1およびTh17細胞の分化を促進する。 - 7.サイトカイン
細胞同士の情報伝達に関わるさまざまな生理活性をもつタンパク質の総称。生体防御に関与する多種類の細胞に働き、免疫反応を発動する。
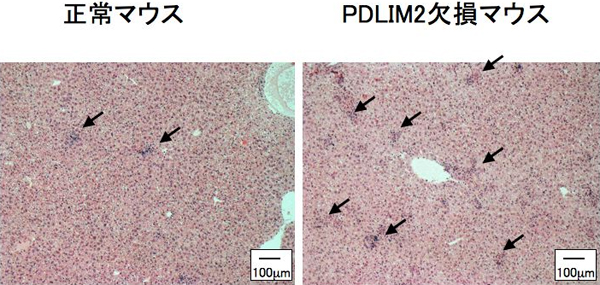
図1 PDLIM2欠損マウスにおける肝臓の肉芽腫形成の促進
正常マウスおよびPDLIM2欠損マウスに、P.acnesを投与して7日目の肝臓の組織像。矢印で示しているのが肉芽腫。PDLIM2欠損マウスの方が、明らかに肉芽腫の形成が促進している。
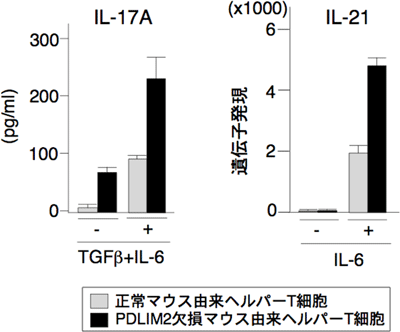
図2 PDLIM2欠損マウス由来T細胞におけるTh17細胞分化
正常マウスおよびPDLIM2欠損マウス由来のヘルパーT細胞を、TGFβ+IL-6またはIL-6だけ存在下(グラフの+)と非存在下(グラフの-)で、それぞれTh17細胞への分化を誘導した。Th17細胞から作られるサイトカインであるIL-17およびIL-21を測定することで、分化の程度を評価した。PDLIM2欠損マウス由来T細胞の方が、Th17細胞の分化が進んでいる。
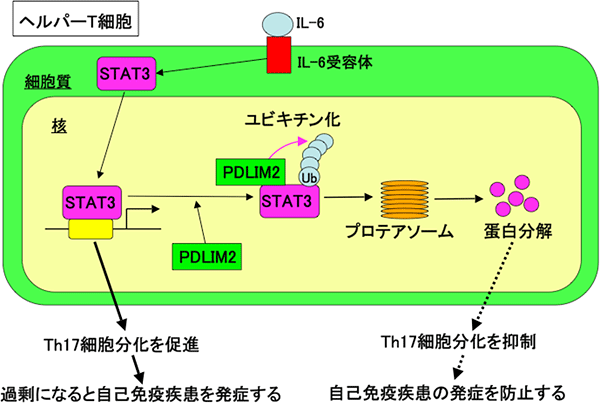
図3 STAT3で誘導されるTh17細胞の分化を、PDlIM2が抑制するメカニズム
PDLIM2は、活性化されて核内に移行してきた転写因子STAT3をユビキチン化し、プロテアソームによる分解を促進することで、STAT3を不活性化する。その結果、Th17細胞の分化を抑制し、自己免疫疾患の症状を防止する。
