2012年2月14日
独立行政法人 理化学研究所
国立大学法人 九州大学
免疫系細胞が刺激に応答し動く仕組みを原子レベルで解明
-DOCK2とELMO1が結合して抑制を解き、互いの機能を発揮-
ポイント
- 免疫応答を制御するDOCK2タンパク質複合体の立体構造を決定
- 免疫応答のシグナル伝達の分子メカニズムを解明
- 臓器移植の際の移植片拒絶や自己免疫疾患に対応する創薬へ期待
要旨
独立行政法人理化学研究所(野依良治理事長)と国立大学法人九州大学(有川節夫総長)は、免疫系細胞に特異的に発現して免疫応答を制御する鍵となる「DOCK2(dedicator of cytokinesis 2)タンパク質」と、その結合タンパク質である「ELMO1(engulfment and cell motility 1)タンパク質」の複合体の立体構造を初めて決定し、2つのタンパク質が結合することでそれぞれの機能を自己抑制している状態から、互いの機能を発揮できる状態へと移行させていることを明らかにしました。これは、理研生命分子システム基盤研究領域の横山茂之領域長、白水美香子上級研究員、新野睦子上級研究員、塙(末次)京子研究員と、九州大学生体防御医学研究所の福井宣規教授、錦見昭彦助教、神田大輔教授らによる共同研究の成果です。
免疫システムは、感染や病変から身を守るために必須の防御機構ですが、正常な細胞や組織に対してまで過剰に反応すると、自己免疫疾患や移植片拒絶などを引き起こします。これは、現代医学が解決すべき大きな課題です。2001年に福井教授らは、DOCK2が免疫系細胞に特異的に発現し、これらの免疫応答を制御する鍵となるタンパク質であることを世界に先駆けて明らかにしました。DOCK2は、実際の細胞内でELMO1と結合し複合体として働きますが、ELMO1がDOCK2の機能にどのように寄与しているかなど、その詳細な分子メカニズムについてはこれまで全く不明でした。
共同研究グループは、X線結晶構造解析※1によりDOCK2とELMO1の複合体の立体構造を決定し、この2つのタンパク質が密接に結合することで互いの自己抑制を解除しあい、それぞれの本来の機能を発揮できる状態へ移行させていることを明らかにしました。
この成果は、自己免疫疾患や移植片拒絶など難治性免疫疾患に対応した新しいアプローチによる治療薬、予防薬の開発につながることが期待されます。
本研究は、文部科学省の「ターゲットタンパク研究プログラム」の一環として行ったもので、研究成果は、2月13日の週に米国科学アカデミー紀要『The Proceedings of the National Academy of Sciences USA (PNAS)』オンライン版に掲載される予定です。
背景
免疫システムは、感染による病原体やがん細胞などから身体を守るうえで必須の防御機構です。他方、身体を守るはずの免疫システムが私たち自身を攻撃する自己免疫疾患や臓器移植の際に免疫システムによって引き起こされる移植片拒絶の問題は、現代医学が直面している課題です。
2001年に福井教授らは、DOCK2が免疫系細胞に特異的に発現し、免疫応答を制御する鍵となるタンパク質であることを世界に先駆けて明らかにしました。DOCK2は、Racタンパク質※2を活性化させ、アクチン※3の重合を誘導し、免疫系細胞の運動や活性化を制御します。自己免疫疾患や移植片拒絶は、免疫系細胞が標的臓器に浸潤し、活性化されることで引き起こされる病態です。そのため、DOCK2はこれら免疫難病をコントロールするための分子標的となる可能性があります。実際、2005年の福井教授らの研究では、DOCK2欠損マウスに心臓移植すると、免疫抑制剤を使用しなくても心臓が長期にわたり働き続けることが明らかになっています。
DOCK2は、DOCKファミリータンパク質に特有のDHR2ドメイン(DOCK homology region 2 domain)を持ちます。そして、このドメインは、Racタンパク質に結合しているGDP(グアノシン二リン酸)をGTP(グアノシン三リン酸)に変換することで、Racを活性化します。この反応は免疫応答のシグナルを伝達するために必要不可欠であることが明らかにされています。DOCK2は試験管内ではDHR2ドメインだけでRacを活性化させる機能を発揮しますが、実際の細胞内ではDOCK2結合タンパク質であるELMO1がないとその機能を発揮できないことが分かっています。しかし、なぜELMO1がないとDOCK2が細胞の中で働くことができないかは謎のままでした。
そこで研究グループは、自己免疫疾患や移植片拒絶などの難治性免疫疾患に対し、DOCK2を標的としたこれまでにない新しいアプローチの治療薬、予防薬などの創生の道を切り開くため、DOCK2とELMO1の複合体の構造解析に取り組みました。
研究手法と成果
原子レベルの構造を詳細に調べる手法であるX線結晶構造解析には、純度が非常に高く安定なタンパク質を大量に必要とします。理研生命分子システム基盤研究領域は、大きなタンパク質であるDOCK2(1830個のアミノ酸で構成)とELMO1(727個のアミノ酸で構成)が相互作用する領域を探索しました。このため独自に開発した無細胞タンパク質合成系※4を用いて迅速なスクリーニングを行い、DOCK2のN末端※5とELMO1のC末端※5とが結合することで安定な複合体を形成することを見いだしました。また、その領域を用いてX線結晶構造解析に適した試料を調製、結晶化し、放射光科学研究施設PF(Photon Factory)※6および大型放射光施設SPring-8※6でX線回折を行った結果、複合体の立体構造を2.1Å(オングストローム、1Å=0.1nm)の分解能で決定することに成功しました(図1)。
ELMO1のC末端にはアミノ酸の1つであるプロリンが連なった領域(PxxP)があり(図2)、DOCK2のN末端にはこのプロリンと結合することができるSH3(SRC homology 3)ドメインがあるため、これまでこの領域が2つのタンパク質を結合させていると考えられていました。しかし、実際の構造はそのような単純なものではなく、ELMO1のC末端はDOCK2のSH3ドメインを取り囲むように結合していました(図1A)。さらに、DOCK2とELMO1のアルファへリックス※7同士が結合し合い、計5本のアルファへリックスから作られるヘリックスバンドル※8を形成し、全体としてDOCK2とELMO1の複合体は強固な構造体になっていました。(図1B)。
構造情報に基づきDOCK2の機能解析を行った結果、単体のDOCK2は、折り畳まれた形で存在し機能を自己抑制していることが分かりました。単体のELMO1も同様に、折り畳まれた形で存在し自己抑制していることが知られています。DOCK2の折り畳まれた形の形成には、32番目のグリシンが重要であることが推測されていましたが、DOCK2とELMO1の複合体では、32番目のグリシンがELMO1と直接結合していることが分かりました。またELMO1の折り畳まれた形の形成には、692番目のメチオニンと693番目のグルタミン酸が重要であることが知られていましたが、複合体ではこれらはヘリックスバンドルの中央に存在し、それぞれのアミノ酸がDOCK2と結合していることが分かりました(図1B)。つまり、DOCK2とELMO1が結合し複合体を形成すると、それぞれの折り畳まれた形の形成を担っていた部位が複合体結合部位となり、折り畳みを解くことが分かりました。この結果からDOCK2とELMO1は、単体ではそれぞれ折り畳まれた状態で機能を自己抑制していましたが、複合体を形成することで折り畳み状態を解いて互いの自己抑制を解除し、それぞれ、DOCK2とELMO1複合体の細胞膜への移行を促進し、さらにDOCK2のRac活性化によりシグナルが伝達され、免疫系細胞の遊走や活性化が起きるという分子メカニズムの一連が明らかとなりました(図2)。
今後の期待
今回決定したDOCK2とELMO1の複合体の立体構造より、免疫応答のシグナル伝達における分子メカニズムの解明が進みました。この発見と立体構造情報により、他のDOCKファミリータンパク質によるさまざまなシグナル伝達のメカニズム解明が期待できます。さらに、難治性免疫疾患に対する治療薬、予防薬創生のためのドラッグデザインが可能となり、新しい治療薬の開発につながることが期待できます。
原論文情報
- Kyoko Hanawa-Suetsugu, Mutsuko Kukimoto-Niino, Chiemi Mishima-Tsumagari, Ryogo Akasaka, Noboru Ohsawa, Shun-ichi Sekine, Takuhiro Ito, Naoya Tochio, Seizo Koshiba, Takanori Kigawa, Takaho Terada, Mikako Shirouzu, Akihiko Nishikimi, Takehito Uruno, Tomoya Katakai, Tatsuo Kinashi, Daisuke Kohda, Yoshinori Fukui and Shigeyuki Yokoyama:“Structural basis for mutual relief of the Rac guanine nucleotide exchange factor DOCK2 and its partner ELMO1 from their autoinhibited forms”. The Proceedings of the National Academy of Sciences USA (PNAS). 2012. doi/10.1073/pnas.1113512109
発表者
理化学研究所
生命分子システム基盤研究領域
領域長 横山 茂之(よこやま しげゆき)
Tel: 045-503-9196 / Fax: 045-503-9195
国立大学法人九州大学 生体防御医学研究所
個体機能制御学部門 免疫遺伝学分野
教授 福井 宣規(ふくい よしのり)
Tel: 092-642-6828 / Fax: 092-642-6829
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel:048-467-9272 / Fax:048-462-4715
国立大学法人九州大学 広報室
Tel: 092-642-2106 / Fax: 092-642-2113
補足説明
- 1.X線結晶構造解析
物質の結晶を作り、それにX線を照射して回折データを解析することにより、物質の内部構造を調べる方法。タンパク質の構造を原子レベルの分解能で詳細に解明するための最も有力な方法の1つ。 - 2.Racタンパク質
グアニンヌクレオチド結合タンパク質で、細胞の運動などに関わる細胞内のシグナル伝達を調節するタンパク質。グアノシン二リン酸(GDP)を結合しているときが不活性型で、グアノシン三リン酸(GTP)が結合すると活性型となり、下流にシグナルを伝えるスイッチとして細胞内のシグナル伝達を調節している。 - 3.アクチン
真核細胞に最も多量に含まれるタンパク質で、細胞骨格を作るタンパク質の1つ。アクチン同士が重合、または脱重合することにより、細胞の形態や運動が制御される。 - 4.無細胞タンパク質合成系
生命体に依存しない人工的なシステム。細胞からタンパク質合成に必要な成分一式を抽出し、これに目的のタンパク質をコードする遺伝子を合成装置が読み取れる形にして添加して任意のタンパク質を合成する技術。外部からさまざまな因子を加えることや、大規模な発現領域のスクリーニング、反応条件の変更、最適化などが容易にでき、生命体で作製が困難な毒性のあるタンパク質の合成も可能であるなど、優れた特徴を持つ。 - 5.N末端、C末端
タンパク質はアミノ酸同士が脱水縮合して形成されたポリマーであり、隣接するアミノ酸は、それぞれのアミノ基とカルボキシル基がペプチド結合をしている。このポリマーの末端のフリーのアミノ基側をN末端、カルボキシル基側をC末端と呼ぶ。 - 6.放射光科学研究施設PF(Photon Factory)、大型放射光施設SPring-8
PFは茨城県つくば市にある放射光科学研究施設。日本初のX線を利用できる放射光専用光源として1982年に完成した。大学や研究機関が共同で利用実験するための施設(大学共同利用機関)として高エネルギー加速器研究機構(KEK)によって運用される。
SPring-8は兵庫県の播磨科学公園都市にある世界最高の放射光を生み出す理化学研究所の施設。その名前はSuper Photon ring 8 GeVに由来する。 - 7.アルファへリックス
タンパク質の二次構造の共通モチーフの1つで、バネのような右巻きらせんの形をしている。アルファへリックスを作る全てのアミノ基は4残基離れたカルボキシル基と水素結合を形成している。 - 8.ヘリックスバンドル
複数本のアルファへリックスが束なって作られるタンパク質の三次構造。
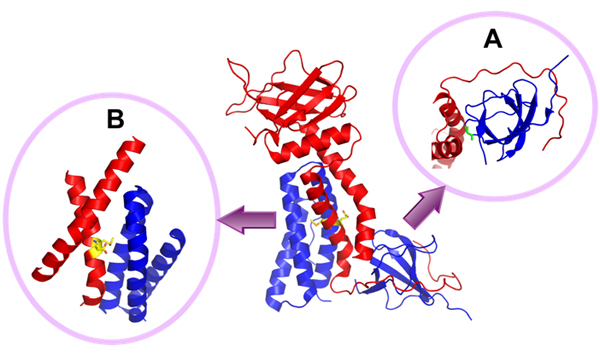
図1 DOCK2(青)のN末端とELMO1(赤)のC末端の複合体の結晶構造。
- A: 中央の複合体構造のSH3ドメインを下から見た図で、SH3ドメインをぐるりと取り囲むようにELMO1のC末端領域が結合している。DOCK2の32番目のグリシン(緑色)がELMO1に取り囲まれるように結合している。
- B: DOCK2の3本のアルファヘリックス(青)とELMO1の2本のアルファへリックス(赤)が合わさり、合計5本のヘリックスからなる強固なヘリックスバンドルを作っている部分を示した。中央図の反対側から見た図で、ヘリックスバンドル中央にELMO1の692番目のメチオニンと693番目のグルタミン酸(黄色)があり、DOCK2と結合している。
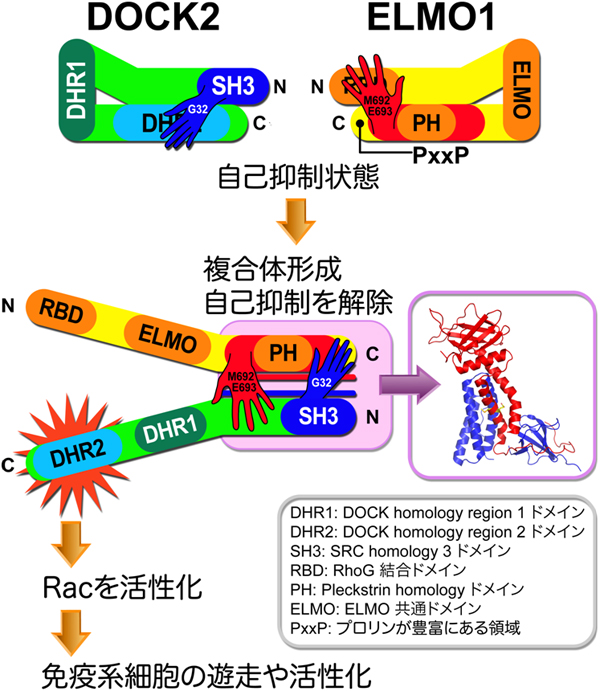
図2 DOCK2とELMO1によるシグナル伝達の模式図
DOCK2とELMO1はそれぞれ単体で存在しているときは、折り畳まれた構造をとり、自己抑制の状態をとる。自己抑制状態の構造では、DOCK2では32番目のグリシン(G32)、ELMO1では692番目のメチオニン(M692)と693番目のグルタミン酸(E693)がそれぞれ分子内結合に関わっている。DOCK2がELMO1と複合体を形成すると、それぞれの分子内結合に関わっている部位が複合体結合部位になるため、DOCK2とELMO1は同時に折り畳まれた構造が解かれる(自己抑制の解除)。ELMO1との結合により自己抑制が解除されたDOCK2は、Racに結合しているGDPをGTPに交換する機能を持つDHR2ドメインが露呈し、Racが活性化される。Racの活性化によりシグナルは伝達され、免疫系細胞の遊走や活性化が可能となる。タンパク質の模式図の中に書かれている文字は、現在分かっているドメイン名を示す。
