2012年6月18日
独立行政法人 理化学研究所
腸管内の抗原取り組み口「M細胞」の分化に必須な転写因子を発見
-いまだに謎が多い腸管免疫系のメカニズム解明に貢献-
ポイント
- 腸管粘膜に分布するM細胞には転写因子Spi-Bが特異的に発現
- Spi-B欠損マウスではM細胞が完全に消失し免疫応答が低下
- Spi-B欠損マウスはM細胞を標的とした経口ワクチン開発の有効なツールに
要旨
理化学研究所(野依良治理事長)は、腸管粘膜に分布し、腸管内の抗原を取り込んで免疫応答を発動するM細胞※1の分化に、Spi-B※2という転写因子※3が必須であることを見いだしました。これは理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫系構築研究チームの大野博司チームリーダー(横浜市立大学客員教授を兼務)、金谷高史研究員(横浜市立大学客員研究員を兼務)と、大阪大学免疫学フロンティア研究センターの改正恒康教授、米国エモリー大学医学部のイフォー・ウイリアムズ(Ifor R. Williams)准教授を中心とする共同研究グループ※4の成果です。
腸管内には、私たちの身体を構成する全細胞よりはるかに多い、100兆個にも及ぶ細菌が腸内細菌としてすみ着いています。その上、食べ物や病原性微生物なども侵入します。それらの微生物から身体を守るために、免疫細胞が集まったパイエル板※5などの腸管免疫組織が発達しています。腸管免疫組織は、どのような微生物が腸管の中にいるかを常に監視し、必要に応じて適切な免疫応答を発動して、病原体の排除や腸内細菌のバランスを維持しています。腸管粘膜は腸管上皮細胞から構成されており、その中で腸管免疫組織を覆う部分には、腸管内の微生物を取り込み、腸管免疫組織に受け渡して免疫応答を発動するM細胞が分布しています。しかし、腸管免疫系の全容はいまだ謎が多く、特に、抗原の取り込み口であるM細胞の分化メカニズムはほとんど分かっていませんでした。
研究グループは、M細胞の分化を誘導するRANKL※6という分泌タンパク質に着目し、3~4日間、野生型マウスに連続投与してM細胞の遺伝子発現を網羅的に調べました。その結果、M細胞はSpi-Bという転写因子を特異的に発現することが分かりました。マウスのSpi-B遺伝子を欠損させるとM細胞が完全に消失し、ネズミチフス菌など病原性微生物に対する免疫応答が低下することも突き止めました。
今後、M細胞を含めた腸管免疫系のメカニズムを解明し、弱毒化した病原体を経口投与してM細胞に抗原を取り込ませることができると、アレルギー症状の軽減などに効果的な、注射を必要としない「経口ワクチン」の開発が期待できます。
本研究成果は、科学雑誌『Nature Immunology』オンライン版(6月17日付け:日本時間6月18日)に掲載されます。
背景
体内と外界の境界は皮膚と粘膜で分けられています。体表面を形成する皮膚は、重層する表皮細胞と角質層で比較的堅牢な防壁となっています。一方、体の内側にある粘膜の多くは単層の細胞だけで覆われています。特に腸管粘膜は、栄養や水分の吸収効率を高めるため、約400m2にも及ぶ広い表面積を持ち、食物や食物とともに侵入する外来微生物、さらには100兆個もの腸内細菌といった異物(抗原)に常にさらされています。従って腸管粘膜は、多くの感染症における病原性微生物の初期侵入経路でもあり、感染から個体を守る最前線と考えられます。腸管には体内の全免疫細胞の60~70%が存在し、体内最大の免疫組織である腸管免疫組織を構築しています。パイエル板に代表される腸管免疫組織は、腸管内腔から腸管粘膜を介して直接抗原の供給を受け、免疫応答を発動させます。腸管粘膜は腸管上皮細胞という細胞で構成されており、その中で腸管免疫組織を覆う部分には、腸管内の抗原を盛んに取り込むM細胞(図1)が分布しています。取りこまれた抗原は直下にある樹状細胞などの免疫細胞に受け渡され、免疫応答が発動されます。しかし、M細胞自身の分化のメカニズムに関しては、ほとんど明らかになっていませんでした。
研究手法と成果
研究グループは、M細胞の分化を誘導する因子として知られるRANKLという分泌タンパク質を用いて、M細胞が分化する過程を追跡しました。野生型マウスにRANKLを3~4日間連続で投与すると、腸管粘膜のうち、本来M細胞が存在しない部分にM細胞が出現してきます。RANKL投与後のマウスの腸管粘膜を採取し、遺伝子を網羅的に解析した結果、M細胞の出現に伴いSpi-B遺伝子が発現してくることが分かりました。そこで、パイエル板を覆う腸管粘膜に着目してSpi-B遺伝子の発現を調べたところ、M細胞だけに発現していることを突き止めました。また、ヒトの内視鏡で得られたサンプルを用いて解析すると、ヒトM細胞でもSpi-B遺伝子の発現を確認しました。
次に、Spi-B遺伝子を欠損したマウス(Spi-B欠損マウス)でM細胞の形成を観察したところ、M細胞の存在を示す目印(マーカー分子)は観察できず(図2)、M細胞と判断できる細胞が完全に消失していました。さらに、Spi-B欠損マウスにネズミチフス菌およびエルシニア属菌を経口感染させたところ、パイエル板への取り込みが10~20%に減少していました(図3)。
このパイエル板への抗原取り込みの減少が、実際に免疫応答の障害につながるかどうかを評価しました。まず、野生型マウスとSpi-B欠損マウスに、ネズミチフス菌を認識して活性化するTリンパ球を移入しました。次に、ネズミチフス菌を経口感染させてパイエル板でのTリンパ球の活性化を観察しました。その結果、野生型マウスではTリンパ球の活性化を確認しましたが、Spi-B欠損マウスでは活性化が4分の1程度に低下していました(図4)。
今後の期待
今回、Spi-B欠損マウスではM細胞が完全に消失することが判明しました。Spi-B欠損マウスをM細胞欠損モデル動物として活用できるようになるため、腸管免疫系におけるM細胞の機能解明に貢献することが期待できます。現在、M細胞を標的とした経口ワクチンの開発が進められていますが、その有効性を評価する強力なツールにもなります。また、M細胞はネズミチフス菌などの病原体の感染口であることが報告されているため、Spi-B欠損マウスは、これらの病原体の感染機構を解明するうえでも有用です。
原論文情報
- Kanaya T, Hase K, Takahashi D, Fukuda S, Hoshino K, Sasaki I, Hemmi H, Knoop KA, Kumar N, Sato M, Katsuno T, Yokosuka O, Toyooka K, Nakai K, Sakamoto A, Kitahara Y, Jinnohara T, McSorley SJ, Kaisho T, Williams IR, Ohno H.” The Ets Transcription Factor Spi-B Is Essential for the Differentiation of Intestinal Microfold (M) Cells.”, Nature Immunology,2012
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫系構築研究チーム
チームリーダー 大野 博司(おおの ひろし)
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.M細胞
腸管粘膜を構成する腸管上皮細胞の1つ。パイエル板をはじめとする腸管免疫組織を覆う部分に分布する。腸管内の抗原を取り込み、腸管免疫組織の免疫細胞に抗原を受け渡す役割を担う。これにより、抗原に対する免疫応答を発動する。取りこんだ抗原をできるだけ早く免疫細胞に渡すため、ポケットのような形をしている。 - 2.Spi-B
転写因子の1つ。1996年、免疫細胞の一種であるB細胞に発現して、分化や機能を調節することが発見された。今回、腸管粘膜を構成する上皮細胞の中ではM細胞だけで発現することを発見し、その分化に必須であることが見いだされた。 - 3.転写因子
特定のDNA配列に結合して遺伝子の発現を制御するタンパク質。 - 4.共同研究グループ
理研免疫・アレルギー科学総合研究センター免疫系構築研究チーム/横浜市立大学大学院生体ナノシステム科学研究科免疫生物学研究室(大野博司、金谷高史、長谷耕二、高橋大輔、福田真嗣、中井久美子、坂元亜矢子、北原祐樹、陣野原俊)、大阪大学免疫学フロンティア研究センター(改正恒康、星野克明、佐々木泉、邊見弘明)、米国エモリー大学(Ifor R. Williams、Katharyn A. Knoop、Nachiket Kumar)、理研植物科学研究センター(豊岡公徳、佐藤繭子)、千葉大学大学院医学研究院(横須賀收、勝野達郎)、米国カリフォルニア大学デイビス校(Stephen J. McSorley)との共同研究による。 - 5.パイエル板
小腸に分布する免疫組織。リンパ球などの免疫細胞が集合しており、腸管内の抗原に対して腸管免疫応答を引き起こす。パイエル板の腸管粘膜面は絨毛とは異なる上皮層で覆われており、ここにM細胞が分布する。 - 6.RANKL
Receptor activator of NFκB ligandの略で腫瘍壊死因子ファミリーサイトカインの一種。破骨細胞の分化因子として同定された。近年、パイエル板の間質細胞(組織を構築する骨組みとなる細胞の総称)に発現することが見いだされ、さらにM細胞の分化を誘導していることが発見された。
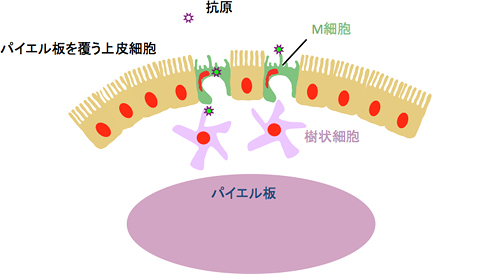
図1 腸管免疫組織を覆う腸管粘膜(腸管上皮細胞)に分布するM細胞
M細胞は、パイエル板をはじめとする腸管免疫組織を覆う腸管粘膜(腸管上皮細胞)に分布しており、腸管内に侵入してきた病原体などの抗原を取り込んで樹状細胞などの免疫細胞に受け渡す。
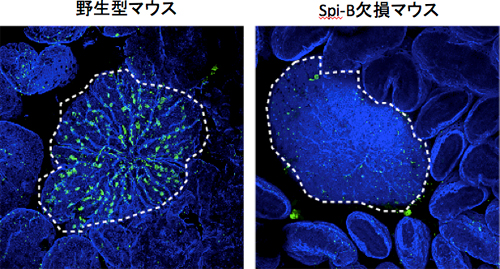
図2 Spi-B欠損マウスにおけるM細胞の消失
マウスのパイエル板(白点線内)を覆う上皮層の染色画像。Spi-B欠損マウスでは、M細胞(緑色)が完全に消失していた。
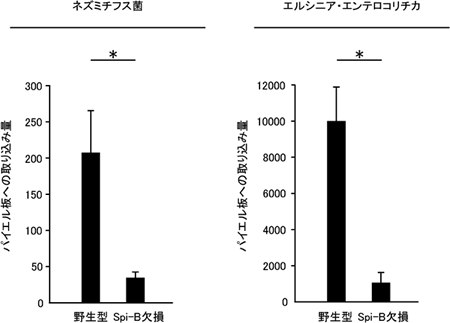
図3 Spi-B欠損マウスにおける抗原取り込みの減少
野生型マウスとSpi-B欠損マウスに、抗原としてネズミチフス菌とエルシニア・エンテロコリチカ菌を経口感染させ、パイエル板への取り込み量を測定した。Spi-B欠損マウスでは野生型マウスと比較して取り込み量が10~20%に減少していた。
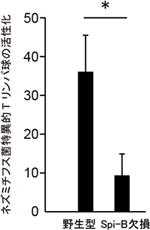
図4 Spi-B欠損マウスにおける腸管免疫応答の阻害
Spi-B欠損マウスと野生型マウスへ、ネズミチフス菌に特異的に活性化するTリンパ球を移入し、ネズミチフス菌を経口感染させた。野生型マウスと比較して、Spi-B欠損マウスではパイエル板でのTリンパ球の活性化が、約4分の1に減少した。
