ポイント
- 細胞成長を抑制する転写調節因子GTL1の関連遺伝子を全ゲノム解析によって同定
- GTL1が染色体の倍加に関わる遺伝子の発現を抑え、細胞成長を止める
- 農作物やバイオマス作物の増産に新たな道を開く
要旨
理化学研究所(野依良治理事長)は、植物の細胞成長を抑制する転写調節因子GTL1(GT2-LIKE 1)※1の機能を解明し、植物細胞の大きさが決まる仕組みを明らかにしました。これは、理研植物科学研究センター(篠崎一雄センター長)細胞機能研究チームの杉本慶子チームリーダー、クリスチャン・ブラウア特別研究員、河村彩子テクニカルスタッフと、米国オハイオ州立大学、奈良先端科学技術大学院大学との共同研究グループによる成果です。
植物の花や葉、実などの器官は多数の細胞から構成されており、その細胞が分裂して数を増やしたり、またその後の伸長成長(細胞成長)によって体積を増大させたりして大きくなります。一つ一つの細胞はある一定の大きさに達すると成長を止めますが、最終的な細胞の大きさがどのように決まるかはまだ分かっていません。理研細胞機能研究チームは、2009年に「GTL1」と呼ばれる転写調節因子が植物細胞の細胞成長を抑制することを見いだしていましたが、GTL1が具体的にどう機能するかは謎のままでした。
共同研究グループは、まずシロイヌナズナを用いて全ゲノムレベルでの解析を行い、GTL1によって直接的に転写制御を受ける182個の関連遺伝子を発見しました。植物の細胞成長には、染色体の倍加現象※2による細胞内のDNA量の増加が深く関わっています。共同研究グループは、これらの関連遺伝子のなかから染色体の倍加を促進する遺伝子「CCS52A1」※3を見つけ、GTL1がこの遺伝子の発現を抑えることによって細胞成長を止めることを突き止めました。さらにGTL1遺伝子の発現量を人為的に増減させることで、細胞の成長を抑制したり促進したりして、細胞の大きさを自在に変えることにも成功しました。
植物の細胞成長を積極的に止める仕組みがあることが証明されたのは、世界でも今回が初めてです。今回の発見で植物の細胞成長が一方的に促進されるだけではなく、適度に抑制されることで組織や器官がかたち作られていることが示されました。今後、GTL1やその関連因子の機能をさらに解明することで、植物の成長が正と負の制御バランスによって厳密に調節される詳細な仕組みが明らかになると考えられます。またGTL1の発現を特定部位で減少させることにより、農作物やバイオマス作物の増産が可能になると期待できます。
本研究成果は、文部科学省 新学術領域研究“大地環境変動に対する植物の生存・成長突破力の分子的統合解析”の計画研究の一環として助成を受けて行われ、欧州分子生物学機構の科学雑誌『The EMBO Journal』に掲載されるに先立ち、オンライン版(11月9日付け:日本時間11月10日)に掲載されます。
背景
動物や植物をはじめとする多細胞生物の器官は多くの細胞から成り立っています。こうした器官の成長は、その構成細胞が分裂して数が増えたり、分裂を終了した細胞がさらに伸長成長(細胞成長)し、体積を増大させたりすることで起きています。このような細胞成長は特に植物で頻繁に起き、私たちが日ごろ目にする葉や花、実などの成長の重要な原動力となっています。一つ一つの細胞はある程度の大きさに達すると成長を止めるため、例えばシロイヌナズナの葉の毛細胞であるトライコームのように、元の数百倍にまで体積が大きくなる細胞でも、最終的な細胞の大きさはほぼ一定です(図1)。これまでに細胞の成長を促進する仕組みについては理解が深まってきましたが、最終的な細胞の大きさがどのような仕組みで決まるかについてはほとんど分かっていませんでした。
成長過程のなかで、多くの細胞が分裂を終えて細胞成長を始めるのと同時に、染色体の倍加が開始します。染色体の倍加が開始された細胞では細胞の分裂を経ずに染色体の複製が繰り返されるため、細胞内のDNA量が倍加していきます。20世紀初頭からの研究によって、多くの細胞種で染色体の倍加に依存した細胞成長が起きることが発見されてきましたが、実際にどのような仕組みでこうした成長が起きるのかはまだ分かっていません。また染色体倍加に依存しない細胞成長の例も数多く報告され、染色体の倍加依存的、非依存的な成長がそれぞれどのような仕組みになっているのか、またどの程度全体の細胞成長に寄与するのかについてはいまだに議論が続いています。
理研細胞機能研究チームは、シロイヌナズナを用いて2009年に植物細胞の成長を抑制する遺伝子としてGTL1を発見し、GTL1の発現量を減少させるとトライコーム細胞の染色体が異常に倍加し、細胞が巨大化することを見いだしていました。(2009年9月1日プレスリリース)GTL1は、転写調節因子として働くため、ある特定の関連遺伝子群の発現を調節することで細胞成長を抑制することが予測されていましたが、その詳細は謎でした。
今回、共同研究グループはシロイヌナズナを用いて全ゲノムレベルでのクロマチン免疫沈降解析※4及び遺伝子発現解析を行い、GTL1が関連する遺伝子の網羅的な同定に挑みました。また同定された関連遺伝子の機能解析を通して、細胞成長を積極的に抑制する仕組みの解明を目指しました。
研究手法と成果
GTL1が関連因子の遺伝子発現を調節するには、その遺伝子のプロモーターと呼ばれる発現調節配列に直接結合することが予測されます。そこで共同研究グループは、シロイヌナズナのゲノム上でGTL1が結合するDNA配列を決定することにしました。まずGTL1の機能が欠失したgtl1変異体のなかで、GTL1に緑色蛍光タンパク質(GFP)を結合させたGTL1-GFPタンパク質を発現させます。そして、この結合タンパク質がGTL1の欠失を補って、GTL1が正常に機能することを確認しました。次にGFPに対する抗体を用いたクロマチン免疫沈降によってGTL1-GFPタンパク質を発現している植物体からGTL1と結合するDNA断片を精製し、タイリングアレイ※5と呼ばれる手法を用いてその配列を決定しました。この結果、GTL1がプロモーターに強い結合性を示す3,900個の遺伝子を同定しました。
さらに、GTL1によって実際の発現が変化する遺伝子も見つけ出す必要があります。そこで野生型とgtl1変異体のトライコーム細胞での遺伝子発現をマイクロアレイ法※6で解析し、GTL1に依存して転写量が変化する1,694個の遺伝子を同定しました。そしてこれらの2つの解析に共通して見出される遺伝子を探索し、GTL1が直接プロモーターに結合し、発現を制御する182個の遺伝子を発見しました(図2)。
次にGTL1が染色体の倍加に依存的な細胞成長を制御する可能性を探るため、発見した遺伝子群のなかにこの過程に関わる遺伝子が含まれているかどうか調べました。すると唯一、染色体の倍加を促進することが知られているCCS52A1遺伝子が見つかりました。そこで、野生型のトライコーム細胞でこれらの遺伝子の発現時期を調べてみると、CCS52A1は細胞成長の開始時期から終了時期までずっと発現しているのに対し、GTL1は細胞成長の終了時期に発現し始め、その発現のタイミングに合わせてCCS52A1の発現が低下することが分かりました。しかし、GTL1の機能が欠失したgtl1変異体のトライコーム細胞では、細胞成長の終了時期でもCCS52A1の発現が継続していました(図3)。さらに、GTL1とCCS52A1の機能を欠失させたgtl1 ccs52a1二重変異体を作成して、gtl1変異体に見られるCCS52A1の異常な蓄積を解消しました。すると、gtl1変異体で見られていた異常な染色体の倍加が起きなくなり、トライコーム細胞の成長も著しく抑制されました。これらの結果から、植物細胞の細胞成長はGTL1の発現によって積極的に止められること、またその主要なメカニズムとしてGTL1がCCS52A1の発現を抑制することによって染色体の倍加に依存的な細胞成長が止まることが明らかになりました(図4)。
もしGTL1の役目がCCS52A1の発現を抑制するだけならば、gtl1 ccs52a1二重変異体のトライコーム細胞は、野生型の半分くらいの大きさのccs52a1変異体のトライコーム細胞と同じ大きさになるはずです。ところが予想に反して、この二重変異体のトライコーム細胞はccs52a1変異体よりも2割程度大きくなっていました。この結果は、GTL1がCCS52A1以外の別の関連遺伝子の発現も抑制していて、gtl1 ccs52a1二重変異体ではこの遺伝子の発現に影響がないため成長が進んでしまうことを示しています。一方で、gtl1 ccs52a1二重変異体の染色体倍加レベルはccs52a1変異体と全く同じなので、この2割の細胞成長は、染色体倍加に依存しないで起きていることになります。つまり、GTL1はCCS52A1以外の関連遺伝子の発現も調節することで染色体倍加に依存しない細胞成長も同時に抑制することが分かりました。
こうした成果は、GTL1が細胞成長を止めるために必要であることを明確に示していますが、GTL1単独で細胞成長を止めるのに十分であるかどうかは分かりません。そこで共同研究グループは、細胞成長が始まったばかりの初期のトライコーム細胞でGTL1を発現させたところ、GTL1の発現と同時に細胞成長が完全に停止することが分かりました。またトライコーム細胞以外の葉の細胞でGTL1の発現を誘導すると、同様に細胞成長が著しく抑制され、葉自体も極度に矮小化しました(図5)。これらの結果から、GTL1単独で細胞成長を厳密に抑制していること、またこうした成長抑制の仕組みが植物のさまざまな細胞でも働くことが明らかになりました。
今後の期待
本研究から、GTL1が染色体の倍加に依存的な細胞成長と非依存的な細胞成長を統合的に制御することが明らかになりました。これまでCCS52A1や動物種に保存されているCCS52A1と同等な遺伝子CDH1/FZRが染色体の倍加を促進することは知られていましたが、その発現を積極的に止めないと倍加の進行やそれに伴った細胞成長が終了しないことが分かったのは動植物を通じて今回が初めてです。今回は細胞成長のモデル系として葉のトライコーム細胞を用いましたが、葉以外の細胞でも同様の成長抑制機構が働く可能性は十分考えられます。今後、GTL1やCCS52A1の関連因子の機能をさらに解明することで、植物の成長が正と負の制御バランスによって厳密に調節される仕組みが見えてくることが期待できます。地球上のバイオマス総量の半分近くが染色体の倍加によって生産されると推定されています。GTL1の発現を特定部位で減少させることにより、農作物やバイオマス作物の増産が可能になると期待できます。
原論文情報
- Christian Breuer, Kengo Morohashi, Ayako Kawamura, Naoki Takahashi, Takashi Ishida, Masaaki Umeda, Erich Grotewold, Keiko Sugimoto,. "Transcriptional repression of the APC/C activator CCS52A1 contributes to the active termination of cell growth".
The EMBO Journal, 2012, DOI: 10.1038/emboj.2012.294
発表者
理化学研究所
植物科学研究センター 細胞機能研究チーム
チームリーダー 杉本 慶子(すぎもと けいこ)
特別研究員 小牧 伸一郎(こまき しんいちろう)
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.GTL1(GT2-LIKE 1)
GT-2と呼ばれるトライへリックス型転写因子と高い相同性をもつ植物に特有な転写調節因子。2009年に理研細胞機能研究チームは、この遺伝子が欠失すると細胞成長が抑制されなくなり、細胞が巨大化することを報告したが、その仕組みは未解明だった。 - 2.染色体の倍加現象
核内倍加現象ともいう。真核生物に広く見られるが、特に高等植物に頻繁に起きる。通常の細胞分裂を行う細胞では染色体複製後に細胞が必ず分裂するのに対し、染色体が倍加する細胞では細胞の分裂を経ずに染色体が複製を繰り返す。シロイヌナズナの葉や根では多くの細胞が数回の染色体倍加を行う。染色体の倍加による細胞内のDNA量の増加が細胞成長の原動力となることも知られているが、その詳しい仕組みはまだよく分かっていない。 - 3.CCS52A1
後期促進複合体(anaphase promoting complex/cyclosome, APC/C)と呼ばれるE3ユビキチンリガーゼを活性化する因子の1つ。APC/Cは、さまざまな細胞周期制御因子にユビキチンと呼ばれる小型のタンパク質を付加し、これらのタンパク質の分解を誘導する。CCS52A1は細胞が分裂を終えて成長し始める時期に発現し、染色体の倍加を促進することが知られている。 - 4.クロマチン免疫沈降解析
転写調節因子などの特定のタンパク質に対する抗体を用いて、そのタンパク質と結合するDNA断片を精製し、その配列を明らかにする方法。 - 5.タイリングアレイ
解読済みのゲノムデータから等間隔に抜き出したDNA配列をプローブとしてタイル状に並べたガラス板(DNAチップ)を用い、それらに相同性のあるDNAを網羅的に検出、定量化することによって、ゲノム上全ての遺伝子発現や転写調節因子結合部位などを解析する方法。 - 6.マイクロアレイ
タイリングアレイと同様に、特定のDNA配列をガラス板に並べたDNAチップを用いて、一度に大量の遺伝子発現を解析する方法。マイクロアレイの場合は既知の遺伝子部分だけのDNA配列を対象とする。シロイヌナズナには約26,000個の遺伝子が存在するが、本研究ではそのうち約24,000の遺伝子に対応するプローブを搭載したDNAチップ(affymetrix社製)を用いて、野生型と gtl1変異体の遺伝子発現の違いを解析した。

図1 シロイヌナズナの葉の表面にあるトライコームと呼ばれる毛細胞
ひとつの細胞から出来ており、元の大きさの数百倍にまで成長するが、最終的な細胞の大きさはほぼ一定になっている。
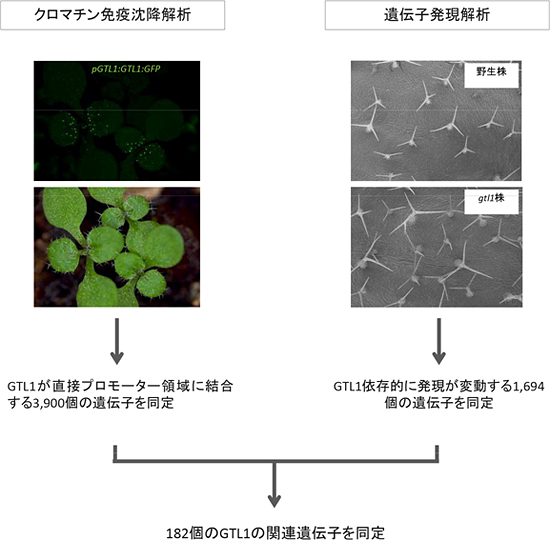
図2 GTL1の関連遺伝子を探索するための全ゲノム解析実験手法
クロマチン免疫沈降解析では、GTL1-GFPタンパク質を発現する植物体(写真左)を用いてGTL1が結合するゲノム配列を決定した。遺伝子発現解析では、野生株とgtl1変異株の巨大化したトライコーム細胞(写真右)での遺伝子発現を比較し、GTL1に依存的に発現が変動する遺伝子を決定した。これらの解析結果を照合することにより、GTL1が直接的に発現調節配列であるプロモーターに結合し、発現を制御する182個の遺伝子を発見した。
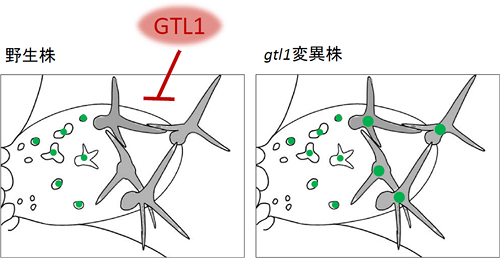
図3 GTL1は細胞成長の終了時期に発現し、CCS52A1の発現を抑制する。
若いシロイヌナズナの葉のトライコーム細胞を示す。左側には細胞成長を開始したばかりの小さなトライコーム細胞(白色の細胞)、右側には細胞成長終了間近の大きな細胞(灰色の細胞)が見える。
- 野生株:CCS52A1(緑の丸印)は細胞成長の開始時期から発現しているが、成長の終了間近になるとGTL1によってその発現を抑制される。
- gtl1変異体:GTL1の機能を欠失させたgtl1変異体ではCCS52A1の発現が抑制されないため、細胞が成長し続け、最終的に巨大化してしまう。
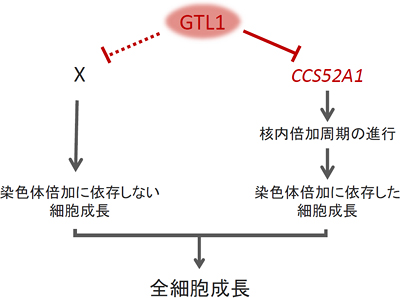
図4 GTL1が細胞成長を抑制する仕組み
GTL1はCCS52A1遺伝子の発現を抑えることによって染色体の倍加に依存した細胞成長を止める。一方でGTL1は染色体の倍加に非依存的な細胞成長も抑制するが、その際の直接的に関連する遺伝子はまだ分かっていない。

図5 GTL1を過剰に発現させると植物体は矮小化する。
GTL1を過剰に発現する植物体では細胞成長が抑制されるため、全体的に矮小化する。
