ポイント
- DAGのフリップフロップ(膜間移動)を細胞膜外層中のスフィンゴミエリンが制御
- 細胞膜外層にDAGのプールが存在、スフィンゴミエリンが細胞内への移動を抑制
- 細胞膜の外層と内層の非対称性を利用したシグナル伝達の存在を発見
要旨
理化学研究所(理研、野依良治理事長)は、細胞膜において産生される生理活性脂質[1]が細胞膜を横切るのは、細胞膜を構成する特定の脂質の量に依存することを発見しました。これは、理研小林脂質生物学研究室の上田善文客員研究員、牧野麻美特別研究員、酒井祥太客員研究員、稲葉岳彦基礎科学特別研究員、ウラン-松田フランソワーズ客員研究員、小林俊秀主任研究員らによる研究チームの成果です。
細胞を取り囲む細胞膜は、内層と外層からなる脂質二重層を基本構造としています。細胞外に向いている外層と細胞質に接している内層とでは、それぞれの層を構成している脂質が非対称に分布しているため物性が異なります。ジアシルグリセロール(DAG)[2]は、ホルモンや神経伝達物質などの細胞外刺激によって産生され、内層および外層に存在する生理活性脂質です。細胞の増殖や分化などを制御するため、がん化やアルツハイマー病との関連が指摘されており、DAGの細胞膜中の挙動が注目されていました。しかし、これまで生きた細胞での挙動はほとんど分かっておらず、主にモデル膜の実験結果に限られていました。
研究チームは、DAGに特異的に結合する蛍光タンパク質プローブ[3]を子宮由来の培養細胞と腎臓由来の培養細胞に適用し、DAGの細胞膜外層から内層への移動(フリップフロップ)を観測しました。その結果、スフィンゴミエリン[4]という脂質を豊富に含んだ腎臓由来の培養細胞ではフリップフロップが起きず、スフィンゴミエリンが少ない子宮由来の培養細胞ではフリップフロップが起きることを見いだしました。また、外層にDAGが定常的に存在することを発見し、スフィンゴミエリンを人為的に分解するとDAGが内層にフリップフロップを起こすことを明らかにしました。
今回の結果は、細胞膜の内層と外層の脂質の非対称分布がDAGによるシグナル伝達を制御するという、非対称分布の生理学的意味を明らかしたものです。DAGの異常な増加は、細胞のがん化やアルツハイマーを誘導するため、スフィンゴミエリンの適切な分布の破綻が細胞内のDAGの濃度を増大させ、これら疾患を誘導する可能性を示唆しています。今後、スフィンゴミエリンを中心とした代謝物質が創薬のターゲットになると期待できます。
本研究成果は、米国の科学雑誌「The FASEB Journal 」(8月号)に掲載されます。
背景
動物の細胞膜は内層と外層の脂質二重層で構成されており、それらの脂質組成は非対称です。内層にはホスファチジルエタノールアミン、ホスファチジルセリンなどのアミノ基を持ったイノシトールリン脂質などが分布しているのに対して、外層にはホスファチジルコリンやスフィンゴエミリン、糖脂質が豊富に存在します(図1)。このような非対称分布の結果、内層と外層では脂質の構造や物性が異なりますが、その生理的意味は分かっていませんでした。
ジアシルグリセロール(DAG)は、ホルモンや神経伝達物質刺激に応じて細胞膜に産生する生理活性脂質であり、細胞増殖や細胞分化などの細胞応答を制御しています。また、DAGは脂質合成の中間体であり、細胞刺激とは無関係に定常的にも産生されます。DAGを産生する酵素は多数存在し、ホスファチジルイノシトール-4,5-二リン酸(PIP2)とホスホリパーゼC(PLC)によって内層の細胞質側に産生される経路や、外層の表側に存在するスフィンゴミエリン合成酵素(SMS)とホスファチジルコリン、セラミドによって、細胞膜表面に産生される経路が知られています(図2)。
脂質が膜の外層から内層へ移動する方法として、フリップフロップ(膜間移動)という膜を横切る運動が知られています。フリップフロップ速度は脂質の極性基[5]の大きさに依存し、膜の主要な構成成分で極性が大きいリン脂質は非常に遅く、極性が小さいDAGは非常に速いと考えられていました(図3)。しかし、これらは主に蛍光標識したDAGによるモデル膜の実験結果に基づいており、生きた細胞でのDAGの分布や動態についてはほとんど分かっていませんでした。
研究手法と成果
DAGが生きた動物細胞膜でフリップフロップするかどうかを調べるために、DAGとだけ結合するタンパク質を蛍光標識したDAGプローブを作製し、ヒト卵巣由来のHeLa細胞やイヌ腎臓上皮由来のMDCK細胞の細胞質で発現させました。この場合、DAGがフリップフロップするとDAGプローブが細胞膜の内側に集まります。細胞表面にDAGを人為的に産生させたところ、HeLa細胞ではフリップフロップを確認しましたが、MDCK細胞ではフリップフロップが起こりませんでした(図4)。2つの細胞の脂質組成を調べた結果、MDCK細胞ではスフィンゴミエリンが外層に多量に存在しており、薬剤を投与してスフィンゴミエリンの量を減らすとフリップフロップが引き起こされることを見いだしました。また、モデル膜の実験では、フリップフロップの速度がスフィンゴミエリンの量に依存して低下したことから、スフィンゴミエリンの量がフリップフロップを制御することが明らかになりました。さらに、DAGプローブが細胞膜表面を明るく染色したことから、細胞表面には多量のDAGがプールのように存在することも明らかになりました(図5)。
今後の期待
DAGは特殊な脂質ではなく、食事中に含まれる脂質の吸収・分解の過程で常に産生されています。DAGが異常に増加するとリン酸化酵素を過剰に活性化してしまい、その結果、細胞のがん化やアルツハイマー病などを誘導します。従って通常は、代謝酵素などによって細胞内のDAGは低濃度に抑えられています。
研究チームは今回、細胞膜表面にDAGのプールが存在すること、スフィンゴミエリンという外層表面に存在する脂質がDAGのフリップフロップを阻害していることを突き止めました。これは、細胞膜の非対称性を利用したDAGによるシグナル伝達が存在することを示しており、細胞膜非対称性の生理的意味の1つを明らかにしたものです。また、細胞外物質に常に曝(さら)されている消化組織などでスフィンゴミエリンの量が減ると、DAGの透過率が上がってがんを誘導する可能性があります。今後、スフィンゴミエリンをターゲットにした抗がん剤の開発につながる可能性が期待できます。
原論文情報
- Ueda Y, Makino A, Murase-Tamada K, Sakai S, Inaba T, Hullin-Matsuda F, Kobayashi T. "Sphingomyelin regulates the transbilayer movement of diacylglycerol in the plasma membrane of Madin-Darby canine kidney cells." The FASEB Journal, 2013, doi:10.1096/fj.12-226548
発表者
理化学研究所
主任研究員研究室 小林脂質生物学研究室
主任研究員 小林 俊秀 (こばやし としひで)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.生理活性脂質
ホルモンや神経伝達物質によって脂質産生酵素が活性化されると、ジアシルグリセロール、セラミド、ホスファチジルイノシトール3,4,5-三リン酸などの生理活性脂質が膜上に産生される。その結果、細胞増殖、アポトーシスなど細胞機能を制御するためのさまざまなタンパク質が細胞膜に呼び寄せられて活性化する。 - 2.ジアシルグリセロール(DAG)
グリセリンに、脂肪酸が2つ結合した脂質分子。ホルモン刺激によって産生され、その下流のリン酸化タンパク質プロテインキナーゼCと結合して活性化する。DAGの産生酵素は、ホスホリパーゼC、スフィンゴミエリン合成酵素、ホスファチジン酸ホスファターゼなど多岐にわたる。また、DAGは脂質の合成、分解の中間体であり、中性脂肪の大部分を占めるトリアシルグリセロールや、脳に豊富に存在し神経伝達物質として働く2-アラキドノイルグリセロールの原料になる。 - 3.蛍光タンパク質プローブ
緑色蛍光タンパク質(Green fluorescent protein)は、興味のあるタンパク質に、遺伝子工学的手法を用いて連結することにより、タンパク質の細胞内の動態を観察するために用いられる。 - 4.スフィンゴミエリン
ゴルジ体と細胞膜表面に存在するスフィンゴミエリン合成酵素(Sphingomyelin synthase, SMS)により合成される。細胞膜内層には、ほとんど存在しないと考えられている。近年、さまざまなシグナル伝達を担うタンパク質が、細胞膜上の特定の領域(ラフト)に局在することが明らかになった。スフィンゴミエリンは、ラフトの主要成分であることから、シグナル伝達に重要であることが明らかになっている。さらに、アポトーシスなどを制御する脂質(セラミド)の原料になることからも、その重要性が示唆されている。 - 5.極性基
脂質分子のうち、脂質二重層より水層に突き出た部分。一方、脂質二重層の中の部位を非極性基と呼ぶ。極性基が大きいほど、自発的なフリップフロップは起きにくくなる。例えば、大きい極性基であるコリンを持つホスファチジルコリンはフリップフロップがほぼ起きないが、小さい極性基を持つジアシルグリセロールはフリップフロップを起こしやすい。
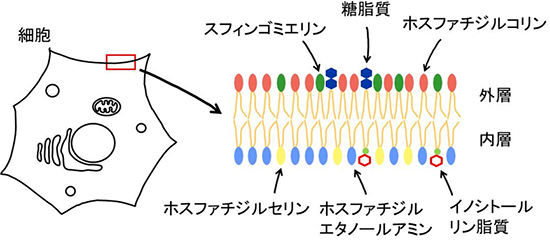
図1 脂質二重層の内層と外層の脂質組成
細胞の細胞膜を構成する脂質は、外層と内層で非対称である。外層では、スフィンゴミエリン、糖脂質、ホスファチジルコリンが豊富に存在するのに対し、内層では、ホスファチジルセリンやホスファチジルエタノールアミンなどのリン脂質が存在する。
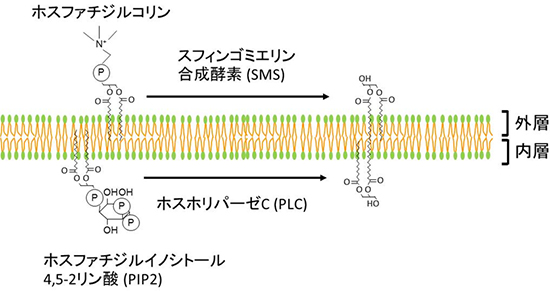
図2 DAG産生経路
DAGの産生経路は、外層と内層の両方に存在する。外層ではSMSによって産生され、内層では主にPLCによって産生される。
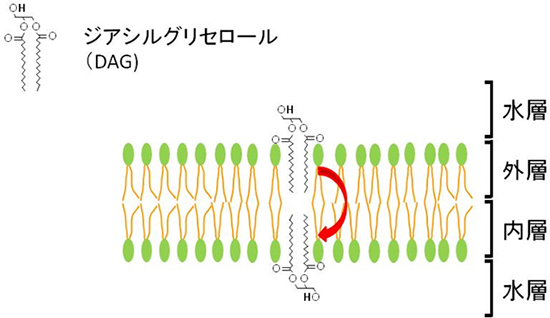
図3 フリップフロップ
フリップフロップは脂質の極性に大きな影響を受け、DAGのような極性基(水層に出ている部分)が小さいとフリップフロップの速度が速くなる。
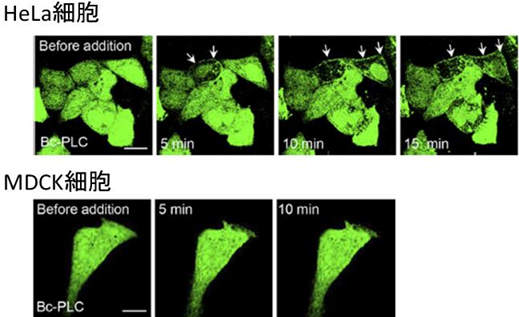
図4 Hela細胞とMDCK細胞のプリップフロップ
細胞膜外層にホスホリパーゼCを添加してDAGを産生させると、HeLa細胞ではフリップフロップを観察した(白矢印)。一方、スフィンゴミエリンが豊富に存在するMDCK細胞ではフリップフロップは起こらなかった。スケールバーは10μm。
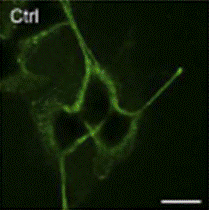
図5 細胞膜外層存在するDAGプール
DAGプローブを細胞膜外層から加えると明るく染色された。スケールバーは20μm。
