ポイント
- 高感度で再現性に優れ、かつ簡便な1細胞RNAシーケンス法を開発
- 分化段階や細胞周期の違いを遺伝子発現の違いとして再現性よく検出
- 同一培養条件かつ細胞周期も同じ細胞間で遺伝子発現のゆらぎを発見
要旨
理化学研究所(理研、野依良治理事長)は、細胞1個が発現する遺伝子を網羅的に定量化する方法「Quartz-Seq(クオーツセック)法」を開発し、同じ種類の細胞で、かつ同じ細胞周期[1]にある細胞同士でも、細胞ごとに遺伝子発現のパターンに差があることを明らかにしました。これは理研生命システム研究センター(柳田敏雄センター長)合成生物学研究グループの上田泰己(ひろき)グループディレクターらの研究成果です。
私たちの身体のほぼすべての細胞は同じ遺伝情報を持っていますが、発現している遺伝子の組み合わせや頻度(遺伝子発現パターン)は細胞ごとに異なります。発現している遺伝子の情報はDNAからmRNAに転写されます。また、それぞれの遺伝子の発現量はmRNAへの転写量(コピー数)として定量化できます。従って、遺伝子発現パターンを知るために、転写されたmRNAの種類と量を網羅的に定量化する方法が開発されてきました。しかし、細胞1個に含まれるmRNAの総量は極めて微量のため、従来の方法では、個々の細胞ごとの遺伝子発現パターンの違いを再現性よく検出することは困難でした。
今回、研究グループは細胞1個のmRNAを試験管内で増幅する方法を綿密に検討し、最も適切な条件を見いだすことで、細胞の遺伝子発現パターンを偏りなく忠実に増幅し、網羅的に定量化する「Quartz-Seq法」を開発しました。
Quartz-Seq法を用いた解析により、異なる細胞種間の遺伝子発現パターンの違いを検出することができただけでなく、同じ培養条件において細胞周期の異なる細胞間のより小さな遺伝子発現パターンの違いも検出することができました。さらに、同じ培養条件で細胞周期も同じ細胞同士でも、遺伝子発現パターンにゆらぎがあることを検出しました。
Quartz-Seq法は、従来の方法と比べ操作が簡単で汎用性の高い方法です。同種の細胞集団における細胞ごとのゆらぎが複雑な生命現象の引き金であると考えられています。今後この方法を用いて、がん細胞の悪性度のばらつきの原因解明や薬剤耐性が現れる仕組みの解明、さらに再生医療におけるiPS細胞とその分化細胞の品質管理などへの応用が期待できます。
本研究成果は、英国の科学雑誌『Genome Biology』(4月17日)に掲載されました。
背景
発現している遺伝子の組み合わせや頻度(遺伝子発現パターン)を調べるには、ある程度の量(一般的に10,000個以上の細胞)の試料が必要で、これまでは組織・臓器レベルの細胞集団を試料としてきました。そこで見られる遺伝子発現パターンは細胞集団についての平均値です。一方、一見同じに見える細胞集団の中に、周りの細胞と性質が異なる細胞が生じてくることがあります。例えば、臓器の中に塊となって発生する固形がんは性質が不均一ながん細胞の集団であり、そのがん細胞の一部が転移性や薬剤耐性を獲得していると考えられています。また、同じ培養条件でもES細胞(胚性幹細胞)やiPS細胞(人工多能性幹細胞)は遺伝子発現パターンにゆらぎがあり、このゆらぎと細胞が異なる細胞種へ分化する能力との関連が注目されています。細胞ごとに違う性質が遺伝子発現パターンの違いによるかどうかは再生医療の技術確立の観点にとって興味深い問題です。
生物の体は主にタンパク質で構成されています。遺伝子とは、主にタンパク質に変換される遺伝情報を持ったDNA配列のことです。そのDNA配列が転写と呼ばれる過程を経てmRNA(メッセンジャーRNA)に変換され、続いてmRNAの情報をもとにタンパク質が合成されます。この一連の過程のなかでmRNAは遺伝子発現の有無を確認できる産物として重要な存在です。しかし、細胞が含んでいるmRNAの総量はごく微量(10pg程度、pgピコグラム=1兆分の1グラム)であり、一つひとつの細胞について、その遺伝子発現を精度よく定量化することは困難でした。
現在用いられている遺伝子発現パターンを網羅的に定量化する方法として1細胞RNAシーケンス法があります。この手法は、細胞ごとの遺伝子発現の不均一性を計測するための有効な手段になり得ますが、現状では感度や再現性が十分ではなく、実験の簡便さにも欠けるという問題があり、細胞1個の遺伝子発現パターンを定量化するための高精度で操作しやすい方法の開発が望まれていました。
研究手法と成果
1細胞RNAシークエンス法では、遺伝子から転写されたmRNAに対応するcDNA(相補的DNA)の増幅が必要であり、理想的にはタンパク質に変換されるすべてのmRNAをcDNAに変換し偏りなく増幅することが求められます。そのために研究グループは主に以下の点について最適な条件を検討しました(図1)。
- 1.逆転写反応
cDNAは、逆転写反応と呼ばれるmRNAをDNAに変換する反応で合成できます。具体的には、遺伝子から転写されたRNA配列の特定の位置にプライマー[2]が結合し、そのプライマーを目印にDNA合成酵素が結合し、cDNAが作られます。研究グループは、プライマーをRNAに結合させるときの温度(アニーリング温度)を最適化することで、全体的に偏りなくcDNAを増幅させることに成功しました。
- 2.PCR反応
増幅能力が強いDNA合成酵素をcDNAの増幅反応に用いることで、発現頻度の低いmRNAも、発現頻度の多いmRNAと同様の効率で増幅させることに成功しました。
- 3.逆転写プライマー由来副産物の軽減
反応液中に残っているプライマー自体の増幅を防ぐため、逆転写反応後に、反応に使われなかった不要なプライマーを特定の酵素によってある程度分解し、除去します。さらに残ったプライマーの末端同士が結合しやすいような(自己アニーリング)配列を設計しました。自己アニーリングした残存物の増幅は起こらないので、効果的に副産物の生成を軽減することに成功しました。
以上の3つのポイントを最適化することで、高精度な1細胞RNAシーケンス法「Quartz-Seq(クオーツセック)法」を確立しました。Quartz-Seq法は従来法のSmart-Seq(スマートセック)法[3]が必要とするゲル精製などの作業プロセスがなく、すべての反応を1つのマイクロチューブの中で行えるので操作が簡便になりました(図2)。
Quartz-Seq法とSmart-Seq法を比較するため、1個のマウスES細胞由来のRNA(10pg)を用いて検証しました。その結果、再現性の相関係数はQuartz-Seq法で0.93、Smart-Seq法で0.7となり、Quartz-Seq法はSmart-Seq法と比べて高精度化を達成しました。また、2回の独立した実験で、約8,000の遺伝子を捉えることができ、再現性があることが確認できました。さらに、これは、1細胞ではなく大量の細胞に相当する1 μg(マイクログラム、1 μg=100万分の1グラム)のmRNAを用いた通常法で検出される遺伝子のうち、9割を捉えている計算になります。一方、Smart-Seq法では、同様の実験で通常法の4割ほどの遺伝子しか検出できませんでした。Quartz-SeqはSmart-Seq法と比べて再現性、検出感度の両面で傑出していました。
次に、Quartz-Seq法を用いて異なる条件における細胞間での遺伝子発現パターンの違いの検出を試みました。
- 1.細胞種の違い
マウスES細胞と、そこから分化した細胞であるPrE(原始内胚葉)細胞の遺伝子発現パターンを計測し解析しました。その結果、2つの細胞種間の遺伝子発現パターンを明瞭に区別することができました。
- 2.同じ培養環境にある細胞が持つ細胞周期の違い
同じマウスES細胞について細胞周期の異なる細胞間で遺伝子発現パターンを解析しました。その結果、細胞種の違いと比べると小さいながらも細胞周期による遺伝子発現パターンの違いを検出することができました。
- 3.同一の培養環境かつ同じ細胞周期の細胞間の違い
細胞周期がG1期にあるマウスES細胞同士で解析した結果、遺伝子発現パターンにゆらぎが検出されました。いくつかの遺伝子の発現を非増幅1細胞qPCR法[4]を用いて測定し、ゆらぎの度合いがQuartz-Seq法で得られた結果と相関していることを確認しました。すなわち、これまで定量化することが難しかった細胞間の遺伝子発現パターンのゆらぎを定量的に捉えることができました(図3)。
以上の結果から、3つの異なるレベルの細胞の違いを検出することに成功しました。
今後の期待
Quartz-Seq法は簡便で高精度なため、多くのユーザーが容易に導入可能であり、さまざまな分野での応用が期待できます。例えば、免疫反応は性質の異なる多数の細胞間の相互作用で引き起こされますが、Quartz-Seq法はこれらの細胞間の遺伝子発現パターンの違いを簡単に捉えることができるので、新しい分子マーカーの発見につながる可能性があります。また、正常な発生過程における細胞分化は同一の細胞間に生じる遺伝子発現の微妙なゆらぎが引き金になっているとも考えられています。Quartz-Seq法によって、細胞間の遺伝子発現のゆらぎを計測することで、発生・分化のメカニズムの解明や薬剤・環境応答メカニズムの解明に寄与することが考えられます。さらに、再生医療におけるiPS細胞とその分化細胞の不均一性・均一性の検証による品質管理、遺伝子発現の不均一性を起因とするがん細胞の悪性化や薬剤耐性化のメカニズム解明などの医療分野に貢献すると期待できます。
本研究は、文部科学省の革新的細胞解析研究プログラム(セルイノベーション)の助成によって行われました。
原論文情報
- Yohei Sasagawa, Itoshi Nikaido, Tetsutaro Hayashi, Hiroki Danno, Kenichiro D Uno, Takeshi Imai and Hiroki R Ueda "Quartz-Seq: a highly reproducible and sensitive single-cell RNA sequencing method, reveals non-genetic gene expression heterogeneity"
Genome Biology 2013, 14:R31 doi:10.1186/gb-2013-14-4-r31
発表者
理化学研究所
生命システム研究センター 細胞デザインコア 合成生物学研究グループ
グループディレクター 上田 泰己(うえだ ひろき)
情報基盤センター バイオインフォマティクス研究開発ユニット
上級センター研究員 笹川 洋平(ささがわ ようへい)
お問い合わせ先
生命システム研究センター 広報担当(川野)
Tel: 06-6155-0113 / Fax: 06-6155-0112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.細胞周期
細胞分裂で生じた娘細胞が、再び母細胞となって再び細胞分裂を行い、新しい娘細胞になるまでの過程。 - 2.プライマー
DNAを増幅するPCR法において用いられる化学合成した短い(20塩基程度)オリゴヌクレオチド(核酸)である。鋳型となるDNAに相補的に結合したプライマーに新たなヌクレオチドが付加されることで相補的なDNAが合成される。 - 3.Smart-Seq法
スウェーデンのグループが2012年に報告した1細胞RNAシーケンス法の一種。 - 4.非増幅1細胞qPCR法
PCR増幅産物の増加をリアルタイムで計測し、cDNAの定量を行う技術。
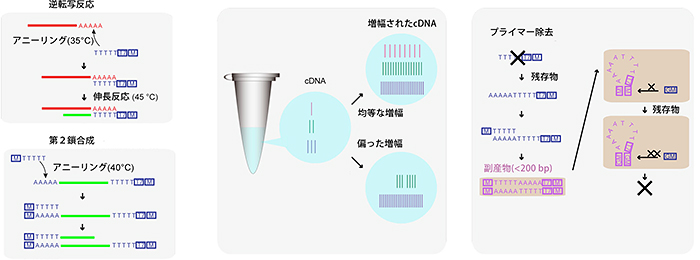
図1 mRNAの増幅条件の検討
- (左) 逆転写反応と第2鎖の合成において、プライマーを結合するアニーリング温度の最適値を求めることによって、取りこぼしなくcDNAの増幅が行われ、実験ごとのばらつきを抑えることに成功した。
- (中) これまで使われていたDNA合成酵素に比べて、3倍以上のcDNAの収量が得られるDNA合成酵素の選定に成功した。これにより微量しか存在しないcDNAの増幅も確実に行うことができた。
- (右) プライマー由来の副産物を低減させるために、余分なプライマーの末端同士が結合しやすくなるような(自己アニーリング)設計を行った。自己アニーリングした副産物はそれ以上増幅されることはないので、効果的に副産物の低減ができた。
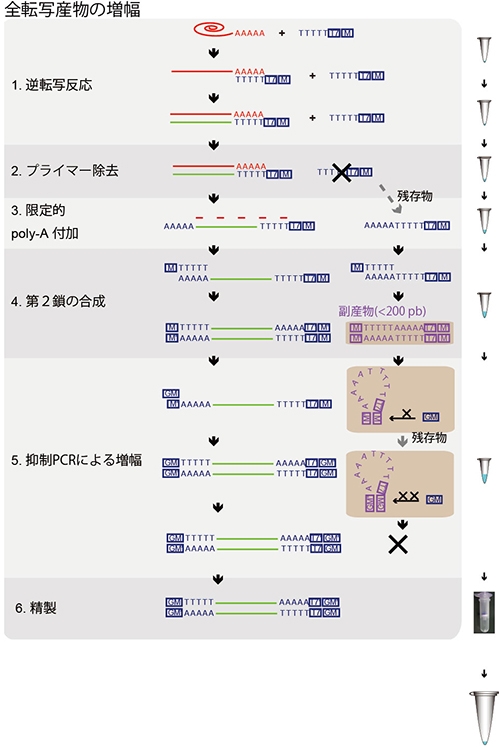
図2 Quartz-Seq法の概略
逆転写反応から精製まですべての過程を1本のマイクロチューブの中で行うことができる。
- 1.オリゴdT配列をもつ逆転写プライマーを用いて逆転写を行いmRNAに相補的なcDNAを得る。
- 2.過剰な逆転写プライマーはエキソヌクレアーゼIで除去するが、完全に除くことはできない。
- 3.逆転写されたcDNAの3’ 末端にターミナルトランスフェラーゼと呼ばれる酵素を用いてpoly-A付加を行う。除ききれなかった逆転写プライマーも同様に修飾される。
- 4.Poly-A鎖に結合させたタギングプライマーからの伸長反応により相補的な鎖(第2鎖)を合成する。結果、両端に相補的配列がついたDNAとなる。
- 5.逆転写プライマー由来の短いDNAの場合、両端の相補配列により残存プライマーはフライパン構造をとることで、PCRプライマーの結合が阻害される。一方でRNA由来の長いcDNAの場合、両端の相補配列が結合する前にPCRプライマーが結合することができる。結果として、逆転写プライマー由来の副産物の増幅は抑制され、目的のRNA由来cDNAの増幅が効率よく進む。
- 6.増幅したcDNAを精製する。
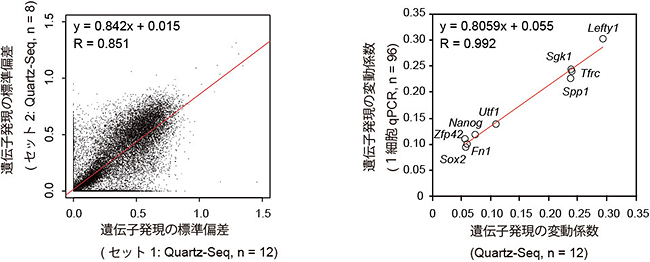
図3 網羅的遺伝子発現のゆらぎの検出
- (左) Quartz-Seq法による網羅的遺伝子発現のゆらぎの再現性。約17,000遺伝子のゆらぎに有為な再現性があった。
- (右) 非増幅1細胞qPCR法とQuartz-Seq法の遺伝子発現のゆらぎの相関。非増幅1細胞qPCR法によってQuartz-Seq法が捉えているものが遺伝子発現のゆらぎであることが分かった。Rは相関係数。
