2013年8月24日
独立行政法人理化学研究所
国立大学法人東京大学
腸管粘膜の異常増殖に関わるタンパク質を発見
-腸管上皮細胞でタンパク質を輸送するAP-1Bが細胞増殖の制御に関与-
ポイント
- AP-1Bが正常に機能しないと、細胞接着分子E-カドヘリンが細胞内で蓄積
- E-カドヘリン細胞内蓄積が、β-カテニンを不安定にして細胞増殖関連遺伝子を活性化
- 今後の研究進展で、大腸がんの新たな早期発見法や予後評価法の開発に期待
要旨
理化学研究所(理研、野依良治理事長)と東京大学(濱田純一総長)は、腸管上皮細胞において、細胞内タンパク質輸送因子「AP-1B[1]」が正常に機能しないと、腸管粘膜の異常増殖が引き起こされることを発見しました。これは理研統合生命医科学研究センター(小安重夫センター長代行)粘膜システム研究グループの大野博司グループディレクター、長谷耕二客員主幹研究員(現 東京大学医科学研究所特任教授、JST戦略的創造研究推進事業さきがけ研究員兼務)、中津 史研究員(現 米イェール大学医学部アソシエートリサーチサイエンティスト)を中心とする共同研究グループ[2]による研究成果です。
ヒトの腸管粘膜は、食べ物に含まれる細菌やウイルス、さらには数百兆個もの腸内常在細菌叢(そう)などの異物に常にさらされています。その最前線に位置する腸管上皮細胞は体内外の境界の役割を果たしています。腸管上皮細胞の細胞膜は、体外である腸管内に面する区画と体内に面する区画に物理的に分けられ、それぞれの区画に決まったタンパク質群が存在するように制御されており、境界として必要な機能を発揮しています。また、腸管上皮細胞は体内で最も盛んに分裂増殖する細胞の1つであり、ヒトの場合では約5日間で全ての細胞が入れ替わります。この腸管上皮細胞の増殖は厳密に制御されており、この制御機構に異常が生じると、がんの発生につながる危険性もあります。しかし、その詳細な分子メカニズムは未だ不明です。
共同研究グループは、上皮細胞で特定のタンパク質を輸送し局在させる因子AP-1Bに着目しました。AP-1B遺伝子を欠損させたマウスの小腸を調べたところ、その重量が3倍になり、腸管上皮細胞が過剰に増殖していることが分かりました。さらに詳しく調べてみると、AP-1Bが欠損しているため、通常であれば腸管上皮細胞の体内に面する細胞膜に局在する細胞接着分子E-カドヘリン[3]が、細胞内に蓄積していました。その結果、細胞間接着と細胞増殖に関わる分子であるβ-カテニン[4]とE-カドヘリンが形成する複合体が不安定になり、β-カテニンが細胞質から核内に移行することで腸管上皮細胞が過剰に増殖することを見いだしました。
今回の研究成果からAP-1Bが腸管上皮細胞のタンパク質局在機能と増殖を制御していることから、腸管上皮細胞のがん化との関連が今後明らかになるものと期待できます。本成果はアメリカ消化器学会発行の専門誌『Gastroenterology』(9月号)にオンライン掲載されます。
背景
細菌やウイルスなどの異物と接する生体の表面は、皮膚や粘膜によって保護されています。体の表面を覆う表皮は、重層する表皮細胞や角質層によって比較的堅牢な防壁を形成して、異物の侵入を食い止めています。一方、消化器官などの粘膜面の多くは、単層の粘膜上皮細胞で覆われているだけで、脆弱な防御機能しか持ち合わせていません。さらに、粘膜面の中でも特に腸管粘膜は、その主たる機能である栄養や水分の吸収効率を高めるために、約400 m2にも及ぶ広い表面積を持ち、食物に含まれるアレルギー物質や、食物とともに摂取される外来微生物、数百兆個にも及ぶ腸内常在細菌叢などの異物に常にさらされています。
このような危険な腸管粘膜の最前線に位置する腸管上皮細胞の細胞膜は、腸管内腔に面する「頂端面」と体内に面する「側底面」という2つの区画に明確に分けられています。それぞれには異なるタンパク質群が存在し、体内外という全く異なる環境を隔てる細胞として必要な機能を発揮します。このように、1つの細胞の中で部位により構成タンパク質の組成やそれに伴う機能が異なる現象を「細胞の極性」と呼びます。
また、さまざまな異物と常に接する腸管上皮細胞は、免疫細胞と並んで体内でも最も盛んに分裂増殖する細胞であり、ヒトの場合では約5日間で全ての細胞が入れ替わります。腸管上皮細胞はその極性を形成・維持しながら盛んな増殖を行わなければならないため、細胞極性と細胞増殖は密接に関連しながら制御されています。しかし、これまでその分子メカニズムは不明でした。
研究手法と成果
共同研究グループは、上皮細胞だけに存在し、特定のタンパク質を輸送して側底面の細胞膜に局在させる因子AP-1Bに着目しました。AP-1B遺伝子を腸管上皮細胞だけで欠損させたマウス(AP-1B欠損マウス)を作製し、その表現型を病理組織学的、生化学的に詳細に解析しました。その結果、AP-1B欠損マウスでは通常ほとんど死亡しない若齢(8週齢以前)での死亡率が約50%と異常に高く、生き残ったマウスでも、体重減少、小腸からの栄養吸収の低下、低血糖、低アルブミン血症、成長不良が認められました。また、AP-1B欠損マウスでは腸管上皮細胞のタンパク輸送の極性に異常があることを発見しました。さらに、AP-1B欠損マウスでは小腸の重量が通常の3倍ほどになり(図1)、また腸管上皮細胞の過剰な増殖が認められました(図2)。より詳細に解析した結果、AP-1Bが失われたために、通常では側底面に局在して細胞間接着として働いている細胞接着分子E-カドヘリンが細胞内の顆粒に蓄積していることが明らかになりました(図3)。また、本来E-カドヘリンと複合体を形成して細胞間接着を制御しているβ-カテニンは、E-カドヘリンとの結合が不安定となることが分かりました。β-カテニンには細胞間接着の機能だけでなく転写を活性化する機能もあります。通常β-カテニンは、未分化な幹細胞では核内に多く存在して増殖因子の転写活性化を介して細胞増殖に働き、分化した細胞では主としてE-カドヘリンとの複合体として細胞間接着に働きます。しかしAP-1Bが欠損するとE-カドヘリンとの結合が不安定となり、細胞質から核内にβ-カテニンが移行することで本来増殖しない分化した細胞においても細胞増殖に働く遺伝子の転写が上昇し、腸管上皮細胞が過剰に増殖することを見いだしました(図4)。この結果は、AP-1Bがこれまで不明であった腸管上皮細胞の極性と増殖を結びつける因子として、その両者を制御していることを示しています。
今後の期待
AP-1Bが腸管上皮細胞の極性と増殖を制御していることから、腸管上皮細胞のがん化との関連が示唆されます。理化学研究所の研究グループは、実際にマウスやヒトの大腸がん検体を用いた神戸大学や金沢大学との共同研究により、それを裏付ける結果を得ています。本研究をさらに発展させることにより、将来的にAP-1Bを標的とした新たながんの早期発見法や予後の評価法の開発が期待できます。
原論文情報
- Hase, K., Nakatsu, F., Ohmae, M., Sugihara, K., Shioda, N., Takahashi, D., Obata, Y., Furusawa, Y., Fujimura, Y., Yamashita, T., Fukuda, S., Okamoto, H., Asano, M., Yonemura, S., Ohno, H. "AP-1B-mediated protein sorting regulates polarity and proliferation of intestinal epithelial cells in mice. Gastroenterol." Gastroenterology 2013 doi: pii: S0016-5085(13)00745-2. 10.1053/j.gastro.2013.05.013
発表者
理化学研究所
統合生命医科学研究センター 粘膜システム研究グループ
グループディレクター 大野 博司 (おおの ひろし)
東京大学医科学研究所
国際粘膜ワクチン開発研究センター
粘膜バリア学分野
長谷 耕二 (はせ こうじ)
お問い合わせ先
統合生命医科学研究推進室
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
東京大学医科学研究所 管理課総務チーム 広報担当
Tel: 03-5449-5601 / Fax: 03-5449-5402
t-soumu [at] ims.u-tokyo.ac.jp (※[at]は@に置き換えてください。)
補足説明
- 1.AP-1B
Adaptor protein-1Bの略。Adaptor proteinは全部で7種類(ほとんどの組織や細胞に見だされる5種類と、組織・細胞特異的に見だされる2種類)存在するとされ、ヘテロ4量体からなる複合体タンパク質である。その中でも上皮細胞だけに存在するサブユニットμ1Bを構成要素としているAP-1Bは、上皮細胞だけに存在する。上皮細胞内ではトランスゴルジ網およびエンドソームと呼ばれる細胞小器官に局在し、その場で膜タンパク質を捕捉すると同時にタンパク質輸送小胞の形成を助ける。AP-1Bによって捕捉された膜タンパク質は、上皮細胞の体内に面する「側底面」細胞膜へと輸送される。 - 2.共同研究グループ
理研統合生命医科学研究センター 粘膜システム研究グループ/横浜市立大学大学院生命医学研究科生命医科学専攻免疫生物学研究室(大野博司、山下泰佑、長谷耕二、中津史、大前ますみ、塩田乃里子、高橋大輔、尾畑佑樹、藤村由美子、福田真嗣)のほか、東京大学医科学研究所(長谷耕二、尾畑佑樹、古澤之裕、藤村由美子)、JST戦略的創造研究推進事業さきがけ(長谷耕二)、金沢大学学際科学実験センター(杉原一司、浅野雅秀)、東北大学(岡本宏)、理研再生・発生科学総合研究センター(米村重信)の研究者各氏。 - 3.E-カドヘリン
上皮細胞の側面に存在する「密着班(aderens junction)」を形成する糖タンパク質で、隣接する細胞表面のE-カドヘリン同士が結合することにより細胞間接着をつかさどる。E-カドヘリンはβ-カテニンを含む複数の分子と複合体を形成し、この複合体がアクチン細胞骨格と結合することで細胞間接着を安定化する。 - 4.β-カテニン
細胞間接着と転写活性化という2つの異なる機能を持つ。分化した上皮細胞では、通常β-カテニンはE-カドヘリン複合体のサブユニットとして細胞間接着装置である「密着班(aderens junction)」に存在し、細胞間接着に働く。E-カドヘリンと複合体を形成しない遊離のβ-カテニンは、リン酸化とそれに引き続くユビキチン化により、速やかにプロテアソームで分解されるため、細胞質にはほとんど存在しない。しかし、未分化な幹細胞ではWntシグナルによりβ-カテニンのリン酸化が阻害される結果、細胞質に蓄積したβ-カテニンは核内に移行して、細胞増殖因子の転写活性化を介して細胞増殖に働く。
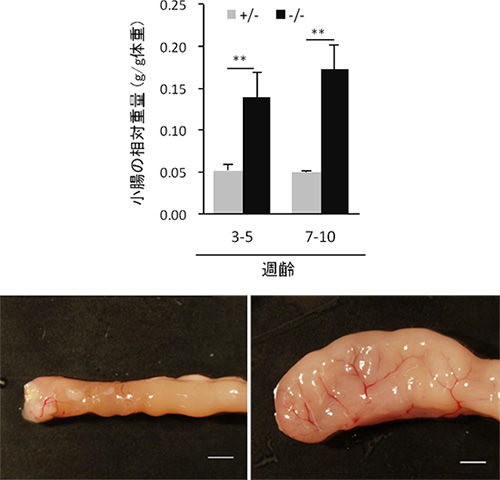
図1 APA-1B欠損マウスにおける小腸重量の増加
AP-1B欠損マウス(-/-)では、正常な対照マウス(+/-)と比較して小腸重量が約3倍に増加していた。スケールバーは2 mm。
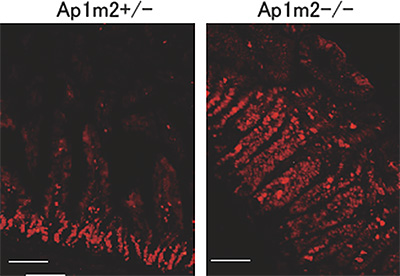
図2 AP-1B欠損マウスの腸管上皮細胞の増殖
AP-1B欠損マウス(Ap1m2-/-、右図)では正常な対照マウス(Ap1m2+/-、左図)と比較して、増殖細胞のマーカーであるKi67(赤)陽性の細胞が増加していた。スケールバーは100 µm。
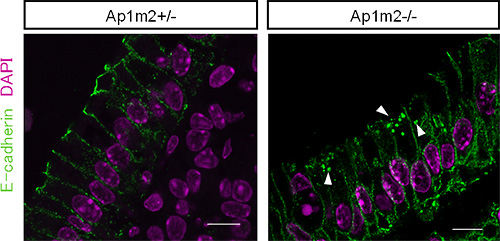
図3 AP-1B欠損マウスの腸管上皮細胞におけるE−カドヘリンの局在異常
正常な対照マウス(Ap1m2+/-、左図)ではE-カドヘリン(緑)は側底面細胞膜に局在するため線状に染色されるが、AP-1B欠損マウス(Ap1m2-/-、右図)では線状の染色に加え、細胞内顆粒への異常な蓄積が認められた(矢頭)。赤紫部分はDAPIというDNAと結合する試薬により核を描出している。スケールバーは10µm。
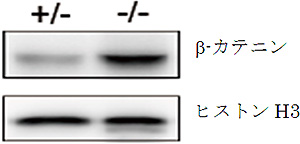
図4 AP-1B欠損マウスの腸管上皮細胞におけるβ-カテニンの核への移行
AP-1B欠損マウス(-/-、右)および正常な対照マウス(+/-、左)の腸管上皮細胞から核画分を精製し、タンパク質を抽出したのち、ウエスタンブロット法にてβ-カテニンとヒストンH3を検出した。核のマーカーであるヒストンH3は両者でほぼ同等の量が検出されているのに対し、β-カテニンはAP-1B欠損マウスの核で有意に多く検出されていることが分かる。この結果から、AP-1B欠損マウスのβ-カテニンは、細胞核内に移行し、本来増殖しない分化した細胞においても細胞増殖に働く遺伝子の転写が上昇させていることが示唆された。
