2014年3月26日
独立行政法人理化学研究所
公立大学法人大阪市立大学
銅の代謝異常をPETによる動態イメージングで診断
-メンケス病モデルマウスで銅と銅キレーター併用の効果を確認-
ポイント
- 銅の放射性同位体64Cuを用いたPETにより銅の臓器分布を可視化
- 銅と銅キレーターの併用が中枢神経障害や腎障害の予防に効果
- 銅代謝異常症の治療法開発に期待
要旨
理化学研究所(理研、野依良治理事長)と大阪市立大学(西澤良記理事長兼学長)は、先天性銅代謝異常症「メンケス病[1]」の治療において、銅と銅キレーター[2]を併せて投与することが、中枢神経障害や腎障害の予防に効果がある可能性を明らかにしました。メンケス病モデルマウスを陽電子放射断層画像法(PET)[3]で撮像し、銅代謝の改善を確認した結果によるものです。これは、理研ライフサイエンス技術基盤研究センター(渡辺恭良センター長)健康・病態科学研究チームの渡辺恭良チームリーダー、野崎聡研究員、大阪市立大学大学院医学研究科発達小児医学(新宅治夫教授)の野村志保大学院生らと、帝京大学医学部小児科学の児玉浩子客員教授との共同研究グループの成果です。
メンケス病は、腸管での銅吸収障害による銅欠乏のため、中枢神経障害や結合組織障害が起こる先天性銅代謝異常症の1つです。標準的な治療法はヒスチジン銅[4]の皮下投与ですが、治療開始が生後2カ月を過ぎると投与した銅が脳に移行しなくなり、脳障害が改善せずに合併症を併発して多くは幼児期に死亡します。一方、長期の銅注射は腎臓の尿細管[5]に銅が蓄積するため、将来的に腎障害をきたすことが懸念されています。従って、投与した銅の脳への移行を促進させ、かつ腎臓への蓄積を抑制する効果的な治療法の開発が求められています。
共同研究グループは、メンケス病モデルマウス(マクラマウス[6])に放射性銅(64CuCl2)と脂溶性キレーター「ジスルフィラム[7]」を併せて投与しました。すると、脳への銅の移行性が顕著に増加しました。一方、水溶性キレーター「ペニシラミン[8]」の併用では、腎臓からの銅の排泄が促進されました。いずれも銅の放射性同位体64Cuを組み込んだ分子(64CuCl2)をトレーサーとしたPETによる画像診断で明らかにしました。この結果は、メンケス病は銅キレーターの併用により、生後2カ月以降でも症状が改善できる可能性を示唆しています。また、今回用いた64Cuを用いたPETによる画像診断は、銅代謝異常症の新しい治療法の開発や評価に有用であることが分かりました。
本研究は、日本学術振興会の科学研究費補助金および厚生労働科学研究費補助金の「難治性疾患克服研究経費」の支援を受けて行われ、成果は、米国の科学雑誌『The Journal of Nuclear Medicine』(5月号)に掲載されるのに先立ち、オンライン版(3月13日付き)に掲載されました。
背景
メンケス病はX染色体に存在する銅輸送ATPase遺伝子(ATP7A)の異常が原因の先天性銅代謝異常症で、国内では男児14万人に対して1人の発生頻度と推定されています(出典:難病情報センターホームページ)。ATP7Aは銅輸送トランスポーターとしてゴルジ体膜上に発現し、銅の細胞内での輸送および細胞から銅を分泌する働きがあります。この働きにより、腸管では食物中の銅を体内に取り込み、脳では血中の銅を脳内に移行させて、細胞の生存に必須な銅を供給しています。メンケス病ではATP7Aが働かないために、腸管での銅吸収に障害が生じ、また血液脳関門[9]で銅が神経細胞に輸送されず、神経変性が生じます。標準的な治療法はヒスチジン銅の皮下投与ですが、母体由来の銅が欠乏する生後2カ月以内に治療を開始しないと重い神経障害や結合組織異常をきたし、多くは幼児期に死亡します。また、新生児期の診断はメンケス病の特異所見(痙攣や発達遅滞など)が乏しいため困難という問題もあります。
生後2カ月以降の治療に関しては、2005年に帝京大学の児玉浩子客員教授らが、メンケス病モデルマウスを使った実験で、ヒスチジン銅と脂溶性キレーター「ジスルフィラム」の皮下注射で脳の銅濃度と銅酵素「チトクロームCオキシダーゼ」の活性の改善が認められたと報告しています。ジスルフィラムはもともと嫌酒剤として認可された医薬品です。現在、メンケス病への適用を検討するため、児玉浩子客員教授らがメンケス病患者に対するヒスチジン銅とジスルフィラム併用療法の治験を帝京大学医学部附属病院で行っています。その治験と並行して、中枢神経系への銅移行性を非侵襲で評価できる新たな手法の開発が進められていました。また、ヒスチジン銅の長期投与は、腎臓へ銅が蓄積することが報告されており腎障害の副作用が懸念されるものの、その対策が行われていないのが現状です。そこで、共同研究グループは、銅の中枢神経系への移行および腎臓からの排泄をヒトで安全に確認できる診断技術の確立を目指し、PETを用いた非侵襲的な画像診断法の開発に取り組みました。
研究手法と成果
実験では、銅の細胞内輸送および細胞外分泌を担うATP7A遺伝子を変異させたメンケス病モデルマウス(マクラマウス)に放射性銅(64CuCl2)と、2タイプの銅キレーター(脂溶性キレーター、水溶性キレーター)それぞれを併用した時の64Cuの体内動態をPETで評価しました。
まず、脂溶性キレーター「ジスルフィラム」の併用時について評価したところ、正常マウスとマクラマウスともに64Cuが脳へ顕著に移行することが確認できました(図1)。これは、脂溶性キレーター投与により、ATP7Aトランスポーターを介さずに銅が脳内移行することを示します。
次に、PETとイメージングプレート[10]を用いて、ジスルフィラムと水溶性キレーター「ペニシラミン」、それぞれの併用時について64Cuの体内動態を評価しました。その結果、キレーターを併用しないマクラマウスでは腎臓に64Cuの強い蓄積が観察され、ジスルフィラムを併用したマクラマウスでは腎臓への蓄積が減少し、肝臓と脳での蓄積が増加しました。これに対し、ペニシラミンを併用したマクラマウスでは、腎臓や肝臓での蓄積が減少し、尿中に64Cuが顕著に排泄されていることが確認できました(図2)。
これらの結果は、メンケス病の治療において、脂溶性キレーター「ジスルフィラム」を併用することで中枢神経障害を、水溶性キレーター「ペニシラミン」を併用することで腎障害を予防する可能性があることを示唆しています。
今後の期待
ATP7A遺伝子異常が原因の銅代謝異常症には、メンケス病以外にもOccipital horn症候群、ATP7A関連遠位運動神経障害などが報告されており、これらの疾患はいずれも根本的な治療法がありません。銅の投与は発症を抑える効果がありますが、多量に蓄積すると毒性を発揮するため、治療中には十分な経過観察が必須です。今回開発した64Cuを用いたPETによる銅の体内動態解析法をヒトに適用することで、投与した銅の標的臓器への移行や、副作用の原因となる臓器への蓄積を非侵襲的に経過観察することが可能となります。PETによる画像診断の新たな応用として、銅代謝異常症の治療法開発に非常に有用な技術となると期待できます。
原論文情報
- Shiho Nomura, Satoshi Nozaki, Takashi Hamazaki, Taisuke Takeda, Eiichi Ninomiya, Satoshi Kudo, Emi Hayashinaka, Yasuhiro Wada, Tomoko Hiroki, Chie Fujisawa, Hiroko Kodama, Haruo Shintaku, Yasuyoshi Watanabe, "PET Imaging Analysis with64Cu in Disulfiram Treatment for Aberrant Copper Bio-distribution in Menkes Disease Mouse Model", The Journal of Nuclear Medicine, vol.55, 2014, doi: 10.2967/jnumed.113.131797
発表者
独立行政法人理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング応用研究グループ 健康・病態科学研究チーム
チームリーダー 渡辺 恭良 (わたなべ やすよし)
研究員 野崎 聡 (のざき さとし)
お問い合わせ先
独立行政法人理化学研究所
ライフサイエンス技術基盤研究センター
チーフ・サイエンスコミュニケーター 山岸 敦 (やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.メンケス病
銅の細胞内輸送や細胞外分泌を担うトランスポーターATP7Aの遺伝子異常により重篤な銅欠乏に陥る先天性銅代謝異常症の1つ。発症頻度は男児14万人に1人(出典:難病情報センターホームページ)。生後2カ月ころから低体温、けいれん、発育遅延、硬膜下血腫などを発症する。また、さまざまな合併症を併発し、多くは幼児期に死亡する。治療ではヒスチジン銅の皮下注射が行われているが、症状の現れる生後2カ月以降、特に神経症状が発症してからの治療では神経障害に対して効果がなく、発症前の早期診断法や新たな治療法の開発が求められている。 - 2.キレーター
金属イオンと配位結合し錯体を形成する物質の総称。食品添加物、洗剤、医療用医薬品など利用範囲は広い。 - 3.陽電子放射断層画像法(PET)
PETはPositron Emission Tomographyの略。陽電子を放出する放射性同位体を薬などの分子に組み込んで個体に投与し、体内で崩壊して放出されるγ線を測定して分子の体内分布を見る方法。 - 4.ヒスチジン銅
アミノ酸の一種であるヒスチジンは金属をキレートする作用があり、2分子のヒスチジンで1つの銅原子と結合する。メンケス病の治療において欠乏した銅の補充目的に使用されている。 - 5.尿細管
腎臓に存在し、糸球体で生成された尿中の水分や電解質など身体に必要な成分を再吸収したり、不要な成分を尿へ排出させたりする器官。 - 6.メンケス病モデルマウス(マクラマウス)
銅の細胞内輸送および細胞外分泌を担うトランスポーター ATP7A遺伝子に変異のあるマウス。成長障害や血液中や組織内銅濃度の低下などメンケス病と同様の臨床症状や病理所見を示すためメンケス病のモデル動物として利用されている。 - 7.ジスルフィラム
テトラエチルチウラムジスルフィド(Tetraethylthiuram disulfide)ともいわれる。生体内で代謝され生じるジエチルジチオカルバメート(Diethyldithiocarbamate)が金属キレート作用を有するため本研究で用いた。一般的には、本物質のアルデヒドデヒドロゲナーゼ阻害作用を利用し、肝臓におけるエタノール代謝を抑制しアセトアルデヒドを体内に蓄積させ悪酔いを生じさせるという、アルコール依存症治療の抗酒癖剤として活用されている。 - 8.ペニシラミン
ペニシリンを加水分解することによって得られるシステインのジメチル誘導体。金属キレート作用を有する水溶性物質であるために、重金属中毒やウィルソン病など金属が蓄積した疾患でペニシラミン‐金属錯体として尿中排泄を促す治療薬に用いられている。また、免疫抑制作用も有し抗リウマチ剤としても利用されている。 - 9.血液脳関門
血液と脳との間に存在する物質の透過を制限する関門。主に毛細血管内皮細胞が密に接していることによる物理的障壁と考えられている。水溶性の物質や分子量の大きいタンパク質などは血液脳関門を通常は通過できないが、脳で必要な物質はトランスポーターによって透過し、また、毒物や薬物などが内皮細胞膜を通過しても排泄トランスポーターによって排泄される機構が備わっていることも判明している。 - 10.イメージングプレート
放射線のエネルギーを光に変換する性質を持った蛍光フィルム。放射線に対する感度が高く、デジタルデータとして画像を取得することができる。
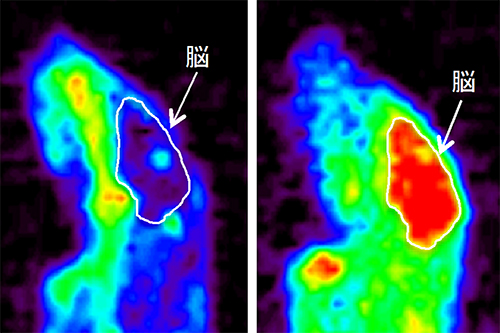
図1 脂溶性キレーター「ジスルフィラム」併用による銅の脳内移行の促進
メンケス病モデルマウス(マクラマウス)で64CuCl2とジスルフィラムの併用が、銅(64Cu)の脳内移行性に影響を与えるかをPET撮像で評価した。銅の蓄積を赤色のシグナルで示す。
- 左: ジスルフィラムを併用しなかったマクラマウスの脳には銅が移行しなかった。
- 右: ジスルフィラムを併用したマクラマウスでは顕著な脳内移行が確認できた。
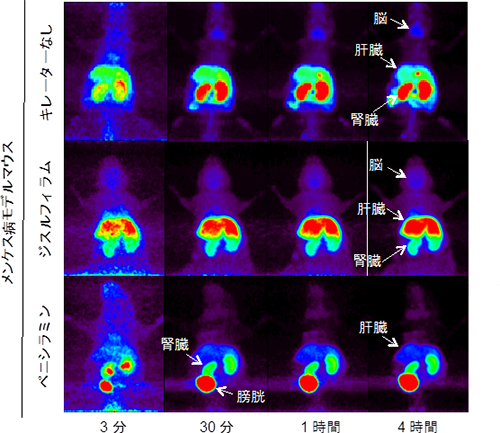
図2 水溶性キレーター「ペニシラミン」併用による銅の尿排泄の促進
メンケス病モデルマウス(マクラマウス)に64CuCl2を投与し、ジスルフィラムとペニシラミンそれぞれの併用が銅(64Cu)の尿排泄を促進するかをPET撮像で評価した。銅の蓄積を赤色のシグナルで示す。
- 上: キレーターを併用しなかったマクラマウスでは腎臓に銅の強い蓄積が見られた。
- 中: ジスルフィラム併用では腎臓への蓄積が減少し、肝臓および脳での蓄積が増加した。(本図では内臓器官の強いシグナルの差を検出する画像解析を行っており、脳の詳細な変化は図1を参照)
- 下: ペニシラミン併用では腎臓と肝臓での蓄積が減少し、さらに尿排泄が促進された(膀胱のシグナル)。
