ポイント
- プロトカドヘリン17(Pcdh17)を欠損した軸索群は伸長が阻害される
- Pcdh17とアクチン重合制御因子によって軸索接触部位の運動活性が維持される
- 情動といった脳の高次機能を生み出す神経回路の形成メカニズムの理解に重要
要旨
理化学研究所(理研、野依良治理事長)は、マウスの脳の発生過程において扁桃体[1]の神経細胞の軸索[2]が伸長する仕組みを調べ、軸索同士がお互いの接触を介して伸長運動を支えていることを発見し、さらに、その分子メカニズムを解明しました。これは、理研発生・再生科学総合研究センター(竹市雅俊センター長)高次構造形成研究グループの竹市雅俊グループディレクター、林周一研究員らの研究チームの成果です。
動物の脳の発生過程では、神経細胞が軸索と呼ばれる突起を伸ばし、別の神経細胞の樹状突起[2]との間でシナプス結合[2]をつくることにより、神経回路を形成します。それぞれの軸索は脳内の決められた経路に沿って伸長し、別の神経細胞に到達します。その過程で、同じ種類の神経細胞の軸索が束を形成しながら伸長することが知られていました。しかし、隣り合う軸索の間でどのような情報のやりとりが行われているのかは明らかになっていませんでした。
研究チームは、以前から細胞同士の接着に関わる分子カドヘリンスーパーファミリー[3]に属する「プロトカドヘリン[4]」の機能を調べてきました。その中で、プロトカドヘリン17(Pcdh17)が、マウスの扁桃体から視床下部方面へ伸びる軸索上に存在することに着目し、Pcdh17が軸索の伸長を制御しているのではないかと考えました。Pcdh17遺伝子を欠損させたマウスを作製しその脳を観察したところ、扁桃体からの軸索の伸長が阻害されていることが分かりました。一方、Pcdh17を発現していない扁桃体の神経細胞にPcdh17を外部から強制発現させると、軸索の束の形成パターンが変化しました。またPcdh17は、軸索同士の接触部位に、細胞骨格の1つであるアクチン線維の形成に必要なWAVE複合体[5]などのアクチン重合[6]制御因子を集結させ、軸索の伸長運動を支えていることが分かりました。これらの結果から、扁桃体の軸索同士がお互いに伸長運動を支えながら集団で伸長すること、その制御のためにPcdh17が重要な役割を果たしていることが明らかになりました。この成果は、神経回路形成の分子基盤の理解を進め、情動といった脳の高次機能の形成機構の理解につながると期待できます。
本研究成果は、米国の科学雑誌『Developmental Cell』(9月29日号)に掲載されるのに先立ち、オンライン版(9月4日付:日本時間9月5日)に掲載されました。
背景
動物の脳の発生過程では、神経細胞が軸索と呼ばれる突起を伸ばし、別の神経細胞の樹状突起との間でシナプス結合をつくることにより、神経回路を形成しています。それぞれの軸索は脳内の決められた経路に沿って伸長し、別の神経細胞に到達します。その過程で、同じ種類の神経細胞の軸索が束を形成しながら伸長することが知られていました。しかし、隣り合う軸索の間でどのような情報のやりとりが行われているのかは明らかになっていませんでした。
細胞同士の接着に関わる分子カドヘリンスーパーファミリーに属する「プロトカドヘリン」は脊椎動物の脳を含む神経組織に広く発現しており、脳の発生の制御に重要な役割を果たすのではないかと考えられてきました。しかし、その機能は明らかになっていませんでした。研究チームはこれまでに、プロトカドヘリン10(Pcdh10)が特定の神経細胞の軸索の伸長に必要であること、またPcdh10を培養細胞に導入すると、細胞運動が促進されることを明らかにしています。しかし、プロトカドヘリンが軸索の伸長を制御する分子メカニズムは分かっていませんでした。研究チームは、Pcdh10と同じタンパク質グループに属するプロトカドヘリン17(Pcdh17)の機能についても調べてきました。その過程で、Pcdh17がマウスの扁桃体から視床下部方面へ伸びる軸索上に存在することが分かり(図1)、軸索伸長におけるPcdh17の役割を遺伝子欠損マウスや神経細胞の蛍光ライブイメージング[7]などを使って調べることにしました。
研究手法と成果
研究チームはまず、Pcdh17遺伝子を欠損させたマウスを作製しました。その脳を観察したところ、扁桃体から視床下部方面へ伸長する軸索が減少していることが分かりました。次にその原因を探るために、扁桃体の軸索が伸長する過程を野生型マウスとPcdh17変異型マウスで比較しました。Pcdh17は扁桃体の特定の神経細胞群にのみ発現しているため、多くの軸索の中からその特定の神経細胞群の軸索を見分ける必要があります。そこで、Pcdh17を発現する神経細胞群を蛍光ラベルしたマウスを作製しました。それにより、野生型マウスではPcdh17を発現する軸索を、Pcdh17変異型(欠損型)マウスではPcdh17を欠損した軸索を蛍光観察することが可能になります。これらのマウスから扁桃体を取り出して培養し、組織片から伸びる軸索を蛍光ライブイメージングにより観察しました。その結果、野生型の軸索は他の軸索と接触しても、接触した軸索に沿って伸長を続けますが(図2左)Pcdh17を欠損した軸索は他の軸索と接触すると伸長が止まることが分かりました(図2右)。このことから、Pcdh17は軸索同士が接触しながら伸長を続けるために必要なことが分かりました。また、細胞にDNAなどの分子を注入することができるエレクトロポレーション法[8]を用いて、本来Pcdh17を発現していない神経細胞にPcdh17を強制発現させました。その結果、軸索の束の形成パターンが変化して、Pcdh17を強制発現させた軸索が内在性Pcdh17をもつ軸索と一緒に伸長するようになりました(図3)。これは、Pcdh17が軸索の集団的な伸長を制御していることを示しています。
続いて、Pcdh17の機能の分子メカニズムの解明に取り組みました。細胞や組織の中のタンパク質を検出する免疫染色法[9]とタンパク質同士の相互作用を検出するプルダウンアッセイ法[10]を用いて、神経細胞を詳しく調べました。その結果、Pcdh17の細胞内領域に、細胞骨格の1つであるアクチン線維の形成を制御するWAVE複合体が結合することを発見しました。さらに、別のアクチン重合制御因子であるLamellipodin(Lpd)[11]、Ena/VASP[12]も軸索同士の境界に濃縮することが分かりました。これらの因子の濃縮は、Pcdh17を欠損した軸索同士の境界では消失することから、Pcdh17に依存していることが明らかになりました。野生型の軸索は他の軸索と接触しても伸長を続けるのに対して、Pcdh17を欠損した軸索は伸長が止まる(図2)という結果を考慮すると、Pcdh17はこれらのアクチン重合制御因子を軸索の接触部位に集結させて、その部位の運動性を維持していると考えられます。
最後に、軸索の先端と同様に活発な葉状仮足[13]を持つ培養細胞を用いてPcdh17の機能をさらに詳しく調べました。この培養細胞を使うことにより、軸索では難しいPcdh17とアクチン重合制御因子、細胞の運動性との関係を詳細に解析することが可能になりました。その結果、細胞接触部位ではPcdh17がWAVE複合体、Lpd、Ena/VASPといったアクチン重合制御因子と相互作用することによって、これらの因子が濃縮することが分かりました。さらに、これらの因子の濃縮により、細胞接着部位でも葉状仮足と同じような独特の構造を持ち、運動性が上がることが明らかになりました(図4)。これらのことから、軸索同士の接触部位でも同様の仕組みによって軸索の運動性が維持されているのではないかと考えられます。
以上の結果から、Pcdh17は扁桃体から伸びる特定の神経細胞の軸索群において、隣り合う軸索同士の伸長運動を支える役割を果たし、同じ種類の軸索が集団的に伸長する仕組みを作り出していることが明らかになりました(図5)。
今後の期待
扁桃体は情動に基づく記憶の制御に重要であり、マウスでは嗅覚からの情報をもとに、生殖行動や防御行動を制御することが報告されています。Pcdh17遺伝子を欠損させたマウスでは、扁桃体からの軸索の伸長が阻害されることから、神経回路に異常をきたし、生殖行動などに影響を及ぼす可能性があります。また、Pcdh17を含むプロトカドヘリン群は、自閉症や統合失調症、また女性のみに起こる特殊なてんかんの原因遺伝子であることが報告されています。今回Pcdh17の研究で得られた知見を生かすことで、ヒトの疾患の原因の理解がより深まると期待できます。
原論文情報
- Shuichi Hayashi, Yoko Inoue, Hiroshi Kiyonari, Takaya Abe, Kazuyo Misaki, Hiroyuki Moriguchi, Yo Tanaka, and Masatoshi Takeichi.
"Protocadherin-17 Mediates Collective Axon Extension by Recruiting Actin Regulator Complexes to Interaxonal Contacts"
Developmental Cell, 2014, doi:10.1016/j.devcel.2014.07.015
発表者
理化学研究所
発生・再生科学総合研究センター 高次構造形成研究グループ
グループディレクター 竹市 雅俊(たけいち まさとし)
研究員 林 周一(はやし しゅういち)
お問い合わせ先
発生・再生科学総合研究センター 国際広報室
Tel: 078-306-3310 / Fax: 078-306-3090
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.扁桃体
情動反応と記憶の制御に関わる脳の領域で、複数の神経細胞群(神経核)からなる。神経核ごとに異なる機能を持つが、例えば、マウスの扁桃体内側核の神経細胞は、嗅覚からの入力情報を受けて生殖行動や外敵に対する防御行動を制御することが報告されている。 - 2.軸索、樹状突起、シナプス結合
神経細胞は軸索と呼ばれる長い突起と、樹状突起と呼ばれる複数の突起を伸ばす。ある神経細胞から伸びる軸索は、別の神経細胞の樹状突起との間にシナプス結合をつくり、情報伝達を行う。

- 3.カドヘリンスーパーファミリー
膜貫通タンパク質で細胞外にECドメインという保存されたドメイン構造を持つ分子群。細胞間接着をつかさどるE-cadherinやN-cadherinなどのクラシカルカドヘリンの他に、プロトカドヘリンなどのサブファミリーを含む。ヒトには約120のカドヘリン遺伝子がある。 - 4.プロトカドヘリン
カドヘリンスーパーファミリーの中で最も数の多い分子群。ゲノム上に並ぶ複数の遺伝子コード領域から確率的に一部が選択されるクラスター型プロトカドヘリンと、通常の遺伝子と同様のゲノム構造をもつ非クラスター型プロトカドヘリンがある。Pcdh17は後者に属する。脊椎動物の神経組織で主に発現している。 - 5.WAVE複合体
Sra1/Cyfip1、Nap1/Hem2/Kette、WAVE1/SCAR、Abi1/2/3、HSPC30/Brick1を含むタンパク質複合体。細胞の葉状仮足に局在し、細胞運動を引き起こす。アクチン繊維の枝分かれ構造を作り出すArp2/3を活性化する機能がよく知られている。 - 6.アクチン重合
タンパク質アクチンが、らせん状に多量体をつくる過程。これにより、細胞骨格の1つであるアクチン繊維が形成される。 - 7.蛍光ライブイメージング
生きたままの試料を用いて、組織の中の細胞の振る舞い(形や移動、増殖)や細胞内のタンパク質の動きを観察する技術。オワンクラゲやサンゴ由来の蛍光タンパク質(GFP、Kusabira-Orangeなど)を目的の細胞に導入すると、蛍光ラベルされた細胞やタンパク質を生きたまま継時的に蛍光観察できる。 - 8.エレクトロポレーション法
電気パルスをかけることによって細胞にDNAなどの分子を導入する方法。本研究では、マウス子宮内の胎児の脳室にDNAを注入し、電気パルスを与えることで胎児の脳の神経細胞に遺伝子の強制発現を行った。 - 9.免疫染色法
細胞や組織におけるタンパク質を検出するために広く用いられる手法。抗体が持つ特性を利用するため、免疫染色法と呼ばれる。検出したいタンパク質に対する抗体(一次抗体)を作製し、ホルマリンなどで固定した組織や、その切片に抗体を反応させる。すると抗体は、目的タンパク質にのみ結合する。抗体をあらかじめ蛍光色素などでラベルしておけば、タンパク質が存在するところだけが蛍光などを発するので、組織の中のどの細胞がそのタンパク質を発現しているか、あるいは細胞の中のどこにタンパク質が局在しているかを知ることができる。抗体を認識する抗体(二次抗体)を蛍光色素などでラベルして一次抗体と反応させ、蛍光を顕微鏡などで検出する方法が広く用いられている。 - 10.プルダウンアッセイ法
タンパク質同士の相互作用を検出する方法。タグ(荷札)をつけたタンパク質(ベイトタンパク質)を細胞抽出液や他のタンパク質を含む溶液と混ぜて反応させた後に、タグを使ってベイトタンパク質を回収する。ベイトタンパク質と一緒に回収されたタンパク質を調べることにより、ベイトタンパク質と相互作用するタンパク質を同定できる。 - 11.Lamellipodin(Lpd)
葉状仮足の先端に存在して、細胞運動を制御する分子。Ena/VASP分子に結合してアクチン繊維の重合を制御する。 - 12.Ena/VASP
細胞の葉状仮足や細胞と基質の接着(細胞接着斑、focal adhesion)に存在し、細胞運動の制御に重要な働きをする。脊椎動物にはEVL、Mena、VASPという3種類のEna/VASPファミリーの分子が存在する。 - 13.葉状仮足
細胞は仮足と呼ばれる突起を使って運動をする。先端が丸みを帯びた仮足を葉状仮足と呼ぶ。細胞膜付近のアクチン重合によってアクチン繊維のネットワークがつくられ、仮足の運動が引き起こされる。
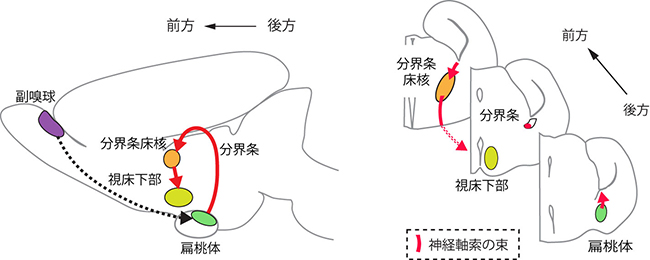
図1 扁桃体から視床下部方面への軸索経路の例
脳の縦断面(左図)と横断面(右図)。Pcdh17がマウスの扁桃体から視床下部方面へ伸びる軸索上に存在することが分かった。
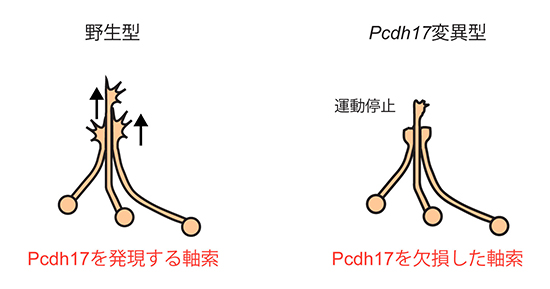
図2 プロトカドヘリン17を欠損した軸索は伸長が阻害される
- 左: 野生型の軸索は他の軸索と接触しても、接触した軸索に沿って伸長運動を続ける。
- 右: Pcdh17変異型(欠損型)の軸索は他の軸索と接触すると伸長運動が停止する。
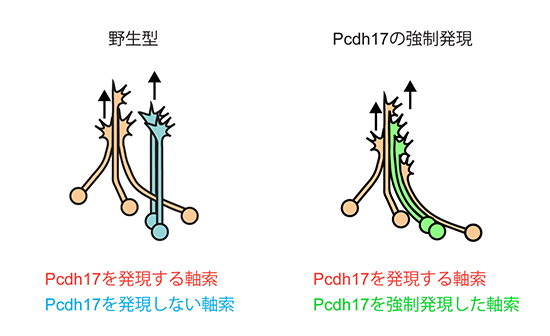
図3 プロトカドヘリン17の強制発現による軸索伸長パターンの変化
- 左: 野生型の軸索では、Pcdh17を発現する軸索(オレンジ)と発現しない軸索(青)は別の集団で伸長する。
- 右: 本来Pcdh17を発現していない神経細胞(左図、青)にPcdh17を強制発現させると、軸索の束の形成パターンが変化して、Pcdh17を強制発現させた軸索(緑)は内在性Pcdh17をもつ軸索(オレンジ)と一緒に伸長する。
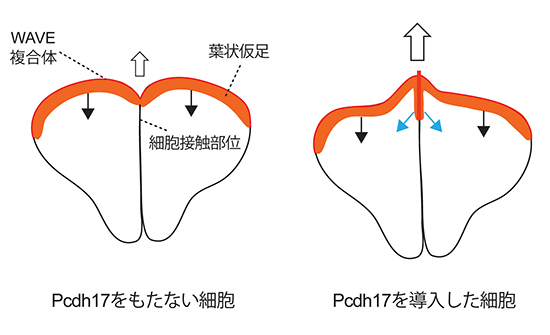
図4 プロトカドヘリン17(Pcdh17)による細胞運動の活性化
プロトカドヘリン17(Pcdh17)を持たない細胞では、WAVE複合体は細胞の葉状仮足に濃縮するが、細胞接触部位では消失する。細胞の先端部位は、突出と退縮を繰り返しながら少しずつ前に進むため、顕微鏡下では、細胞の先端から後方へ周期的な波が伝わる様子が観察される(黒矢印)。一方、Pcdh17を強制発現させた細胞では、細胞接触部位の周辺領域でもWAVE複合体が濃縮することにより、細胞の運動性が上昇する(白矢印)。その領域では、細胞の葉状仮足と同様に後方に向かって波が発生することから(青矢印)、細胞の接触部位でありながら葉状仮足と同様の運動性を維持していると考えられる。
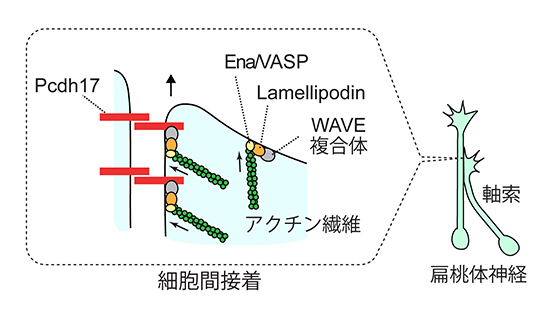
図5 プロトカドヘリン17(Pcdh17)が細胞運動を制御する分子メカニズム
Pcdh17、WAVE複合体、Lamellipodin(Lpd)、Ena/VASPの順に相互作用が起こり、これらの因子が軸索同士の境界に濃縮されることが分かった。Pcdh17はこれらのアクチン重合制御因子を軸索の接触部位に集結させ、Ena/VASPによるアクチン重合の促進を介して、その部位の運動性を高めていると考えられる。
