要旨
理化学研究所(理研)統合生命医科学研究センター 免疫細胞システム研究グループの小安重夫グループディレクターらの研究チーム※は、免疫反応を一定に保つ働きを担う免疫細胞「制御性T細胞(Treg)[1]」のうち、内臓脂肪に存在するTregが、脂肪組織に特徴的な分化・増殖のメカニズムを持つことを発見しました。
現代社会で増加している生活習慣病の病態の一部には、肥満で脂肪組織が恒常性を保てなくなることが関係すると考えられています。例えば、肥満によって内臓脂肪組織に炎症が生じると、インスリン感受性[2]が低下して耐糖能[2]が下がり、血糖値が上がりやすくなります。内臓脂肪に存在するTregは、内臓脂肪組織の炎症を抑えることで、インスリン感受性や耐糖能を一定に保つ働きをしています。
研究チームは、内臓脂肪組織のTregがどのように分化・増殖するのか、そのメカニズムを明らかにするため、野生型マウスの内臓脂肪組織からTregを採取し、細胞内の分子発現を解析することで、内臓脂肪組織のTregの性質を詳しく調べました。その結果、内臓脂肪組織では体の他の部位と異なり、Tregにインターロイキン-33(IL-33)受容体[3]が高発現していることが分かりました。そこで、IL-33[3]あるいはIL-33受容体を遺伝的に欠損したマウスを用いて内臓脂肪組織を調べたところ、Tregがほとんど存在せず、内臓脂肪組織のTregの分化・増殖にはIL-33とIL-33受容体が必須であることが分かりました。
さらに、肥満マウスの内臓脂肪組織を調べたところ、内臓脂肪組織のTregが大幅に減少し、血糖値が上昇していました。そこで、IL-33を肥満マウスに投与したところ、内臓脂肪組織のTregが増加し、血糖値が改善されました。
ヒトの内臓脂肪組織のTregでも、マウスと同様にIL-33受容体が高発現していたことから、ヒトでもIL-33が内臓脂肪組織のTregの分化・増殖に関係しているのではないかと考えられます。この成果は、ヒトの肥満や2型糖尿病[4]の病態解明・治療応用に役立つと期待できます。
研究成果は、英国の科学雑誌『Nature Immunology』オンライン版(1月19日付け:日本時間1月20日)に掲載されました。
※研究チーム
ウォルター・アンド・エリザ・ホール医学研究所 (オーストラリア)
Laboratory Head Axel Kallies (アクセル カリース)
理化学研究所統合生命医科学研究センター 免疫細胞システム研究グループ
グループディレクター 小安 重夫 (こやす しげお)
背景
現代社会で増加している生活習慣病の病態の一部には、肥満で脂肪組織が恒常性を保てなくなることが関係しています。例えば、肥満によって内臓脂肪組織に炎症が生じると、インスリン感受性が低下して耐糖能が下がり、血糖値が上昇しやすくなります。
制御性T細胞(Treg)は、過度な免疫反応を抑制し、免疫反応を一定に保つ免疫細胞です。内臓脂肪組織に存在するTregは、内臓脂肪組織の炎症を抑え、インスリン感受性や耐糖能を一定に保つ働きをするといわれています。しかし、内臓脂肪組織のTregがどのように増殖し、機能を発揮して、生活習慣病の病態と関係しているのか、そのメカニズムは明らかになっていませんでした。
そこで、今回研究チームは、内臓脂肪組織のTregについて詳しく調べ、どのように分化・増殖するのか、そのメカニズムを明らかにするとともに、肥満のモデルマウスを用いて、内臓脂肪組織のTregと生活習慣病との関係を調べることにしました。
研究手法と成果
研究チームは、野生型マウスの内臓脂肪組織からTregを採取し、細胞中の分子の発現を解析しました。その結果、内臓脂肪組織のTregはBlimp1という分子(遺伝子発現を誘導する転写因子)を発現しており、高い免疫抑制活性を持つことが分かりました。さらに、内臓脂肪組織のTregでは、体の他の部位と異なり、インターロイキン-33受容体(IL-33受容体)が高発現していました。そこで、IL-33あるいはIL-33受容体を遺伝的に欠損したマウスを用いて内臓脂肪組織を調べたところ、Tregがほとんど存在せず、内臓脂肪組織のTregの分化・増殖にはIL-33とIL-33受容体が必須であることが分かりました(図1)。
続いて、肥満のマウスモデルを用いて、肥満と内臓脂肪組織のTregとの関係を調べました。まず、遺伝的に早期に肥満になるマウス(NZOマウス[5])を調べたところ、内臓脂肪にTregがほとんど存在せず、血糖値が上昇していることが分かりました(図2)。そこで、IL-33をNZOマウスに投与したことろ、内臓脂肪組織にTregが増加し、血糖値が改善されました(図2)。
同様に、高脂肪食を与えた肥満マウス(HFDマウス)でも内臓脂肪組織中のTregが大幅に減少し、耐糖能が低下していました。そこで、HFDマウスにIL-33を投与したところ、内臓脂肪のTregが増加し、血糖値や耐糖能が改善されました(図3)。
今後の期待
研究チームは、ヒトの腹膜の脂肪組織でも、マウスと同様に、TregでIL-33受容体の発現が見られることを確認しました。このことから、ヒトでもIL-33が内臓脂肪の代謝恒常性の維持に重要であると考えられます。
しかし、IL-33は、喘息などのアレルギー疾患を誘導することが知られており、その投与には注意が必要です。
今後、さらに内臓脂肪組織での免疫恒常性維持のメカニズムを明らかにしていくことで、ヒトの肥満や2型糖尿病の病態解明・治療応用につながると期待できます。
原論文情報
- Ajithkumar Vasanthakumar, Kazuyo Moro, Annie Xin, Yang Liao, Renee Gloury, Shimpei Kawamoto, Sidonia Fagarasan, Lisa A. Mielke, Shoukat Afshar-Sterle, Seth L. Masters, Susumu Nakae, Hirohisa Saito, John M. Wentworth, Peng Li, Wei Liao, Warren J. Leonard, Gordon K. Smyth, Wei Shi, Stephen L. Nutt, Shigeo Koyasu & Axel Kallies, "IRF4/BATF and interleukin-33 orchestrate development and maintenance of adipose tissue resident regulatory T cells", Nature Immunology, doi: 10.1038/ni.3085
発表者
理化学研究所
統合生命医科学研究センター 免疫細胞システム研究グループ
グループディレクター 小安 重夫 (こやす しげお)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.制御性T細胞(Treg)
T細胞は、T細胞受容体と呼ばれるタンパク質を細胞表面に持ち、この受容体を介して異物を特異的に認識して活性化する。ウイルス感染細胞などを殺すキラーT細胞、免疫応答の成立を助けるヘルパーT細胞、さらに、免疫応答を抑制する制御性T細胞(regulatory T cell:Treg)に大きく分けられる。Tregは転写因子FoxP3を発現し、リンパ節を含むリンパ組織と、皮膚や腸管などの末梢組織にも存在し、膠原病などの免疫病の発症を阻止する。体が正常な状態の時も、自分の組織に対する免疫応答を抑え、免疫恒常性を維持する役割を果たす。 - 2.インスリン感受性、耐糖能
膵臓のβ細胞から分泌されるインスリンは、肝臓や筋肉に糖分を取り込ませることで血糖値を低下させる作用がある。糖分を摂取すると分泌されたインスリンの作用で、いったん上昇した血糖値は正常に戻る(耐糖能)。しかし、脂肪組織の炎症が慢性化すると、インスリンに対する反応性(インスリン感受性)が低下し、正常なインスリン量では血糖値が下がらなくなる。また、このような状態で糖分を摂取すると、上昇した血糖値は戻りにくくなり(耐糖能の低下)、高血糖が持続する。 - 3.インターロイキン-33(IL-33)受容体、IL-33
IL-33は、サイトカインと総称される生理活性を持つタンパク質の一種で、主に上皮細胞、内皮細胞、脂肪細胞によって作られる。IL-33は、その受容体に結合することでさまざまな細胞に作用する。Tregの場合には増殖を誘導するが、2型ヘルパーT細胞やグループ2型自然リンパ球に作用すると、サイトカイン産生を誘導することが知られる。IL-33受容体は、T1/ST2と呼ばれるIL-33の結合能を持つタンパク質と、IL-1R accessary protein (IL-1RAcp) と呼ばれるタンパク質の2量体からなる。IL-33が結合すると、細胞質内にさまざまなシグナルを伝達する。 - 4.2型糖尿病
糖尿病はインスリン作用の不足により、慢性的に高血糖が持続する病気で、治療を怠ると、さまざまな臓器が侵され合併症を引き起こす。糖尿病に特有の糖尿病網膜症、腎症、神経障害といった細小血管症に加え、全身の太い血管にも動脈硬化が進みやすくなり、心筋梗塞や脳梗塞を引き起こす。なかでも2型糖尿病は、インスリン分泌低下とインスリン抵抗性(インスリンの働きが悪くなること)が合わさることによって血糖値が上昇し糖尿病になるタイプ。発症には、遺伝因子(家系)と環境因子(過食、肥満、運動不足などの生活習慣)の両者が深く関わることが知られている。 - 5.NZOマウス
NZOはNew Zealand Obeseの略。突然変異によって生じた肥満を自然発症するマウス。肥満と共に耐糖能異常を示す。
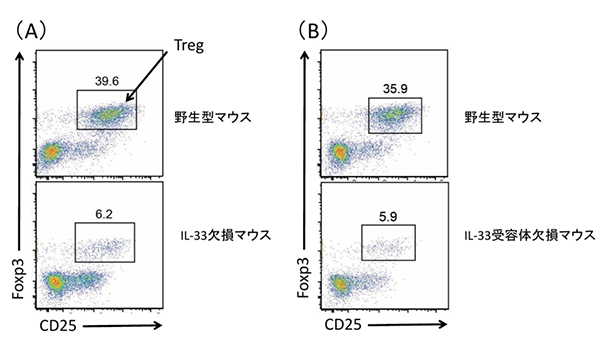
図1 IL-33、IL-33受容体欠損マウスの内臓脂肪組織内のTreg数
- (A) 野生型マウスとIL-33欠損マウスの内臓脂肪組織内のTreg数を、Tregの細胞マーカー分子であるCD25とFoxp3の発現を指標に調べた結果。
- (B)
野生型マウスとIL-33受容体欠損マウスの内臓脂肪組織内のTreg数を(A)と同様に調べ結果。
IL-33欠損マウスとIL-33受容体欠損マウスは、内臓脂肪組織にTregがほとんど存在しないことが分かる。
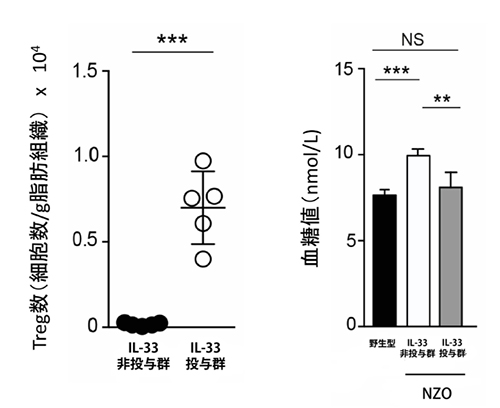
図2 IL-33によるTreg数と血糖値の制御
IL-33非投与群のNGOマウスは、内臓脂肪にTreg(左図)がほとんど存在せず、血糖値(右図)が野生型より上昇している。IL-33投与群では、Tregが増加し、血糖値が野生型と同程度まで改善する。
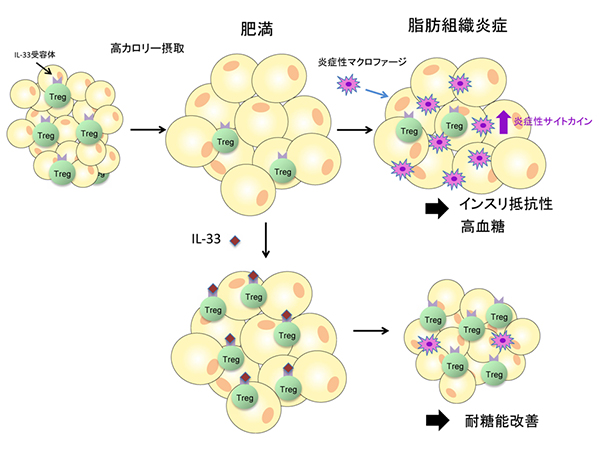
図3 脂肪組織の恒常性を司るIL-33とTreg
高カロリー摂取によって脂肪細胞は脂肪を蓄積し肥大化する。同時に炎症性マクロファージ(白血球の1種)が蓄積し、それに伴って炎症を抑える働きを持つTregが減少し、炎症が引き起こされる。脂肪組織内のTregにはIL-33受容体が発現しており、IL-33を与えることでTregが増加し、炎症を抑えて耐糖能異常が改善される。
