要旨
理化学研究所(理研)多細胞システム形成研究センター器官発生研究チームの桑原篤客員研究員、立体組織形成研究ユニットの永樂元次ユニットリーダーらと、住友化学生物環境科学研究所の共同研究グループ※は、ヒトES細胞(胚性幹細胞)[1]から、毛様体縁[2]幹細胞ニッチ[3]を含む立体網膜(複合網膜組織)[4]を作製することに成功しました。
毛様体縁は、胎児の網膜の端に存在する領域で、これまでに魚類や鳥類などで幹細胞を維持する特殊な構造(ニッチ)として働いていることが報告されていました。しかし、ヒトの毛様体縁の網膜発生における役割はほとんど明らかにされていませんでした。これを解明するには、ヒト毛様体縁を含む立体的な網膜を安定的に作製する新たな技術が有用です。
これまで理研の笹井芳樹博士を中心とした研究チームは、「SFEBq法(無血清凝集浮遊培養法)」という分化誘導法[5]を開発し、ES細胞やiPS細胞(人工多能性幹細胞)[1]から、複雑な神経組織を作製してきました。網膜についても、マウスES細胞やヒトES細胞から立体網膜を作製しています。今回、共同研究グループはSFEBq法をさらに改良して、新しい網膜分化誘導法の開発に挑みました。その結果、胎児型網膜とよく似た、毛様体縁を含む立体網膜を作製することに成功しました。そして、作製した立体網膜を詳しく解析したところ、ヒト毛様体縁には幹細胞が存在し、この幹細胞が増殖する機能を発揮することで、網膜を試験管内で成長させることが分かりました。
新しい分化誘導技術には、立体網膜を効率よく安定的に生産できる長所があります。現在、理研を中心としたグループは、この分化誘導技術を用いて生産した立体網膜を、網膜色素変性[6]を対象とした再生医療に応用するための研究を進めています。
本研究は、文部科学省の「再生医療実現拠点ネットワークプログラム」の一環として行い、成果は、英国のオンライン科学雑誌『Nature Communications』(2月19日付け:日本時間2月19日)に掲載されます。
※共同研究グループ
理化学研究所 多細胞システム形成研究センター 器官発生研究チーム
客員研究員 桑原 篤*,†(くわはら あつし)
リサーチ・アソシエイト 大曽根 親文(おおぞね ちかふみ)
客員研究員 中野 徳重*(なかの とくしげ)
*住友化学 生物環境科学研究所 細胞科学グループ (兼任)
†現所属:大日本住友製薬 再生・細胞医薬事業推進室
住友化学 生物環境科学研究所 細胞科学グループ
グループマネージャー 斎藤 幸一(さいとう こういち)
理化学研究所 多細胞システム形成研究センター 立体組織形成研究ユニット
ユニットリーダー 永樂 元次(えいらく もとつぐ)
理化学研究所 発生・再生科学総合研究センター 器官発生研究グループ
グループディレクター 笹井 芳樹(ささい よしき)
背景
ES細胞(胚性幹細胞)やiPS細胞(人工多能性幹細胞)などの多能性幹細胞[1]は、すべての種類の体細胞に分化する能力(多能性)を持ち、試験管内で医学的・産業的に有用な細胞や組織を産生するための供給源として注目されています。ES細胞やiPS細胞を目的とする細胞へと分化させる分化誘導法の開発は、激しい国際競争のなかで進められています。これまで理研の笹井芳樹博士を中心とした研究チームは、多能性幹細胞を効率よく分化できる「SFEBq法(無血清凝集浮遊培養法)」[5]を開発し、マウスやヒトのES細胞やiPS細胞から、大脳、視床下部、下垂体、小脳や網膜などの複雑な神経組織を試験管内で形成させることに成功してきました。SFEBq法の特徴は、細胞集団が自発的に秩序立った構造を作り上げる現象(自己組織化)を利用して試験管内で個体発生のプロセスを再現させ、細胞が整然と並んだ三次元組織を、安定的かつ再現性よく作り出せる点にあります。
ES細胞やiPS細胞から作製される網膜細胞は、医薬品など化学物質の薬効や安全性評価、さらに再生医療への応用が期待され、注目を集めています。共同研究グループは、網膜の作製法として、これまでマウスES細胞からの立体網膜の形成注1)、ヒトES細胞からの立体網膜の形成注2)を報告してきました。本研究では、この立体網膜の作製法を改良する目的で、以下の3つの課題に取り組みました。
- 1.選択的な網膜分化誘導法の開発
- 2.毛様体縁を持つ網膜組織の作製法の開発
- 3.毛様体縁を持つ網膜組織における細胞の動態評価
- 注1)2011年4月7日のプレスリリース「ES細胞から人工網膜組織の3次元形成に世界で初めて成功」
- 注2)2012年6月14日のプレスリリース「ヒトES細胞から立体網膜の形成に世界で初めて成功」
研究手法と成果
1)選択的な網膜分化誘導法の開発
従来のSFEBq法で網膜を作製する場合は、分化を促進するために、培養液中に動物由来の基底膜抽出物を添加していました。この基底膜抽出物は、マウス肉腫由来細胞の抽出物であり、さまざまな成分を含んでいるため品質保証が難しく、安定的に高い分化効率が求められる再生医療用途には不向きです。この点が、網膜組織を生産する上での課題の1つになっていました。
共同研究グループは、基底膜抽出物を使わずに効率よく網膜へと分化させることを目指して、SFEBq法の培養条件に新たに検討を加えました。その結果、分化培養の初期にBMP(骨形成因子)と呼ばれるシグナル作用物質を添加することで、ヒトES細胞から効率よく網膜組織へと分化誘導できることを発見し、これをBMP法[7]と名付けました(図1、図2)。BMP法は、基底膜抽出物を使った従来法と比べ、分化誘導効率が80%程度と高く(従来法では最高でも70%程度、 Nakano et al., Cell Stem Cell 2012)、選択的に網膜へと分化誘導できることが分かりました。さらに、従来法では分化誘導効率が不安定でしたが、BMP法の分化誘導効率は常に80%程度と安定していました。
2)毛様体縁を持つ網膜組織の作製法の開発
毛様体縁は、胎児期の網膜の端に存在する領域(図1)で、その役割は動物間で差があります。魚類や両生類、鳥類などを用いた研究では、毛様体縁は幹細胞を長期的に維持する特殊な構造(幹細胞ニッチ)であり、網膜の成長や再生に貢献することが知られていました。一方、ほ乳類の実験モデルとしてよく使われるマウスでは、胎児期の毛様体縁の役割は明確には分かっておらず、幹細胞が存在するかしないかについては発生生物学者の間でも意見が分かれていました。さらに、ヒトの毛様体縁は、実験に使用できるヒト組織の入手が困難であるため、網膜発生における役割がほとんど明らかになっていませんでした。毛様体縁の特性、特に幹細胞が存在するか否かを解明できれば、それぞれの動物の眼の形や大きさがどのように決まっているかの理解につながる可能性があります。そこで、共同研究グループは、ヒトES細胞を毛様体縁を持つ立体網膜へと、分化誘導することを目指しました。
毛様体縁は、胎児期の網膜(神経網膜)と網膜色素上皮(RPE)の境界領域に形成されます(図1)。そこで、まず神経網膜とRPEが共存する複合網膜組織の作製法を検討しました。これまでの研究により神経網膜の分化・維持にはFGFシグナルが、またRPEの分化・維持にはWntシグナルが重要な役割をしていることが分かっていました。共同研究グループは、ヒトES細胞からBMP法で作製した網膜組織を、まずFGFシグナルの阻害薬とWntシグナルの作動薬を含む培養液で培養してRPEへと分化させ、その後、再び神経網膜を誘導する条件で培養することにより神経網膜へと戻すことで、神経網膜とRPEが共存した複合網膜組織の形成に成功しました。この方法は、いったんRPEに運命転換[8]した細胞を、再び神経網膜へと運命転換させることから、“揺り戻し法[8]”と名付けました(図3)。
これまでの方法では、神経網膜のみ、または、RPEのみを作ることはできていました。しかし、神経網膜とRPEが共存する複合網膜組織を、効率よく安定的に作るのは困難でした。本研究で開発した揺り戻し法では、神経網膜とRPEの間を行ったり来たりさせ、細胞集団の運命を揺さぶることで、複合網膜組織を安定して40%程度の効率で作製できるようになりました。
揺り戻し法により作製した複合網膜組織は、60日目まで培養を続けると、神経網膜とRPEがそれぞれ成長し、野菜のカブとよく似た形態になりました(カブラ型網膜とも呼ぶ)。この複合網膜組織を解析したところ、神経網膜とRPEの境界領域に胎児の毛様体縁によく似た特徴を持つ組織が形成されました(図4)。このことは、ヒトES細胞から神経網膜とRPEを同時に誘導することで、自己組織化により、両者の境界領域に毛様体縁が形成されることを示唆しています。
この毛様体縁を含む複合網膜組織は、90日目まで培養を続けると、幼若な視細胞前駆細胞を豊富に含むことが確認されました(図5)。さらに、150日目まで培養を続けると、分化の進んだ視細胞が産生されました。また、この複合網膜組織では、従来法に比べ、胎児網膜とよく似た規則的な立体構造(連続上皮構造)が、高い頻度で含まれることが分かりました。
3)毛様体縁を持つ網膜組織における細胞の動態
次に、毛様体縁を含む立体網膜の性質を詳細に検討しました。まず、網膜幹細胞の数を調べたところ、毛様体縁に幹細胞が豊富に含まれることが分かりました(図6)。また、毛様体縁に含まれる幹細胞は、光を受ける視細胞や、脳に視覚情報を伝える神経節細胞への分化能を持つことも確認しました。さらに、細胞を核酸アナログでラベルして動態を解析した結果、毛様体縁の細胞は活発に増殖し、毛様体縁の近くで立体網膜を成長させる細胞が供給されることを発見しました。これらの結果から、毛様体縁が幹細胞ニッチとして機能することが、立体網膜が試験管内で成長する上で重要であることが分かりました(図7)。
今後の期待
本研究では、選択的で安定性の高い網膜分化誘導法を確立しました。また、揺り戻し法により、毛様体縁を含む複合網膜組織の作製に成功しました。さらに、毛様体縁が幹細胞ニッチとして機能することで、立体網膜が試験管内で大きく成長することが分かりました(図7)。これまで、ヒトの網膜がどのようにして成長するかは大きな謎でしたが、本研究により、網膜の端に存在する毛様体縁が、幹細胞ニッチとして機能することにより、ヒトの網膜を試験管内で成長させるのに貢献することが明らかになりました。
幹細胞ニッチ形成のメカニズムは、よく分かっていませんでしたが、今回、新たに試験管内で幹細胞ニッチを形成する培養系が確立できました。今後この培養系を用いることで、幹細胞性、すなわち幹細胞を幹細胞たらしめる分子機構の解明に迫れるのではないかと考えています。
ヒト立体網膜を用いた再生医療を広く普及させるための大きな課題の1つとして安定生産が難しいという課題がありましたが、本研究により、安定生産に適した分化誘導技術を確立できました。この技術の長所は、(1)分化誘導効率が安定的に高い点、(2)複合網膜組織は品質のバラツキが小さい点(網膜の形状、神経網膜とRPEの比率)、(3)複合網膜組織の毛様体縁付近は、胎児網膜と良く似た規則的な立体構造(連続上皮構造)をとる点、が挙げられます。こうした特性を持つ複合網膜組織は、研究開発用途で有用です。
現在、再生医療応用に向け、理研多細胞システム形成研究センター網膜再生医療研究開発プロジェクトの高橋政代プロジェクトリーダーらは、住友化学のグループ会社である大日本住友製薬との共同で、本研究成果をヒトiPS細胞に適用して、網膜色素変性を対象とした再生医療の実現に向けた研究開発を進めています。
原論文情報
- Atsushi Kuwahara*, Chikafumi Ozone*, Tokushige Nakano*, Koichi Saito, Mototsugu Eiraku & Yoshiki Sasai, "Generation of a ciliary margin-like stem cell niche from self-organizing human retinal tissue", Nature Communications, doi: 10.1038/ncomms7286
*Contributed equally
発表者
理化学研究所
多細胞システム形成研究センター 器官発生研究チーム
客員研究員 桑原 篤(くわはら あつし)
(住友化学株式会社 主任研究員)
(現所属:大日本住友製薬株式会社 再生・細胞医薬事業推進室)
多細胞システム形成研究センター 立体組織形成研究ユニット
ユニットリーダー 永樂 元次(えいらく もとつぐ)
理化学研究所 多細胞システム形成研究推進室 広報担当
Tel: 078-306-3092 / Fax: 078-306-3090
cdb-pr [at] cdb.riken.jp(※[at]は@に置き換えてください。)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
住友化学株式会社 コーポレートコミュニケーション室(広報)
Tel: 03-5543-5102 / Fax: 03-5543-5901
sumika-kouhou [at] ya.sumitomo-chem.co.jp(※[at]は@に置き換えてください。)
補足説明
- 1.ES細胞(胚性幹細胞)、iPS細胞(人工多能性幹細胞)、多能性幹細胞
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。iPS細胞は、体細胞を初期化することで樹立された多能性幹細胞を指す。ES細胞やiPS細胞は多能性を有しているため、体のさまざまな細胞に分化する能力があり、再生医療の材料や、医薬品など化学物質の薬効・安全性評価への利用が期待されている。 - 2.毛様体縁
胎児期の網膜と網膜色素上皮の境界に存在する構造体。毛様体縁の役割には動物間での種差があることが報告されており、ヒトの毛様体縁の網膜発生における役割については、ほとんど明らかにされていない。 - 3.幹細胞ニッチ
幹細胞を長期間(例えば、一生涯)維持できる特別な微小環境のこと。骨髄に存在する造血幹細胞ニッチ、毛包に存在する毛包幹細胞ニッチ、腸管上皮陰窩に存在する腸上皮幹細胞ニッチなどが知られている。 - 4.立体網膜、複合網膜組織
網膜組織は光を受容して電気シグナルに変換し、さらに情報処理後に脳の視覚中枢へ軸索を介して情報を伝える重要な感覚組織。大きく内外2つの上皮組織が重なってできている。内側は、光を受容し情報処理を行なう神経網膜(本稿では網膜とも呼ぶ)で、視細胞などの複数種類の細胞を含む。外側は、視細胞の生存と機能をサポートする1層の細胞シートである網膜色素上皮(RPE)からなる。立体網膜とは、試験管内で作製した胎児網膜とよく似た層構造を持つ網膜組織のこと。複合網膜組織とは、神経網膜とRPEが共存する立体網膜のこと。 - 5.SFEBq法(無血清凝集浮遊培養法)、分化誘導法
多能性幹細胞から特定の細胞を作る方法のことを分化誘導法という。試験管内で適切な刺激を加えることで、細胞に備わる分化プログラムが働き、特定の細胞種(神経細胞、肝細胞、心筋細胞、網膜細胞など)へと分化させることができる。理研の笹井芳樹博士を中心とした研究チームは2008年、SFEBq法(無血清凝集浮遊培養法)という分化誘導法を開発した。SFEBq法では、血清や転写因子などの神経分化阻害効果のある成分を一切含まない特殊な培養液に、多能性幹細胞を浮遊させて数日培養する。この方法により、90%以上の細胞を中枢神経系の細胞に分化させることができる。SFEBq法の特徴は、細胞集団が自発的に秩序だった構造を作り上げる現象(自己組織化)を利用することにより、試験管内で個体発生のプロセスを再現させ、細胞が整然と並んだ三次元組織を、安定的に再現性よく作り出せる点にある。 - 6.網膜色素変性
「網膜変性」は、網膜組織を構成する特定の種類の細胞が加齢や遺伝的原因などで変性して起こる疾患で、強度の視力障害に至る重篤なものである。代表的なものの1つに、遺伝子の異常が原因で、視細胞が変性して起こる「網膜色素変性」がある。視細胞の変性・脱落は、数十年以上かけてゆっくり起こることが多いが、暗いところで光を感知する桿体(かんたい)細胞が優先的に変性する。初期には夜盲症(夜に物が見えない)で始まる。次第に、見える視野が狭まってゆき、やがて失明に至ることも多い。網膜色素変性を起こす遺伝子異常は複数発見されており、遺伝子診断も一部可能だが、治療法や予防法は現在存在していない。 - 7.BMP法
基底膜抽出物を使わずに効率よく網膜分化させるため、SFEBq法の培養条件に新たに検討を加えた。その結果、分化培養の初期にBMP(骨形成因子)シグナル作用物質を添加することで、ヒトES細胞から効率よく網膜組織を作製できることが分かった(BMP法)。しかし、そのメカニズムは分かっていない。このSFEBq法の培養系では、BMPを添加しない条件では大脳(終脳)へと選択的に分化する。発生生物学の研究からBMPシグナルには大脳分化を抑制する活性があることが示唆されているため、BMP法ではBMPが大脳分化を抑制した結果、網膜になっているのではないかと考えている。 - 8.運命転換、揺り戻し法
運命転換とは、異なる分化系譜の細胞へと、分化状態を転換すること。最終分化した細胞の運命転換のことを、特に分化転換という場合がある。例えば、繊維芽細胞はMyoD遺伝子を導入するだけで、筋肉の細胞へと運命転換することが知られている。また、細胞のリプログラミングも運命転換の一種と考えることもできる。胎児期の網膜は、これまでの研究から、網膜(神経網膜)と網膜色素上皮(RPE)の間で互いに運命転換しやすい性質を持つことが報告されていた。遺伝子の導入などの操作により、網膜からRPEへの運命転換や、逆にRPEから網膜への運命転換が起きることが分かっていた。このような発生生物学の知見を活かし、本研究では、試験管内で網膜からRPEへの運命転換と、続いてRPEから網膜への運命転換を起こすことで、網膜とRPEが共存する新型網膜を安定的に作ることに成功した。共同研究グループはこの分化誘導法を「揺り戻し法」と名付けた。揺り戻し法は、組織と組織の境界に存在する中間領域を、高効率で分化誘導する方法として一般化できる可能性がある。
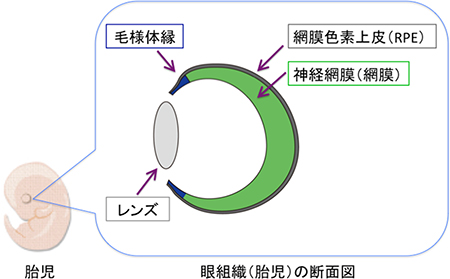
図1 胎児期の網膜における毛様体縁
緑:神経網膜(網膜)、灰:網膜色素上皮(RPE)、青:毛様体縁。
毛様体縁は、神経網膜とRPEの境界領域に存在する。ヒトの毛様体縁の役割は、ほとんど分かっていなかった。
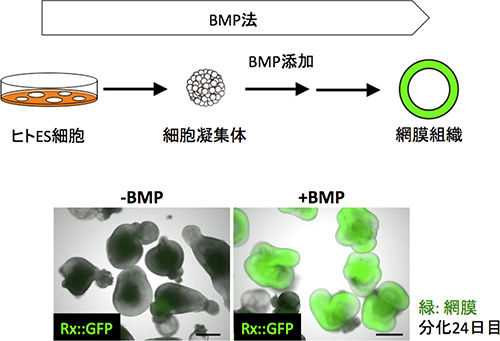
図2 開発した選択的な網膜分化誘導法(BMP法)
- 上段:BMP法による網膜分化の概略図。
- 下段:対照群(BMP非存在下、左)、BMP存在下(右)で培養した細胞凝集体。それぞれの画像は、網膜マーカー(Rx)の蛍光像(緑色)と明視野像(白黒)を重ねてある。ヒトES細胞を培養皿から剥がして、SFEBq法により細胞凝集体を形成させた後、培養液中にBMP-4を添加すると、18日後から24日後に胎児型の網膜組織が形成された(スケールバー: 500μm)。
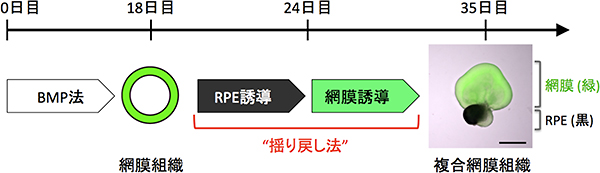
図3 神経網膜とRPEが共存する凝集体の製造法(揺り戻し法)
ヒトES細胞からBMP法で作製した網膜組織を、いったんRPEへと分化させた後に(RPE誘導)、再び神経網膜へと運命転換させることで(網膜誘導)、神経網膜とRPEが共存した複合網膜組織を形成できた。この方法は、網膜組織をRPEと神経網膜の間で行ったり来たりさせ、細胞集団の運命を揺さぶることを特徴とし、“揺り戻し法”と呼ぶ。(写真:緑が神経網膜[Rx:GFP]、黒がRPE。スケールバー: 500μm)。
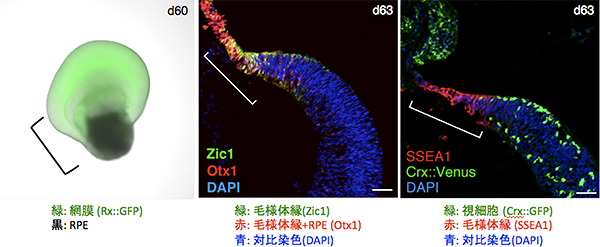
図4 揺り戻し法で作製した複合網膜組織の毛様体縁
揺り戻し法により作製した複合網膜組織は、蕪(かぶら)によく似た特徴的な外見をもち(左、分化60日目)、自己組織化により神経網膜とRPEの境界領域に毛様体縁が形成されることが分かった(中・右、分化63日目)。
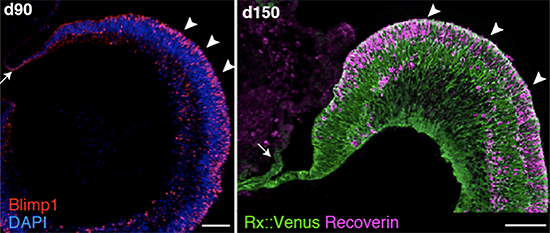
図5 複合網膜組織に含まれる視細胞
左は毛様体縁を含む複合網膜組織を90日間培養した画像。視細胞前駆細胞(赤、Blimp1)を豊富に含んでいる。右は150日間培養した画像で、より成熟した視細胞(紫、Recoverin)へと分化している。この複合網膜組織には、従来法に比べ、胎児網膜とよく似た規則的な立体構造(連続上皮構造)が、高い頻度で含まれる。
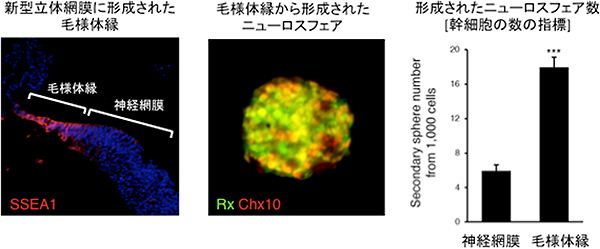
図6 毛様体縁に存在する幹細胞
毛様体縁に幹細胞が含まれるか否かを、ニューロスフェア法により調べた。すると、毛様体縁からは効率よくニューロスフェア(球状の細胞塊)が形成された。すなわち、毛様体縁には神経網膜と比べて、幹細胞が豊富に含まれることが示唆された。
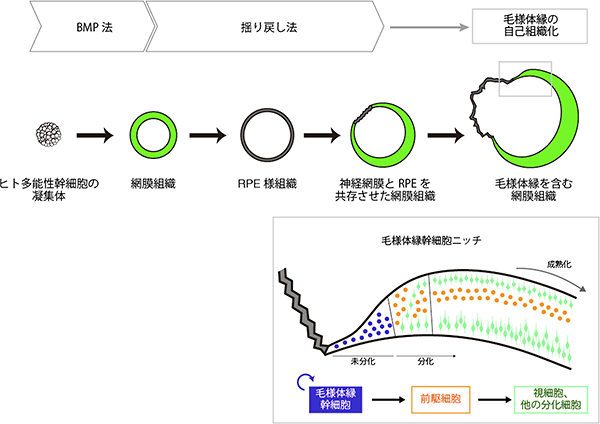
図7 研究成果のまとめ
本研究では、BMP法という、ヒトES細胞から網膜組織への安定的な分化誘導法を開発した。次に、揺り戻し法という、網膜組織を出発材料として、神経網膜とRPEを共存させた複合網膜組織を形成させる手法を確立した。この複合網膜組織では、自己組織化により、毛様体縁が形成されることを見いだした。形成された複合網膜組織では、毛様体縁が幹細胞ニッチとして機能して、網膜の成長に貢献することが分かった。
