2015年4月9日
理化学研究所
東京大学
糖・脂質代謝に重要なアディポネクチン受容体の立体構造を解明
-メタボリックシンドローム・糖尿病の治療薬の開発へ前進-
要旨
理化学研究所(理研)横山構造生物学研究室の横山茂之上席研究員と、東京大学大学院医学系研究科の門脇孝教授、山内敏正准教授らの共同研究グループ※は、メタボリックシンドローム(内臓性脂肪症候群)の「鍵」分子であるアディポネクチン受容体[1]の立体構造の解明に成功しました。
細胞膜に存在する膜タンパク質は、細胞外からのシグナル(情報)を細胞内へと伝達する重要な役割を担い、創薬の標的として注目されています。アディポネクチン受容体(AdipoR1、AdipoR2)は、メタボリックシンドロームの「鍵」分子として注目されている膜タンパク質です。アディポネクチン受容体は、脂肪細胞から分泌されるホルモンであるアディポネクチン[2]により活性化され、細胞内において、糖と脂質の代謝を促進し、抗糖尿病、抗メタボリックシンドローム作用を発揮します。しかし、アディポネクチン受容体は、試料調製の困難さからその立体構造情報が得られていませんでした。
共同研究グループは、大型放射光施設「SPring-8[3]」を用いたX線結晶構造解析により、アディポネクチン受容体の立体構造の解明に成功しました。その構造から現在までに知られている膜タンパク質の構造とは異なる、新規の構造をしていることが分かりました。この結果は、アディポネクチン受容体の情報伝達メカニズムの解明につながるだけでなく、メタボリックシンドローム・糖尿病の予防薬や治療薬の開発に有益な情報となることが期待できます。
本研究は、文部科学省ターゲットタンパク研究プログラム、創薬等支援技術基盤プラットフォーム事業、橋渡し研究加速ネットワークプログラム、科学研究費助成事業などの支援を受けて行われました。成果は英国の科学雑誌『Nature』に掲載されるのに先立ち、オンライン版(4月8日付け:日本時間4月9日)に掲載されます。
背景
タンパク質の立体構造を知ることは、薬の設計に有用な情報を得ることにつながります。特に細胞膜に存在する膜タンパク質は、細胞外からのシグナル(情報)を細胞内へと伝達する重要な役割を担っているため、薬の標的分子として注目されています。現在使用されている薬の約50%は、Gタンパク質共役受容体(GPCR)[4]という7回膜貫通型(細胞膜を7回貫通する構造)の膜タンパク質群を標的にしています。
日本では、高脂肪食や運動不足といった生活環境の変化により肥満者が増加しています。肥満はメタボリックシンドローム(内臓性脂肪症候群)や糖尿病を引き起こす原因になっていると考えられています。日本のメタボリックシンドロームの該当者・予備群は推計で約2,000万人と言われています注)。
2003年に東京大学の門脇孝教授らのグループにより発見された膜タンパク質「アディポネクチン受容体(AdipoR1、AdipoR2)」は、メタボリックシンドロームの「鍵」となる分子です。脂肪細胞から分泌されるホルモンであるアディポネクチンのシグナル(情報)を、細胞内に伝える機能を担っています。そのシグナルが細胞内に伝えられると、細胞内で糖や脂質の代謝が促進され、抗糖尿病、抗メタボリックシンドローム作用が発揮されます。また、アディポネクチン受容体のホモログ(相同体)は酵母からヒトまで広く保存されており、生物全般にとって重要なタンパク質と言えます。
アディポネクチン受容体の構造は、7回膜貫通型でありながらGPCRとは全く異なるファミリー(共通の祖先を持つタンパク質の集まり)に属し、膜に対する配向性が正反対(タンパク質を構成するアミノ酸の末端が、GPCRでは細胞外であるのに対し、アディポネクチン受容体では細胞内)と推定されていました。また2013年には、門脇教授らにより、アディポネクチンの代わりにアディポネクチン受容体を活性化する低分子化合物が発見され、今後の創薬開発に大きな期待が寄せられているところです。ヒトのアディポネクチン受容体の立体構造や情報伝達機構を解明することは、メタボリックシンドロームの予防薬や治療薬の開発に有益な情報となります。しかし、試料調製の困難さから、立体構造は解明されていませんでした。
注)厚生労働省ホームページ:メタボリックシンドローム該当者・予備群の状況
研究手法と成果
共同研究グループは、従来は困難だった、高純度かつ大量に膜タンパク質を安定に調製する手法や脂質メソフェーズ結晶化手法[5]など、さまざまな技術開発注)を進めることで、ヒトアディポネクチン受容体(AdipoR1、AdipoR2)の調製と結晶化に成功しました。そして、大型放射光施設「SPring-8」のマイクロフォーカスビームを用い、結晶のX線回折データを収集して、AdipoR1とAdipoR2の立体構造をそれぞれ2.9Å(オングストローム:1Åは10-10m)、2.4Åの分解能で解明しました(図1)。
今回の解析で、アディポネクチン受容体AdipoR1とAdipoR2は、推定されていた通り7回膜貫通型の構造をしていることが確認され、この2つの構造は非常に類似性が高いことが分かりました。また、解明した構造と既知の7回膜貫通型膜タンパク質であるGPCRの構造を比較したところ、重ね合わせることができず、アディポネクチン受容体は、現在までに知られている膜タンパク質の構造とは異なる新しい立体構造であることが分かりました(図2)。特にAdipoR1/AdipoR2の膜貫通部位の螺旋構造(αヘリックス)は、GPCRに特徴的な曲がりがなく、異なる働き方をすると考えられました。
AdipoR1/AdipoR2の膜貫通部位では、7本のαヘリックスに取り囲まれた空間が細胞膜から細胞内へと続く空洞となり、その中に、1つの亜鉛イオンを結合していました(図3)。現在まで、受容体タンパク質で、膜貫通部位に亜鉛を結合したものは知られていません。
この空洞の中には、亜鉛イオンの近くに、未同定の物質が含まれていることも分かりました(図4)。
さらに、構造解析によって明らかになった亜鉛イオンと相互作用するアミノ酸残基は、アディポネクチン受容体の活性に重要であることを確認しました。亜鉛イオンは、アディポネクチン受容体の立体構造を内側から支える可能性が考えられます。
以上の発見から、アディポネクチン受容体は、多数の新規の構造的特徴を有する受容体であることが明らかになりました。
注)Tanabe, H. et al. “Expression, purification, crystallization, and preliminary X-ray crystallographic studies of the human adiponectin receptors, AdipoR1 and AdipoR2”, Journal of Structural Functional Genomics. 16(1), 11-23 (2015)
今後の期待
全く新規の構造を持つ膜タンパク質、アディポネクチン受容体の立体構造情報は、アディポネクチン受容体の作用メカニズムの解明に重要な基礎となると考えられます。また、この立体構造情報に基づいた、メタボリックシンドローム・糖尿病の予防薬や治療薬の研究・開発が進展すると期待できます。
※共同研究グループ
理化学研究所 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
特別技術員 田辺 弘明(たなべ ひろあき)*兼務
研究員 藤井 佳史(ふじい よしふみ)
研究員 中村 祥浩(なかむら よしひろ)*兼務
研究員 寺田 貴帆(てらだ たかほ)
ライフサイエンス技術基盤研究センター 構造・合成生物学部門
部門長 白水 美香子(しろうず みかこ)
構造生物学グループ タンパク質機能・構造研究チーム
リサーチアソシエイト 田辺 弘明(たなべ ひろあき)
上級研究員 染谷 友美(そめや ともみ)
上級研究員 羽藤 正勝(はとう まさかつ)
研究員 大沢 登(おおさわ のぼる)
研究員 中村 祥浩(なかむら よしひろ)
研究員 保坂 俊彰(ほさか としあき)
技師 池田 眞理子(いけだ まりこ)
構造生物学グループ転写後制御研究ユニット
ユニットリーダー 脇山 素明(わきやま もとあき)
放射光科学総合研究センター 利用システム開発研究部門
部門長 山本 雅貴(やまもと まさき)
ビームライン基盤研究部 生命系放射光利用システム開発ユニット
専任技師 河野 能顕(かわの よしあき)
専任技師 平田 邦生(ひらた くにお)
東京大学医学部附属病院 糖尿病・代謝内科/22世紀医療センター
教授 門脇 孝 (かどわき たかし)
准教授 山内 敏正(やまうち としまさ)
特任助教 岩部 美紀(いわぶ みき)
特任助教・さきがけ研究員(兼任) 岩部 真人 (いわぶ まさと)
京都大学 医学研究科
教授 岩田 想(いわた そう)
助教 村田 武士(むらた たけし)
研究員 小笠原 諭(おがさわら さとし)
研究員 日野 智也(ひの ともや)
原論文情報
- Hiroaki Tanabe, Yoshifumi Fujii, Miki Okada-Iwabu, Masato Iwabu, Yoshihiro Nakamura, Toshiaki Hosaka, Kanna Motoyama, Mariko Ikeda, Motoaki Wakiyama, Takaho Terada, Noboru Ohsawa, Masakatsu Hato, Satoshi Ogasawara, Tomoya Hino, Takeshi Murata, So Iwata, Kunio Hirata, Yoshiaki Kawano, Masaki Yamamoto, Tomomi Kimura-Someya, Mikako Shirouzu, Toshimasa Yamauchi, Takashi Kadowaki, and Shigeyuki Yokoyama, "Crystal structures of the human adiponectin receptors", Nature, doi: 10.1038/nature14301
発表者
理化学研究所
上席研究員研究室 横山構造生物学研究室
上席研究員 横山 茂之(よこやま しげゆき)
東京大学医学部附属病院 糖尿病・代謝内科
教授 門脇 孝(かどわき たかし)
准教授 山内 敏正(やまうち としまさ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
東京大学医学部附属病院 パブリック・リレーションセンター
Tel: 03-5800-9188
pr[at]adm.h.u-tokyo.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.アディポネクチン受容体
アディポネクチンのシグナルを細胞内へ伝える分子。アディポネクチン受容体には、AdipoR1、AdipoR2が存在し、それぞれ骨格筋、肝臓などに多く発現している。 - 2.アディポネクチン
脂肪細胞から分泌されるホルモン。抗糖尿病作用、抗動脈硬化作用、抗炎症作用を併せ持つ分子。肥満では、その血中濃度が低下し、生活習慣病の一因になっている。 - 3.SPring-8
兵庫県佐用郡の播磨科学公園都市にある世界最高性能を有する大型放射光施設。
SPring-8 Web Site - 4.Gタンパク質共役受容体
ホルモン、神経伝達物質、光や匂いなどのセンサーとして働き、細胞外からの情報を受け取り、細胞内へ伝達する。7回膜貫通型の膜タンパク質である。 - 5.脂質メソフェーズ結晶化手法
人工脂質二重膜中で膜タンパク質の結晶化を行う新しい技術。生体外で不安定な膜タンパク質の結晶化に適している。理研では、膜タンパク質などの結晶化の難しいタンパク質を対象に、ターゲットタンパク研究プログラムや創薬等支援技術基盤プラットフォーム事業などにおいて開発を進めてきた。
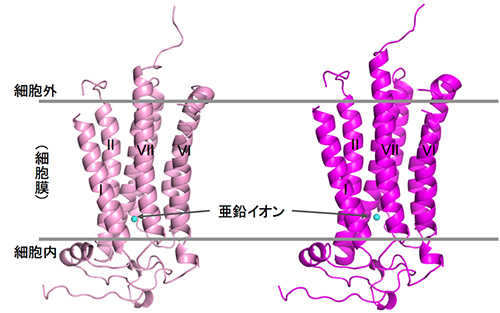
図1 アディポネクチン受容体の立体構造
X線結晶構造解析で決定したAdipoR1(左)およびAdipoR2(右)の立体構造。亜鉛イオン(シアン色の球)が7本の螺旋構造に囲まれている。
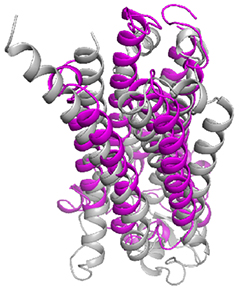
図2 アディポネクチン受容体とGPCRの立体構造比較
AdipoR2(マゼンタ)とGPCR(灰色)の構造比較図。
7本の螺旋構造(αヘリックス)の曲がりが異なるため、重ならないことが分かる。
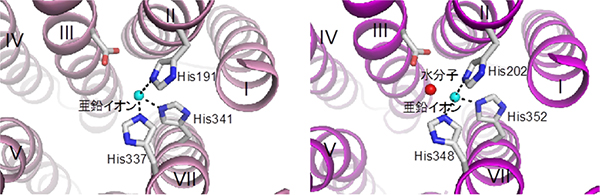
図3 アディポネクチン受容体の亜鉛イオン結合部位
AdipoR1(左)とAdipoR2(右)の亜鉛イオン結合部位。亜鉛イオン(シアン色の球)が、3つのヒスチジン(His)残基により固定されていることが分かる。マゼンタ色の球は、水分子。
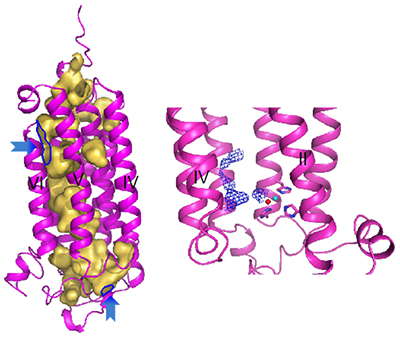
図4 アディポネクチン受容体に存在する空洞
- 左: アディポネクチン受容体には膜貫通部位と細胞内をつなぐ空洞が存在する。空洞を黄色で示す。青矢印は空洞の出入り口。
- 右: 空洞中に未同定の物質(青色メッシュ)が存在する。
