2015年4月22日
理化学研究所
(株)オーガンテクノロジーズ
慶應義塾大学医学部
摘出臓器の生体外長期保存・機能蘇生技術を開発
-従来移植不適用な阻血状態ドナー臓器の利用拡大へ-
要旨
理化学研究所(理研)多細胞システム形成研究センター器官誘導研究チームの辻孝チームリーダー、株式会社オーガンテクノロジーズの手塚克成研究開発部長、慶應義塾大学医学部の小林英司特任教授らの共同研究グループ※は、生体外においてラットから摘出した臓器の長期保存と臓器の機能を蘇生する技術を開発しました。
機能不全に陥った臓器の抜本的な治療として臓器移植治療が行われています。現在の臓器移植では、ドナー臓器を臓器保存液に浸して低温で保存する方法が一般的です。しかし、低温保存によって臓器の鮮度を保てる時間は限られています。世界的なドナー臓器不足のため、心停止ドナーからの臓器の利用拡大が求められており、なかでも長時間の阻血(そけつ)[1]状態で移植不適応になったドナー臓器を蘇生し、臓器移植への利用を可能にする技術の開発に期待が寄せられています。
共同研究グループは、生体の血液循環を再現できる臓器灌流(かんりゅう)培養システム[2]を開発しました。このシステムを利用して、ラットから摘出した肝臓を、22℃の温度域で、酸素運搬体として赤血球を添加した培養液を用いて灌流培養した結果、48時間にわたって肝障害を抑制できました。
また、摘出した肝臓を24時間灌流培養した後にレシピエント(臓器提供を受ける動物)であるラットに移植したところ生存率は100%となり、低温保存による肝臓を移植した場合の生存率と比較して飛躍的に向上しました。さらに、機能不全となった臓器の蘇生にも成功しました。臓器内のATP(アデノシン三リン酸)[3]量を可視化できるラット肝臓を使って、90分間の温阻血(心停止)[1]により移植が不適応となった肝臓を、本システムで灌流培養した後にレシピエントに移植しました。その結果、レシピエントを生存させることができたことから、機能不全の臓器の蘇生を確認しました。
今回の研究成果を進展させることで、現在の移植医療の課題を解決し、そのレベルをさらに向上できる可能性を示しました。また、未来の再生医療である再生臓器育成機器の開発にもつながると期待できます。
本研究成果は英国のオンライン科学雑誌『Scientific Reports』へ近日中に掲載されます。
※共同研究グループ
理化学研究所 多細胞システム形成研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)(東京理科大学 総合研究機構 客員教授)
株式会社オーガンテクノロジーズ
研究開発部長 手塚 克成(てづか かつなり)
慶應義塾大学医学部
特任教授 小林 英司(こばやし えいじ)
背景
肝臓や腎臓、心臓など、体内の臓器が事故や疾患によって機能不全に陥ると生命維持に大きな影響を及ぼします。代表的な臓器の疾患としては、肝硬変などの重度の肝疾患や、慢性腎不全などがあり、これら疾患に対しては臓器移植治療以外に根治可能な治療法がありません。臓器移植を希望している患者は、現在、わが国で約14,000人以上に達し、移植を受けられるときを待ち続けています(日本臓器移植ネットワーク2014年報告)。しかし、これまでの国内における臓器移植の実施数は待機患者全体の15%程度に留まっており、多くの患者は臓器移植を受けることができないのが実情です(図1)。
国際的な課題である慢性的なドナー不足に対応すべく、海外ではドナー数の増加を目指して、これまで移植に用いることは不可能とされてきた心停止ドナーの利用を推進しています。例えば米国では、心停止ドナー数は脳死ドナー数と比べて4倍以上であり、ドナー不足を大きく改善できると考えられています(OPTN & SRTR Annual Data Report 2012)。一方で、心停止ドナーの臓器は、移植に適した状態であるものは少なく、臓器状態の悪化から廃棄される割合は、脳死ドナーの9%に対して48%に上っており、心停止ドナーの利用が進まない原因となっています(図2)。
わが国では、心停止ドナーの臓器移植に関して厳しい制限を設けた上で、肝臓や腎臓、角膜など一部の臓器や組織に対してのみ移植利用が認められています。共同研究グループは、現在の臓器移植治療の課題である、ドナー臓器の安定した長期保存と、移植不適応となった心停止ドナーの臓器を蘇生し、安全に臓器移植への利用を可能とする臓器灌流(かんりゅう)培養システムの開発を目指しました。また、再生医療の到達点とも考えられている再生臓器の育成につなぐことができる技術開発を視野に入れて開発を進めました。
研究手法と成果
生体内において立体的な臓器は、血管網を通して絶えず血液の供給を受けており、ガス交換や栄養分の補給、不要物の排泄などにより、恒常性が維持されています。私たちはこの血液の循環による立体臓器維持に着目し、それを再現することによって、臓器の維持、蘇生が可能であると考えました。そこで、臓器の血管を介して培養液を灌流させる臓器灌流培養システムを開発しました(図3)。
実験では、まずラットから摘出した肝臓を、本システムで培養し、一定時間、灌流培養した臓器を生体へ移植することによって、本システムが臓器移植治療に応用可能であるかどうかを検証しました。
さらに90分間の温阻血(心停止)を行ったラットから機能不全となった肝臓を摘出し、臓器灌流培養システムで灌流することによって移植可能な臓器へと蘇生できるかを検証しました。
1)温度制御と酸素運搬体の添加による灌流培養条件の決定
まず培養液中の臓器の保存条件を設定するため、酸素運搬と保存温度の最適化を行いました。酸素運搬体としてヒトの赤血球を添加し、保存温度を22℃以下に設定することで、臓器障害を顕著に抑制できることが明らかになりました(図4)。この条件下において48時間灌流培養した肝臓は、生体から摘出したばかりの肝臓と同じ組織構造を維持しており、尿素合成能を有していました。さらに、システムでの灌流時に、胆汁やアルブミンの合成も認められ、肝臓機能が維持されていることが示されました。
2)常温環境下における細胞活動の制御
適切な培養温度を探るために、肝臓の培養細胞を用いて、1)で行った温度下において培養した細胞の機能を解析しました。37℃、33℃の温度で培養した細胞は、正常に増殖するのに対して、22℃、10℃、4℃の温度で培養した細胞は、増殖がほぼ完全に停止しました(図5左)。さらに22℃、10℃、4℃の温度で48時間培養した細胞を37℃に復温すると、10℃、4℃で培養した細胞は徐々に細胞が死滅していくのに対して、22℃で培養した細胞は速やかに増殖を回復したことから、22℃の培養温度は、細胞をあたかも「休眠」させたような状態にすることが判明しました(図5右)。
細胞内の代謝についても解析したところ、温度低下に依存して細胞内代謝が減少するものの、22℃の温度域では10℃以下の培養条件と比較して、優位にエネルギー代謝が行われていました。これらの結果から、ドナー臓器の生体外保存には22℃が適切であることが示されました。
3)灌流培養システムの臓器保存への応用
開発した灌流培養システムを用いて、培養液に赤血球を添加したラット肝臓と、赤血球非添加のラット肝臓をそれぞれ22℃の培養温度で24時間保存しました。その後、それぞれの肝臓を他のラット(レシピエント:臓器提供を受ける動物)へ異所的に移植[4]し、一般的に用いられる臓器保存液を用いた低温保存後のラット肝臓を移植したレシピエントと比較しました。その結果、臓器保存液を用いた低温保存後の肝臓(移植数=5)と灌流培養システム(赤血球非添加条件)で培養した肝臓(移植数=7)を移植したレシピエントは、移植後、すぐに生存率が低下しました。一方、灌流培養システム(赤血球添加条件)で培養した肝臓(移植数=9)を移植したレシピエントの生存率は100%でした。
次に、移植した肝臓の再生能を調べるためにレシピエント本来の肝臓を移植後7日目に70%部分切除することによって、移植した肝臓への血流を増加させて再生を誘導する実験を行いました。この実験では、臓器保存液を用いた低温保存後の肝臓と灌流培養システム(赤血球非添加条件)で培養した肝臓を移植したレシピエントは、部分切除後、移植肝臓が正常な大きさまで再生せず、さらに生存率が低下しました。一方、灌流培養システム(赤血球添加条件)で培養した肝臓を移植したレシピエントの部分切除後の生存率は100%でした(図6右)。このマウスの移植肝臓は、正常な大きさまで再生した(図6左)ことから、再生能を維持している機能的な肝臓であることが明らかとなりました。さらにこの移植肝臓は、アルブミンの合成能や糖代謝酵素も正常な肝臓と同等に維持されており、生体内で正常に機能することも確認しました。
4)心停止ドナーの肝臓の蘇生への応用
次に、灌流培養システムで、移植不可能な程度まで障害を受けた心停止ドナーの肝臓を蘇生できるか検証しました。この実験には慶應義塾大学医学部の小林英司特任教授らが開発した臓器内のATP(アデノシン三リン酸)量を可視化できるルシフェラーゼ遺伝子改変ラットを使用しました。心停止により臓器は阻血状態となり、含有するATPが枯渇するため、重度の肝障害が起こると考えられています。90分間の心停止による深刻な温阻血によって重度の肝障害を受けたラット肝臓を、22℃の培養温度で赤血球を添加しながら100分間の灌流培養を行い、評価しました。肝臓内のATPを測定した結果、温阻血した肝臓は著しくATP量が減少するものの、100分間の灌流培養によりATP量が顕著に回復し、肝臓の蘇生を確認しました(図7)。
蘇生した肝臓を異所的にレシピエントへ移植し、臓器保存液を用いた低温保存後の肝臓と、赤血球非添加群の肝臓を移植したレシピエントと比較しました。臓器保存液を用いた低温保存後の肝臓(移植数=5)と灌流培養システム(赤血球非添加条件)の肝臓(移植数=5)を移植したレシピエントは生存率が低下するとともに、レシピエント本来の肝臓を移植後7日目に70%部分切除した後、3日以内に全例死亡しました。一方、灌流培養システムにより蘇生した肝臓(移植数=5)を移植したレシピエントは、移植後14日目の生存率は100%で、移植後7目に70%部分切除した後には再生能を有していました。これは、重度の温阻血肝臓でも蘇生できることを示しています(図8)。
今後の期待
共同研究グループが開発した臓器灌流培養システムを用いることにより、ドナー臓器の保存時間の延長が可能になること、移植が不可能であると考えられてきた長時間の温阻血による深刻な障害を受けた心停止ドナー由来の肝臓を、生体外培養により再生が可能なほどに蘇生できることが分かりました。また、本研究では、これまで不明であった常温域での保存効果がどのようなメカニズムによって起こるのかを明らかにしました。
今後、本技術のヒトへの応用化に向けて、進めていきます。
さらに、今回開発した技術は、未だに不可能な生体外における再生臓器の育成のための培養装置としての発展が期待できます。
原論文情報
- Jun Ishikawa, Masamitsu Oshima, Fumitaka Iwasaki, Ryoji Suzuki, Joonhong Park, Kazuhisa Nakao, Yuki Matsuzawa-Adachi, Taro Mizutsuki, Ayaka Kobayashi, Yuta Abe, Eiji Kobayashi, Katsunari Tezuka & Takashi Tsuji, "Hypothermic temperature effects on organ survival and restoration", Scientific Reports, doi: 10.1038/srep09563
発表者
理化学研究所
多細胞システム形成研究センター 器官誘導研究チーム
チームリーダー 辻 孝(つじ たかし)
株式会社オーガンテクノロジーズ
研究開発部長 手塚 克成(てづか かつなり)
慶應義塾大学医学部
特任教授 小林 英司(こばやし えいじ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
慶應義塾大学信濃町キャンパス総務課 吉岡、三舩
Tel: 03-5363-3611 / Fax: 03-5363-3612
med-koho [at] adst.keio.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.阻血、温阻血
心停止や血管の閉塞によって臓器に血流が送られなくなった状態を阻血という。阻血に陥っても体温は急激には下がらないため、臓器の周囲温度が体温程度に維持されている状態を温阻血と言い、臓器障害が急速に進行する。 - 2.臓器灌流培養システム
臓器の血管に送液チューブを連結させ、ポンプを用いて血管内に液体を循環させる方法。 - 3.ATP(アデノシン三リン酸)
アデノシンと3つのリン酸から構成される物質で、生体内に広く存在し、細胞にエネルギーを供給する。 - 4.異所的な移植(異所性臓器移植)
移植臓器を、生体内の本来の位置とは異なる部位へ移植を行うこと。完全な臓器置換を行う場合は、同所性移植といわれる。
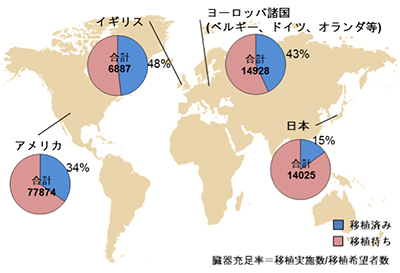
図1 各国における臓器充足率の割合
2014年における各国の臓器充足率の状況(UNOS, UK Transplant, Euro Transplant, 日本臓器移植ネットワークより一部改編)。世界的に臓器が不足しているなか、日本の臓器移植実施率は特に低く、15%に留まっている。
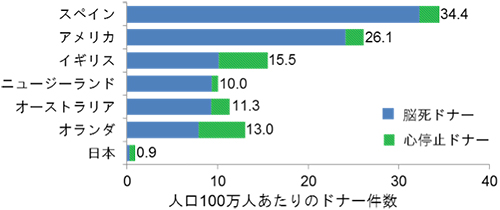
図2 各国における心停止ドナーの利用状況
2012年における各国の心停止ドナー利用状況(日本臓器移植ネットワーク、Br J Anaesth 2012より一部改編)。日本を除く各国は脳死ドナーと比較し心停止ドナーの利用が少ない状況。
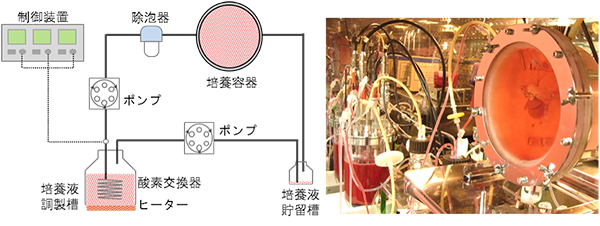
図3 臓器灌流培養システムの回路図と写真
- 左: 臓器灌流培養システムの回路図。肝上部下大静脈と門脈にチューブを接続し、ポンプで培養液を灌流する。培養液の温度やpH、酸素濃度などを制御できる。
- 右: 臓器灌流培養システムの写真。手前に臓器チャンバー(臓器を入れる容器)があり、その内部に肝臓を設置している。写真左側に見えるボトルには灌流培養液が入っている。
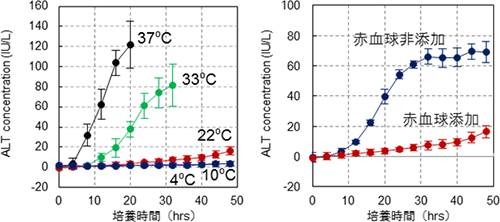
図4 温度制御と赤血球の添加による臓器障害の抑制効果
アラニンアミノトランスフォラーゼ(ALT)の値が高いほど肝障害が大きい。左図は培養温度を変えた時の肝障害を示し、右図は赤血球の添加、非添加時の肝障害を示した。
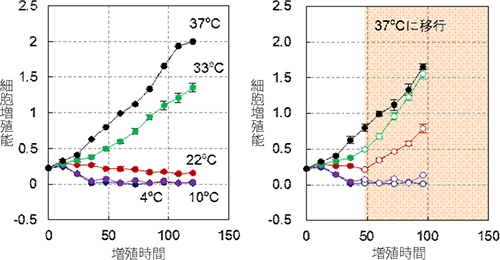
図5 温度制御下における細胞増殖能の解析
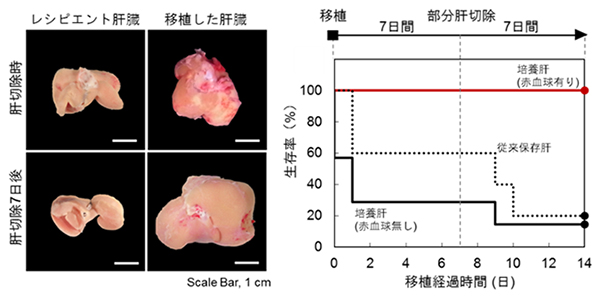
図6 移植した培養臓器の肝再生能の解析
- 左: 肝臓を切除した後の肝臓の再生を示す。レシピエント本来の肝臓を70%部分切除し、再生できないように処置しているので、切除後、7日目でも肝臓は再生していない。一方、灌流培養システム(赤血球添加条件)で灌流培養した移植肝臓は、切除後7日目には正常な臓器の大きさまで再生した。
- 右: さまざまな条件で処置した肝臓を移植した時のレシピエントの生存率。移植後、7日目に部分肝切除をし、その後の生存率も解析した。
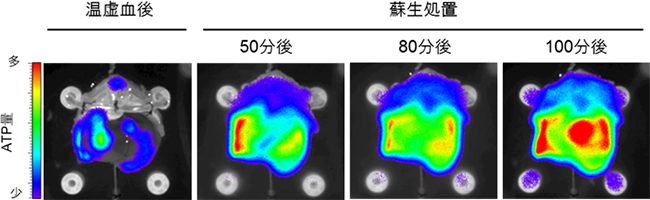
図7 心停止ドナーの生体外灌流による蘇生効果の解析
ルシフェラーゼラットを用いて肝臓内のATP量を可視化した。ATP量は赤くなるほど多く、青くなるほど少ない。蘇生処置後には時間に依存して赤く光る領域が広くなり、ATP量が増えていることが分かる。
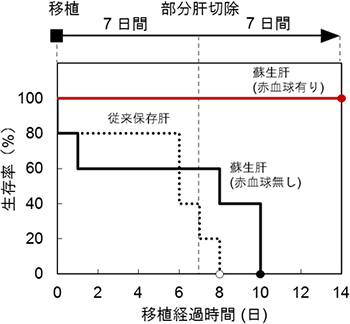
図8 蘇生肝臓の移植による生存率の解析
さまざまな条件で処置した肝臓を移植したレシピエントの生存率。レシピエント本来の肝臓を移植後7日目に70%部分切除をし、その後の生存率を解析した。温阻血後、臓器保存液を用いて100分間低温保存した後の肝臓を移植したレシピエントと、灌流培養システム(赤血球非添加条件)により100分間灌流培養した肝臓を移植したレシピエントは、移植後に生存率が低下するとともに、肝臓の部分切除後3日以内に全例死亡した。一方、温阻血後、灌流培養システム(赤血球添加条件)により100分間灌流培養し蘇生した肝臓を移植したレシピエントは、切除後、肝臓が再生し14日目の生存率が100%だった。
