要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター非天然型アミノ酸技術研究チームの坂本健作チームリーダーらの研究チーム※は、大腸菌の遺伝暗号を改変することで、多様なアミノ酸をタンパク質に高い効率で導入できる技術を開発しました。
医薬品や産業用酵素などのタンパク質の多くは、組換えDNA技術を用いて大腸菌で生産されています。ヒトのタンパク質を構成している20種類のアミノ酸(正規アミノ酸)は「遺伝暗号[1]」によって決められています。遺伝暗号は、大腸菌からヒトまでのほとんどの生物で同じであり、ヒト遺伝子を大腸菌に組み込んでヒトのタンパク質を大量生産することが可能になっています。しかし、20種類のアミノ酸以外の有用な新規アミノ酸を含んだ組換えタンパク質[2]の生産技術は開発途上であり、実用できる生産量の実現にまで到っていませんでした。研究チームは、生物の遺伝暗号を操作することによってこの問題の解決を試みました。
遺伝暗号の中にはアミノ酸を意味する(に対応する)「コドン[1]」以外に、タンパク質の合成の終了を意味する「終止コドン」が3種類含まれています。研究チームは、大腸菌のゲノムを改変することで、終止コドンの1つ「TAGコドン」を何の意味も持たないコドンに変えた大腸菌株を作成しました。この大腸菌株を利用すると、TAGコドンを使って新規アミノ酸をタンパク質に導入できます。
例えば、血液凝固を防ぐ薬として使われているタンパク質のヒルジン[3]は、硫酸基を持つアミノ酸(硫酸化アミノ酸)を取り込むことで効果が増強されることが分かっていますが、実験レベルに留まっていました。研究チームは、開発した大腸菌株を用いて硫酸化アミノ酸の取り込みを劇的に改善することに成功しました。また、抗体を活用した医薬品は、これからの医薬品としてますます有望視されていますが、その抗体にも自由に新規アミノ酸を導入して機能を高度化できる可能性を示しました。開発した大腸菌株は、機能を高度化したタンパク質医薬品や産業用酵素の大量生産につながる可能性があります。
本研究は、英国のオンライン科学雑誌『Scientific Reports』(5月18日付け)に掲載されます。
※研究チーム
理化学研究所 ライフサイエンス技術基盤研究センター 構造・合成生物学部門生命分子制御研究グループ 非天然型アミノ酸技術研究チーム
チームリーダー 坂本 健作(さかもと けんさく)
基礎科学特別研究員 向井 崇人(むかい たかひと)
(現:米イエール大学ポスドク研究員)
背景
私たちの体を構成するタンパク質は、メチニオンやアラニンなど20種類のアミノ酸が結合してできています。どの種類のアミノ酸をどの順番でつなげてタンパク質をつくるのかが、DNAにあるアデニン(A)、グアニン(G)、シトシン(C)、チミン(T)という4つの塩基の並び方(塩基配列)によって書かれています(図1)。DNAの塩基配列を、タンパク質の中のアミノ酸の並び方に変換するルールは「遺伝暗号」と呼ばれています。遺伝暗号は基本的には全ての生物で同じであり、このように全生物が共通のルールを持っていることは、現在の生物が共通の祖先を持つことの証拠と考えられています。
遺伝暗号のルールを図2に示します。このルールは1960年代に解明されました。3つの塩基が1つのまとまり(コドン)となって特定の意味を持ちます。例えばTTTというコドンはフェニルアラニンというアミノ酸を意味します。遺伝暗号の中にはコドン以外に「終止コドン」が3種類(TAA、TGA、TAG)含まれています。終止コドンは、文章の句点「。」のような働きをしていて、タンパク質の合成終了を意味しており、いつも遺伝子の最後に現れます(図1)。
生物の遺伝暗号は20種類のアミノ酸にしか対応しておらず、その結果として、生合成される全てのタンパク質は20種類のアミノ酸がつながってできたものになります。1980年代には、20種類以外の多様なアミノ酸をタンパク質に導入することで、より有用なタンパク質を作り出す研究が盛んに行われ、そのための技術開発が始まりましたが、新規アミノ酸に対応した遺伝暗号を作り出すには困難が伴いました。遺伝暗号が解明された1960年代に、DNAの二重らせん構造の発見者の1人であるF. C. クリック博士[4]が、この困難について「遺伝暗号はDNA情報を変換するルールなのだから、このルールの変更は生物にとって致死的な結果になる」と述べています。間違った辞書を使って英語を日本語に翻訳したら、意味が通じなくなるのと同じことです。
研究チームは2010年に、遺伝暗号の改変が致死的にならない条件を大腸菌で見いだしました。TAGコドンで終わる遺伝子の中で、とくに重要な7つの遺伝子のTAGコドンを他の終止コドン(TAA、TGA)に変えるというものです。こうすれば、他の遺伝子のTAGコドンの意味がタンパク質合成終了から新規アミノ酸に変わっても、これらの重要な遺伝子の機能は損なわれません。しかし、TAGコドンで終わる遺伝子は大腸菌には約300個あるため、ゲノム中に多数のTAGコドンが残り、TAGコドンを、いったん意味を失った状態にすることは難しく、TAGコドンは必ず何らかのアミノ酸を意味してしまいました。そのため、アミノ酸の種類によって大腸菌の生育が大きく影響されるという問題が生じました。タンパク質の生産量は大腸菌の生育に大きく依存するため、研究チームはこの問題の解決を目指しました。
研究手法と成果
今回、2010年の研究手法をさらに徹底させ、さらに洗練された方法の開発を試みました。まず、置き換えるTAGコドンの数を7つから、全体の約3分の1に相当する95に大幅に増やしました。約300個の遺伝子全てのTAGコドンを置換した先行研究が2013年に報告されていましたが、これほど多くの改変を施すと大腸菌の生育が悪くなり、タンパク質生産量の観点から望ましくないことが分かっていました。研究チームは、生命活動の維持に重要な遺伝子95個に絞るとともに、大腸菌の染色体DNAの改変を行うためにDNA修復機構[5]を利用する方法を採用しました。これによって、余計な変異が生じる確率を大幅に減らすことができ、狙った95個の遺伝子のTAGコドンを他の終止コドンに置き換えることができました。
次のステップとして、TAGコドンを読み取ってタンパク質合成を終了させる大腸菌内の因子「RF-1」を大腸菌から取り除きました。これによって、TAGの本来の意味(機能)を大腸菌の遺伝暗号の中から消去することに成功しました。この手法で作製した大腸菌(B-95.⊿A株)の中では、TAGは何の意味も持っていませんが(図3)、B-95.⊿A株は通常の大腸菌と同じように順調に増殖します。さらにTAGを新規アミノ酸の意味を持たせる(翻訳する)ための分子を大腸菌B-95.⊿A株に導入することで、TAGコドンを自由に新規アミノ酸に翻訳できます。
研究チームは、大腸菌(B-95.⊿A株)を用いて、血液凝固を防ぐ薬として使われているタンパク質のヒルジン中の63番目のアミノ酸として硫酸チロシン(図4)を組み込んだ硫酸化ヒルジン分子の合成に成功しました。このような分子を通常の大腸菌で合成すると合成が途中で止まった分子が生じてしまい、その分だけ生産量が少なくなります。B-95.⊿A株を用いれば、途中で止まった分子は生じないので、生産量が5倍に改善されると共に均一な試料が得られることが示されました。
さらに、抗体Fab分子[6]中の3カ所に新規アミノ酸を導入できることを示しました。通常の大腸菌を用いてタンパク質中の複数個所に新規アミノ酸を導入すると、タンパク質生産量の大幅な低下を招くことがありました。B-95.⊿A株を用いた場合は、新規アミノ酸の1つであるアジドフェニルアラニン(図4)を同時に3つの異なる部位に導入しても、抗体Fab分子の生産量はほとんど低下しませんでした。アジドフェニルアラニンは通常のアミノ酸にはないアジド基を含んでいます。アジド基に特異的な化学反応が知られているので、抗体Fab分子の3カ所をそのような反応のための「足場[7]」とすることができます。この足場を使うことで、分子の有用な性質を変えることなく、抗体Fab分子にさまざまな化合物を結合させることが可能になります。本研究の成果によって、このような有用性を賦与した組換えタンパク質の生産効率を産業的に実用できるまでに高めることが初めて可能になりました。
今後の期待
ヒトのタンパク質が大腸菌で生産できる組換えタンパク質生産技術は、そもそも革新的なものでした。その利点に加えて、これまでにも、遺伝暗号という生物にとって最も基本的な性質を人為的に改変することが試みられてきました。本研究により、遺伝暗号の改変が大腸菌の正常な増殖を損なうことなく可能であることが示され、今後、有用なタンパク質の開発・生産方法の進展につながると期待できます。
血液凝固を防ぐ薬剤のヒルジンは、硫酸基を持つアミノ酸(硫酸化アミノ酸)を取り込むことで効果が増強されることが分かっています。研究チームは、大量培養に適したB-95.⊿A株を用いて、硫酸化アミノ酸を組み込んだヒルジンの生産効率が改善され、しかも目的物を均一な産物として生産できることを示しました。
また、抗体を活用した医薬品は、これからの医薬品としてますます有望視されていますが、開発されたB-95.⊿A株を用いることで、抗体に新規アミノ酸を高い効率で導入できることが示されました。この成果は、将来的には抗がん剤などの薬物を抗体に結合させるような用途の実用化に貢献すると期待されます。
原論文情報
- Takahito Mukai, Hiroko Hoshi, Kazumasa Ohtake, Mihoko Takahashi, Atsushi Yamaguchi, Akiko Hayashi, Shigeyuki Yokoyama, and Kensaku Sakamoto, "Highly reproductive Escherichia coli cells with no specific assignment for the UAG codon", Scientific Reports, doi: 10.1038/srep09699
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 構造・合成生物学部門 生命分子制御研究グループ 非天然型アミノ酸技術研究チーム
チームリーダー 坂本 健作(さかもと けんさく)
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
チーフ・サイエンスコミュニケーター 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.遺伝暗号、コドン
タンパク質の中のアミノ酸の並び方は、そのタンパク質の遺伝子(DNA)の中の塩基配列に対応している。3つの塩基がひとまとまりになって1つのアミノ酸に対応しており、この3塩基の並びを「コドン」と呼ぶ。64通りのコドンが存在するが、そのうちの61種類のコドンがアミノ酸を意味しており、例えばTTTはフェニルアラニンである。残り3つのコドン(TAA、TGA、TAG)はタンパク質合成終了を意味する「終止コドン」であり、遺伝子の最後に現れる。このようなコドンとアミノ酸などの対応関係を「遺伝暗号」と呼び、この対応関係に基づいて遺伝子の塩基配列をタンパク質中のアミノ酸の配列に変換することができる。 - 2.組換えタンパク質
組換えDNA技術によって生産されるタンパク質。リコンビナント・タンパク質とも呼ばれる。例えば、ヒトのインシュリンの遺伝子を大腸菌に組み込むことで、インシュリンを大腸菌に合成させることができる。 - 3.ヒルジン
医用ヒルの唾液腺に含まれる短いタンパク質。血液中に含まれる酵素であるトロンビンの働きを阻害して血液の凝固を防ぐ作用を持つ。組換えDNA技術によって大量生産されている。 - 4.F. C. クリック博士
1953年にJ. ワトソン博士と共同でDNAの2重らせん構造モデルを提唱し、1962年にノーベル生理学・医学賞を受賞した英国の研究者。遺伝暗号に関するいくつかの洞察を行い、とくに、遺伝暗号におけるアミノ酸とコドンの対応関係は、生物進化のある時期に偶然に成立しその後変化していない、とする「偶然凍結説」が有名である。 - 5.DNA修復機構
DNA分子は複製されて全く同じ2つのコピーが作られるが、ときどき間違いが生じることがあり、生物はこの間違いを修正する分子機構を持っている。この修正はDNAが2つの鎖から構成されることを利用しており、間違った塩基配列を生じた1つの鎖を、正しい鎖の情報と照らし合わせることで修復を行う。短い人工的なDNA分子を細胞に導入することで、DNAが複製されるタイミングで人工DNAの情報を細胞のDNAに書き込むことができる。この技術を利用して、本研究ではTAGコドンの置き換えを行っている。 - 6.抗体Fab分子
抗体はY字の形をしていて、上に突きだした2つの「腕」の部分のそれぞれをFabと呼んでいる。抗体が抗原を認識する機能はFab部分にあるので、この部分だけ切り離した分子(Fab分子)を作製し、抗原の検出等に利用することがある。 - 7.足場
タンパク質と化合物が化学的につながるときには、タンパク質の一部分と化合物の一部分が化学変化して互いに結びつく。このような化学変化をするタンパク質側の一部分を、反応の「足場」と呼んでいる。本研究では、タンパク質に導入されたアジド基が足場の役割を果たしている。

図1 遺伝暗号によるDNAの塩基配列からタンパク質のアミノ酸配列への変換
DNAの塩基配列の情報を遺伝暗号に従って変換するとタンパク質中のアミノ酸配列が得られる。塩基にはA、G、C、Tの4種類があり、アミノ酸には、メチオニン(Met)やアラニン(Ala)など20種類が存在する。遺伝子末端の「TAG」はタンパク質合成の終了を意味する終止コドンである。
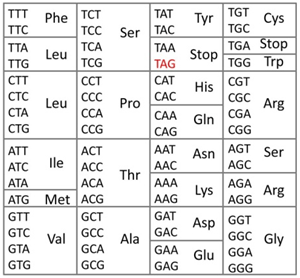
図2 生物の遺伝暗号
全ての生物で基本的には同じ遺伝暗号が使われてタンパク質が生合成される。たとえば、TTTという塩基配列(コドン)はフェニルアラニン(Phe)を意味している。TAA、TAG、TGAの3つのコドンはタンパク質の合成終了を意味する終止コドンである。
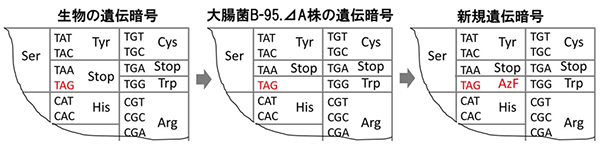
図3 大腸菌(B-95.⊿A株)におけるTAGコドンの役割
TAGコドンは通常の生物の遺伝暗号ではタンパク質合成の終了を意味する(左)。一方、開発したB-95.⊿A株ではその意味を喪失する(中)。このような遺伝暗号は天然には存在しない。さらにTAGコドンを新規アミノ酸(アジドフェニルアラニン(AzF)など)に意味づけることで有用なタンパク質の生産に応用できる(右)。
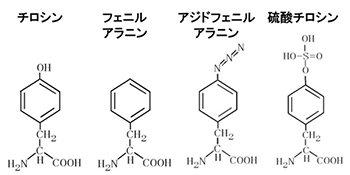
図4 アミノ酸の化学構造
左2つ(チロシン、フェニルアラニン)は正規アミノ酸。右2つは天然の遺伝暗号には存在しない新規アミノ酸。
