2016年3月9日
理化学研究所
大阪大学
北海道大学
分子混雑が計測できる蛍光タンパク質「GimRET」の開発
-定量評価の実現により、分子混雑と細胞機能の関連の議論が可能に-
要旨
理化学研究所(理研)生命システム研究センター先端バイオイメージング研究チームの森川高光大学院生リサーチ・アソシエイト(研究当時 大阪大学大学院生命機能研究科)渡邉朋信チームリーダー、大阪大学大学院理学研究科 今田勝巳教授、同産業科学研究所 永井健治教授、北海道大学大学院先端生命科学研究院 金城政孝教授らの共同研究グループ※は、細胞内の分子混雑状態により色が変わる蛍光タンパク質[1]「GimRET(Glycine inserted mutant fRET sensor)」の開発に成功しました。
細胞内にタンパク質が詰め込まれた状態を「分子混雑[2]」といいます。近年、試験中と細胞中では、タンパク質の折り畳まれ方が異なることが発見されました。また、分子混雑がタンパク質の機能にも影響を与える可能性が示唆されています。例えば、タンパク質の混雑が過剰になると、細胞内ではアミロイド[3]が凝集し神経疾患を引き起こします。細胞内の分子混雑を評価することは、試験内実験と細胞内での実験とを繋げための重要な要素であると共に、分子混雑が細胞機能に与える影響を知ることにも役に立つと期待されます。
これまで、分子混雑を評価する指標として、流動性(分子の動き)が使われてきました。混雑状態と流動性は、必ずしも一致しません。細胞内では、細胞骨格やクロマチンのようなタンパク質が集まった構造体が存在し、流動性に影響を与えます。従って、細胞内の分子混雑は、混雑状態(分子の量)と流動性の両面から評価する必要があります。そこで共同研究グループは、生きた細胞内で分子の混雑状態と流動性を同時に計測する技術の開発に挑みました。
共同研究グループの森川大学院生リサーチ・アソシエイトは、従来の蛍光タンパク質にわずか一つのアミノ酸を挿入することで分子混雑の具合によって明るさの変わることを見いだしました。このユニークで有効な改変方法に多くの研究者が興味を持ち、今回の共同研究グループが立ち上がりました。そして分子の混雑状態に依存して色が変わる蛍光タンパク質「GimRET」を開発・実証しました。GimRETから発せられる蛍光の色を解析することで、分子の混雑状態が評価できます。同時に、光学顕微鏡を用いることでGimRETの細胞内での拡散速度が計測可能です。
蛍光タンパク質にアミノ酸を挿入するというシンプルなアイデアが、分子混雑を定量的に評価する方法の開発につながりました。今後、これまで議論できなかった分子混雑と細胞機能の関連について、議論が可能になると見込まれます。また、GimRETは、基礎的な生命科学分野のみならずアミロイド―シス[3]などの分子混雑が関連する病気の原因解明など、医学分野においても役立つことが期待できます。
本研究は、英国科学誌『Scientific Reports』電子版(英国時間:3月9日)(日本時間:3月9日19時)に掲載されます。
※共同研究グループ
理化学研究所
生命システム研究センター 細胞動態計測コア 先端バイオイメージング研究チーム
大学院生リサーチ・アソシエイト 森川 高光 (もりかわ たかみつ)(研究当時、大阪大学大学院生命機能研究科)
チームリーダー 渡邉 朋信(わたなべ とものぶ)
研究員 市村 垂生(いちむら たろう)
テクニカルスタッフⅠ 慶澤 景子(よしざわ けいこ)
大阪大学
大学院理学研究科
教授 今田 勝巳(いまだ かつみ)
産業科学研究所
教授 永井 健治(ながい たけはる)
免疫学フロンティア研究センター
特任准教授 藤田 英明(ふじた ひであき)
特任助教 町山 裕亮(まちやま ひろあき)
北海道大学大学院 先端生命科学研究院
教授 金城 政孝(きんじょう まさたか)
助教 北村 朗(きたむら あきら)
特任助教 山本 条太郎(やまもと じょうたろう)
修士課程 堀尾 尚司(ほりお たかし)
産業技術総合研究所 バイオメディカル研究部門
研究員 佐々木 章(ささき あきら)
背景
細胞内は、水よりもむしろタンパク質が詰め込まれた「分子混雑」と呼ばれる状態です。これは、生化学実験を行う試験管内の状態とはかけ離れています。分子混雑とタンパク質機能との関係性に関する研究がされており、分子混雑はタンパク質の構造の不安定化を引き起こしたり、逆に安定化したり、酵素活性に影響を与える可能性が示唆されています。
細胞内で分子混雑を構成する要因は主にタンパク質の濃度であり、タンパク質濃度とその溶液の粘性(流動性)に相関があることから、これまでは、細胞内の分子混雑は、流動性により評価されてきました。詳しくは、細胞内に微小粒子と仮定できる蛍光色素や蛍光タンパク質といったプローブを導入し、その拡散係数を測ることで、分子混雑の指標としてきました。しかし、実際の細胞の中には、細胞骨格やクロマチンなど、タンパク質が集まってある構造を持って機能しています。そして、プローブの拡散はこの構造体の挙動により影響を受けてしまいます。したがって分子混雑は、細胞内の混雑状態(分子の量)と流動性(分子の動き、拡散係数)の両面から評価する必要があります。分子混雑と細胞の機能メカニズムとの関連は生命現象を理解する上で、明らかにすべき重要課題の一つですが、これまでは流動性を評価する技術しかなく、混雑状態を評価する有効な方法がありませんでした。
そこで共同研究グループは、混雑状態によって色の変わる蛍光タンパク質の開発と、その蛍光タンパク質を用いて、混雑状態と流動性との同時計測に挑みました。
研究手法と成果
共同研究グループは、分子混雑が溶液の疎水性と直接関与していることに注目しました。そして、溶液全体の疎水性は、分子混雑のうち最も大きなファクターであるタンパク質濃度と見なせると考えました。このとき、計測技術の基盤として選んだのは蛍光タンパク質です。蛍光タンパク質を用いることで、生きた細胞の中での計測が可能になるためです。
蛍光タンパク質が発する光の強度を、溶液中の疎水性に依存させることが、本研究の最初の課題でした。蛍光タンパク質は円柱型をしていて、蛍光を発する発光団はその円柱構造の内部にあります(図1A)。円柱構造が発光団を水分子との相互作用から守っているため、発光団の蛍光は溶液中の疎水性には依存しません。つまり、蛍光が失われない程度に発光団と水分子を相互作用させることができれば、溶液中の疎水性によって発光の量が変わる蛍光タンパク質になります。そこで森川大学院生リサーチ・アソシエイトは、蛍光タンパク質の円柱構造に「穴をあける」というアイデアを試しました(図1B)。
蛍光タンパク質の遺伝子改変には、通常、アミノ酸を置換する方法が用いられます。今回の目的は穴をあけることなので、あえて余計なアミノ酸を挿入しました。これにより、円柱構造の一部が少しだけ壊れ、数個の水分子だけが発光団に相互作用するようになりました(図2)。そこで、まずアミノ酸の一種であるグリシンを一つだけ蛍光タンパク質に挿入したところ、溶液の疎水性によって蛍光強度が変わる蛍光タンパク質になることが分かりました。
さらに、蛍光共鳴エネルギー移動法[4]を適応することで、分子混雑が上昇すると、黄色から青色に色が変わる蛍光タンパク質が得られました(図3A)。共同研究グループは、カクテルのギムレット(Gimlet)と同じ色の蛍光を発する、この新しい蛍光タンパク質を「GimRET(Glycine inserted mutant fRET sensor)」と名付けました。GimRETを哺乳類細胞に発現させたところ、細胞からはさまざまな色の蛍光が確認されました(図3B)。これは哺乳類細胞の中のタンパク質の混み具合が、細胞ごとにばらついていることを示しています。どの細胞でもその中のタンパク質濃度は同じである、と考えていた共同研究グループにとって、この観察結果は驚くべき発見でした。
さらに共同研究グループは、GimRETによって見積もられる混雑状態と、従来の方法である分子の拡散速度とを比較してみました。拡散速度を測るプローブは、GimRETそのものです。試験管の中では、拡散速度と混雑状態は直線的な関係性にありました。しかし細胞の中ではその直線的な関係が確認されたものの、その直線の傾きが違っていました。この結果は、タンパク質の混雑状態に違いがなくても、細胞核内と細胞質内ではタンパク質の流動性には違いがあることを示しています。同時に、細胞内分子混雑を研究する上で流動性を評価する従来の方法だけでは情報が不足していることも示しています。これは、タンパク質内部の混雑状態の直接計測が、これまでにない情報を与えた一つの実例です。
蛍光タンパク質は細胞を生かしたまま計測できるので、24時間もの間、細胞の分子混雑を計測し続けることが可能です。そこで共同研究グループは、GimRETを用いて細胞が分裂する時の分子混雑の経時的な変化を測りました。(図4)細胞は分裂するまでに娘細胞のためにタンパク質を合成しているので、細胞分裂に同期して混雑状態が変化し、GimRETの色も変化するはずです。予想通り、GimRETの色は細胞分裂に同期して変化しました。また、細胞の大きさを強制的に大きくしたり小さくしたりすることによっても、GimRETの色は変化しました。共同研究グループは、さまざまな検証実験を行い、GimRETが確かに細胞内の混雑状態により色を変えることを実証しました。
今後の期待
共同研究グループは、GimRETを胚性幹細胞(ES細胞)に発現させ、分化前後で細胞核内の分子混雑状態がどう変化するかも調べています。未分化の状態であるES細胞は、かなり混雑している状態にあり、分化が進むに従い混雑状態は減少していくことが分かりました。ES細胞において、細胞の未分化維持に重要な転写因子Myc[5]が、他の多くの転写因子の発現量を全体的に増加させることは過去に報告されており、共同研究グループの発見と矛盾がありません。この発見は、分子混雑とES細胞の未分化維持とが密接に関連していることが強く示唆しています。
本研究では、非常に単純な遺伝子改変により多大な効果をもたらす蛍光タンパク質を開発しました。これまで直接的に測ることができなかった分子混雑が測れるようになったことで、生命科学に新たな知見がもたらされると見込まれます。
原論文情報
- Takamitsu J. Morikawa, Hideaki Fujita, Akira Kitamura, Takashi Horio, Jotaro Yamamoto, Masataka Kinjo, Akira Sasaki, Hiroaki Machiyama, Keiko Yoshizawa, Taro Ichimura, Katsumi Imada, Takeharu Nagai, Tomonobu M. Watanabe., "Dependence of fluorescent protein brightness on protein concentration in solution and enhancement of it.", Scientific Reports
発表者
理化学研究所
生命システム研究センター 細胞動態計測コア 先端バイオイメージング研究チーム
大学院生リサーチ・アソシエイト 森川 高光(もりかわ たかみつ)
(研究当時大阪大学大学院生命機能研究科)
チームリーダー 渡邉 朋信(わたなべ とものぶ)
大阪大学 大学院理学研究科
教授 今田 勝巳(いまだ かつみ)
産業科学研究所
教授 永井 健治(ながい たけはる)
北海道大学 大学院 先端生命科学研究院
教授 金城 政孝(きんじょう まさたか)
 渡邉 朋信
渡邉 朋信
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.蛍光タンパク質
分子量約27kDaの円柱状のタンパク質で、光エネルギーを吸収し、蛍光を発する機能を持つ。蛍光タンパク質は、遺伝子導入等で容易に生きた生物試料内に発現させられることから、分子生物学、細胞生物学、基礎医学など、様々な分野で、もっとも良く用いられる研究ツールのひとつとなっている。1960年代に、下村脩博士により発見され、この功績により下村博士は2008年にノーベル化学賞を受賞した。 - 2.分子混雑
細胞の中は、水よりも、むしろ、大小様々なタンパク質により埋め尽くされており、この状態を分子混雑(molecular crowding)と呼ぶ。例えば、大腸菌の細胞内のタンパク質濃度は、約350g/Lと見積もられている。通常の生化学的な実験では、試験管内は、試料以外のタンパク質は混入しておらず、細胞内の環境とはかけ離れた状況である。分子混雑は、酵素反応やシグナル伝達効率、タンパク質の構造安定性など与えると言われており、分子混雑は、試験管実験と生試料実験とを繋ぐ重要なファクターと考えられる。 - 3.アミロイド、アミロイドーシス
アミロイドは、繊維状の構造を持つ、水に溶けないタンパク質である。病理組織を一般染色法であるヘマトキシリン・エオジン染色を用いて観察すると、アミロイドは、淡桃色の細胞外沈着物として確認される。アミロイドの器官や臓器への凝集・沈着が原因で起こる疾患の総称が、アミロイドーシス(アミロイド症)である。アルツハイマー型認知症やプリオン病が、脳のアミロイドーシスとして有名であるが、他臓器あるいは全身にアミロイドが沈着する可能性がある。 - 4.蛍光共鳴エネルギー移動法(FRET法)
2つの蛍光分子がごく近接して存在する場合に、片方の蛍光分子(ドナー)からもう片方の蛍光分子(アクセプター)へエネルギーが移行する現象。FRETのエネルギー移動効率は2つの蛍光分子のスペクトルの重なりの大きさ、距離と角度により左右される。この原理を用いて、ドナーとアクセプターの蛍光強度比を測定する事によりタンパク質相互作用、生化学反応や細胞内シグナル伝達が可視化されるプローブが数多く開発されている。FRETはFluorescence Resonance Energy Transferの略。IUPAC(国際純正・応用化学連合)の表記法では、「フェルスター共鳴エネルギー移動(Förster Resonance Energy Transfer)」である。 - 5.転写因子Myc
細胞の成長とアポトーシスに作用する転写調節因子のひとつで、多くの遺伝子の発現に関わっている。細胞内で、Mycが強く働くと、細胞のがん化を促進することが良く知られている。人工多能性幹細胞(iPS細胞)作成法が確立された時に、初期化因子として使用された4つの転写因子(Oct3/4、Sox2、Klf4、c-Myc)の一つであるc-Mycは、Mycファミリーに属する転写因子である。
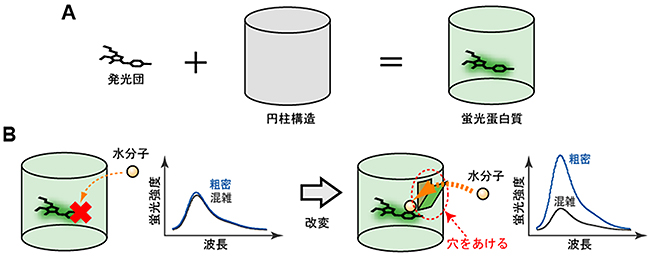
図1 分子混雑に反応する蛍光タンパク質開発の基本的なアイデア
A:蛍光タンパク質の模式図。発光団は単体では、水分子にさらされていて蛍光を発することができない。円柱が水分子の発光団へのアクセスを抑制するため、発光団は光ることができる。
B:通常の蛍光タンパク質では、水分子と発光団との相互作用が抑制されているため、蛍光タンパク質の蛍光は、周囲の水分子の状態(本研究では疎水性)により影響を受けにくい。水分子か通るくらいの穴を円柱にあけることで、少数の水分子だけが発光団と相互作用できると考えられる。
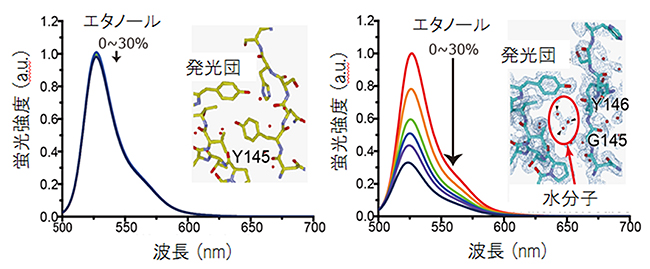
図2 グリシン残基が挿入された蛍光タンパク質の発光強度のエタノール濃度依存性と結晶構造
オワンクラゲ由来の緑色蛍光タンパク質の亜種である黄色蛍光タンパク質の145番目のアミノ酸残基の直前にグリシン残基を一つだけ挿入することで、溶液中のエタノール濃度により蛍光強度が大きく変化する蛍光タンパク質ができた(エタノール濃度が高くなると蛍光強度が下がる)。結晶構造解析により詳しく見てみると、この蛍光タンパク質内部では、発光団近くに水分子が配置されていることが明らかになった。
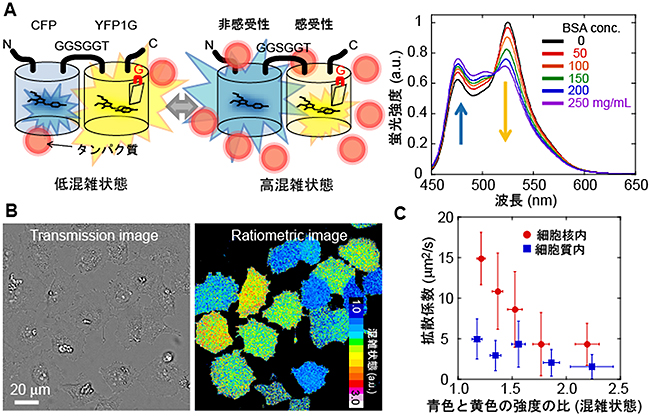
図3 分子混雑により色が変わる蛍光タンパク質GimRET
A:GimRETの模式図(左)と蛍光スペクトルのタンパク質濃度依存性(右)濃度によって強く発光する波長が異なる。
B:GimRETを哺乳類細胞に発現させた例。混雑状態によって色の違いが出ていることが分かる(右)。
C:拡散係数とGimRETの色との相関を示すグラフ。拡散速度が遅くなるほど高混雑状態となる。

図4 GimRETを用いた細胞分裂中の分子混雑変化を経時計測した例
蛍光タンパク質は、細胞を生かしたまま計測できるので、24時間もの間、細胞の分子混雑を計測し続けることができる(左)。細胞は分裂する前に娘細胞のためにタンパク質を合成するので、タンパク質濃度が上がると考えられる。細胞分裂直後からGimRETの色を計測してみると、細胞分裂直後にタンパク質濃度が上がることが確認された(右)。
