2016年6月1日
理化学研究所
愛媛大学
アミロイドペプチドの凝集を阻害する生体反応を発見
-酸化ストレス疾患を治療する創薬研究に大きな手掛かり-
要旨
理化学研究所(理研)田中生体機能合成化学研究室の田中克典准主任研究員、筒井歩特別研究員と、愛媛大学大学院理工学研究科の座古保教授らの共同研究グループ※は、酸化ストレス[1]条件下で、アクロレイン[2]とポリアミン[3]から速やかに生成される8員環化合物が、アミロイドペプチド[4]の凝集を阻害して細胞毒性を中和することを発見しました。
生体内で活性酸素が作られると、タンパク質や脂質、あるいは核酸(DNAやRNA)と反応し、生体にダメージを与えます。これを酸化ストレスと呼びます。アルツハイマー病やがん、脳梗塞、慢性疾患など、酸化ストレスを原因とする疾患では、細胞に対して強い毒性を持つアクロレインが過剰に発生し、この分子が酸化ストレスをさらに進行させると考えられてきました。
今回、共同研究グループはアクロレインがアルツハイマー病発症時に高発現するポリアミンと速やかに反応して、8員環化合物が生成されることを発見しました。さらに、この8員環化合物が、アルツハイマー発症の要因の1つであると考えられているアミロイドペプチドの凝集を著しく抑え、アミロイドペプチドの細胞毒性を中和することを発見しました。これらの結果は、細胞が酸化ストレス条件下でアクロレインを発生し、ポリアミンなどさまざまな生体内アミンとの間で8員環化合物を形成することで、細胞機能を制御している可能性を強く示しています。
今後、酸化ストレス疾患の発症メカニズムの究明や治療法の開発に貢献すると期待できます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 個人型研究(さきがけ)の研究領域「分子技術と新機能創出」(研究総括:加藤隆史)研究課題名「生体内合成化学治療:動物内での生理活性分子合成」(研究者:田中克典)の一環として行われました。本成果は、ドイツの科学雑誌『Advanced Science』のオンライン版(6月1日付け)に掲載されます。
※共同研究グループ
理化学研究所
田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
特別研究員 筒井 歩(つつい あゆみ)
前田バイオ工学研究室
主任研究員 前田 瑞夫(まえだ みずお)
国際プログラム・アソシエイト(研究当時) トン・ブ(Tong Bu)
グローバル研究クラスタ 理研-マックスプランク連携研究センター
システム糖鎖生物学研究グループ 糖鎖構造生物学研究チーム
チームリーダー 山口 芳樹(やまぐち よしき)
愛媛大学大学院理工学研究科
教授 座古 保(ざこ たもつ)(研究当時 理研前田バイオ工学研究室 専任研究員)
背景
生体内で活性酸素が作られると、タンパク質や脂質、あるいは核酸(DNAやRNA)と反応し、生体にダメージを与えます。これを酸化ストレスと呼びます。アルツハイマー病やがん、脳梗塞、慢性疾患など、酸化ストレスを原因とする疾患ではアクロレインが過剰に発生します。
アクロレインは、不飽和アルデヒド分子[2]の中で最もサイズが小さく、また他の分子との反応性が高く、細胞に対して強い毒性を持つ分子です。酸化ストレス疾患では、脂質やポリアミン(タンパク質合成や細胞分裂に関与する因子)の代謝産物として過剰に発生したアクロレインがさまざまな生体内分子と反応することによって、酸化ストレスをさらに進行させると考えられています。
また、アルツハイマー病の患者では、ポリアミンの濃度が著しく上がっていることが知られています。さらに、最近の報告では、アルツハイマー病の発症原因の1つと考えられているアミロイドペプチドの凝集速度を、ポリアミンが著しく高めているとされています。アミロイドペプチドは凝集すると細胞毒性を示します。
そこで、アクロレインやポリアミンと、アルツハイマー病を代表とする酸化ストレス疾患との関連性について、分子レベルでの解明に興味が集まっていました。
研究手法と成果
共同研究グループは、アクロレインの反応性を有機化学的に解析していたところ、アクロレインがポリアミンと生体内(細胞内)に存在する濃度で速やかに反応し、8員環化合物が効率よく生成されることを発見しました。この反応は、最初に生成する2分子の共役イミン[5]が、[4+4] 環化反応(4原子と4原子が結合する過程)を経て進行した結果です(図1)。アクロレインがポリアミンなどさまざまな生体内アミンと反応して共役イミン誘導体が生成されることは昔からよく知られていますが、8員環化合物が生成されるという結果は、今まで報告がありませんでした。
さらに、アクロレインとポリアミンとの反応によって速やかに生成される8員環化合物は、アルツハイマー発症の要因の1つであると考えられているアミロイドペプチドの凝集を著しく阻害することが分かりました。図2aの表は、Aβ40ペプチド(40個のアミノ酸からなるアミロイドペプチド)に対して、アクロレインと代表的なポリアミンであるスペルミジン[3]やスペルミン[3]との反応から生成される8員環化合物を共存させた結果です。これら8員環化合物を共存させるとAβ40ペプチドの凝集が著しく抑えられていることが分かります。一方、アクロレインやスペルミンだけでは、Aβ40ペプチドの凝集を抑えることができません。さらに、これらの8員環化合物がAβ40ペプチドの凝集を抑えることによって、Aβ40ペプチドの細胞毒性が軽減することが判明しました(図2b)。
共同研究グループは、アミロイドペプチドの凝集と細胞毒性阻害メカニズムを色々と検討した結果、アクロレインとポリアミン(スペルミジン)から生成される8員環化合物は、強い毒性を持つ可溶性Aβ40高分子種の形成、および不溶性のAβ40の線維化を防ぐことにより、細胞毒性を中和していることが分かりました(図3)
今後の期待
これまでに、アクロレインは酸化ストレス条件下で発生し、生体分子と反応することで酸化ストレスを増進させる毒性物質として捉えられてきました。一方、今回の共同研究グループの成果は、アクロレインがポリアミンと反応し、新しい生理活性物質(8員環化合物)に変わることにより、アミロイドペプチドの凝集を著しく抑え、アミロイドぺプチドの細胞毒性を中和するという新しい知見です。共同研究グループのこれまでの成果により、アクロレインは、ポリアミンを含むさまざまな生体内アミンと反応し、8員環化合物が生成されることが示されています。これらの現象は、アクロレインが酸化ストレス条件下で、細胞で発生し、さまざまな生体内アミンとの間で8員環化合物を形成することで、細胞機能を制御している可能性を強く示めしています(図4)。今後、酸化ストレスを原因とするさまざまな疾患の発症メカニズムの究明や治療法の開発に貢献すると期待できます。
原論文情報
- Ayumi Tsutsui, Tamotsu Zako, Tong Bu, Yoshiki Yamaguchi, Mizuo Maeda and Katsunori Tanaka, "1,5-Diazacyclooctanes, as Exclusive Oxidative Polyamine Metabolites, Inhibit Amyloid-β(1-40) Fibrillization", Advanced Science
発表者
理化学研究所
准主任研究員研究室 田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
特別研究員 筒井 歩(つつい あゆみ)
愛媛大学大学院理工学研究科
教授 座古 保(ざこ たもつ)
 左から田中准主任研究員、座古教授
左から田中准主任研究員、座古教授
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
愛媛大学総務部広報課広報チーム
Tel: 089-927-9022 / Fax: 089-927- 9052
koho [at] stu.ehime-u.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.酸化ストレス
生体内で酸化還元状態の均衡が崩れたとき、過酸化水素やヒドロキシラジカルを代表とする活性酸素が産生される。これらがタンパク質や脂質、あるいは核酸と反応し、生体にダメージを与える。また、脂質や生体内アミンが酸化されて、反応性の高い不飽和アルデヒドが生じる。酸化ストレスを原因とする疾患には、アルツハイマー病やがん、動脈硬化、慢性疾患などがよく知られている。 - 2.アクロレイン、不飽和アルデヒド
アルデヒド基が二重結合(または三重結合)と炭素-炭素結合を介してつながった構造を持つ化合物を不飽和アルデヒドといい、アルデヒド基につながる二重結合が、全て水素で置換されている分子がアクロレインである。共役アルデヒドとも呼ばれる。不飽和アルデヒドは、アルデヒド基や二重結合の多数の部位で反応でき、反応性が高い分子である。特に、アクロレインは不飽和アルデヒドの中でサイズが最も小さく、生体内のさまざまな分子との反応性が高い。また毒性が非常に強い。

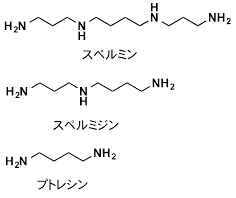
- 3.ポリアミン、スペルミン、スペルミジン
下記の構造に代表されるような1,3-または1,4-ジアミノ構造を持つ生体分子。長い分子も存在する。細胞内のRNAに主に付着しており、細胞増殖などの際に合成・代謝が盛んに起こる。酸化ストレス条件下では、ポリアミンが酸化されてアクロレインが生成する。
- 4.アミロイドペプチド
アミロイドβタンパク質(Aβ)からセクレターゼという酵素によって切り出されるペプチド断片。アミロイドペプチドが凝集すると細胞毒性を示す。アルツハイマー発症の原因の1つの要因であると考えられている。Aβ40ペプチドは40個のアミノ酸からなるペプチドのことである。 - 5.共役イミン
不飽和アルデヒド(共役アルデヒド)を1級アミンと反応させて得られる分子。共役シッフ塩基とも呼ばれる。
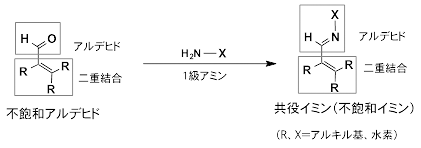
![アクロレインとポリアミンとの[4+4]環化反応による8員環化合物の生成の図](/medialibrary/riken/pr/press/2016/20160601_1/fig1.gif)
図1 アクロレインとポリアミンとの[4+4]環化反応による8員環化合物の生成
酸化ストレス条件下、細胞で発生するアクロレインは、スペルミンやスペルミジンを代表とするポリアミンと反応し、2分子の共役イミンを生成する。その後、共役イミンは、[4+4]環化反応を起こし8員環化合物が速やかに生成される。
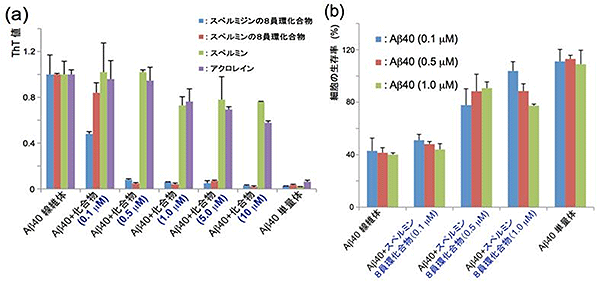
図2 Aβ40ペプチド凝集と細胞毒性に対する8員環化合物の効果
(a)Aβ40ペプチドに対して、さまざまな濃度の①アクロレインとスペルジミンとの反応で生成される8員環化合物、②アクロレインとスペルミンとの反応で生成される8員環化合物、③スペルミン、④アクロレインを作用させたときのAβ40ペプチド凝集体形成への効果(ThT:チオフラビンTによる凝集体生成の評価による(※1))。③スペルミンや④アクロレインを作用させたときにはAβ40ペプチドの凝集体が生成するのに対して、①スペルミジン由来の8員環化合物と②スペルミン由来の8員環化合物は凝集体の生成を効果的に阻害した。
※1:ThTはアミロイド線維と結合すると490ナノメートル(nm、1nmは10億分の1メートル)付近に蛍光を示すため、アミロイド線維化や凝集の簡便な試験試薬として汎用されている。
(b)PC12細胞(※2)に対して、アクロレインとスペルミンから生成される8員環化合物の存在下にAβ40ペプチドを作用させると、Aβ40ペプチドの細胞毒性が軽減した。
※2:ラットの副腎髄質由来の褐色細胞腫で、神経細胞分化活性やアルツハイマーの毒性評価の代表的モデル細胞として利用されている。
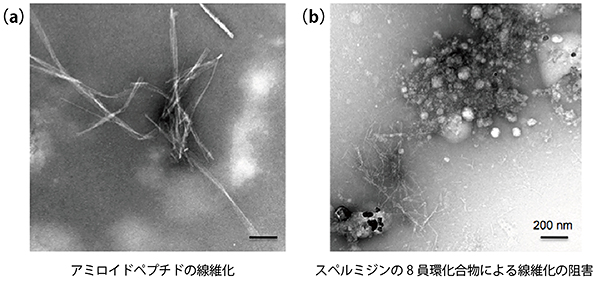
図3 透過型電子顕微鏡(TEM)観察による8員環化合物存在化でのAβ40ペプチド線維化阻害
アクロレインとスペルミジンとの反応から得られる8員環化合物をAβ40ペプチドに添加した画像。2つの写真から、8員環化合物により効果的にAβ40ペプチドの線維化が阻害されていることが分かる。
図4 酸化ストレス条件下での8員環化合物形成による細胞制御の可能性
酸化ストレス条件下で、細胞内にアクロレインが発生し、ポリアミンをはじめとする生体内アミンと反応することで8員環化合物が生成される。8員環化合物は、アミロイドペプチドの凝集を制御するなど、さまざまな細胞の機能を制御している可能性がある。
