要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター タンパク質機能・構造研究チームの仁田亮上級研究員と東京大学大学院総合文化研究科の矢島潤一郎准教授らの共同研究グループ※は、細胞分裂を牽引する分子モーター[1]「Kinesin-14(キネシン-14[2])」が、他のキネシンとは逆向きに動く分子メカニズムを解明しました。
生物がつくるタンパク質には、エネルギーを使って動くものがあります。このようなタンパク質は分子モーターと呼ばれ、筋肉の収縮や細胞内の分子の運び屋として働きます。分子モーターの一種のキネシンは、細胞内物質輸送の中心的役割を担い、細胞分裂時には紡錘体[3]の形成や染色体の移動を牽引する重要なタンパク質群です。ほとんどのキネシンは、「微小管[4]」というレールの上をプラス端[5]側へ動く順行性モーターです。しかし、キネシン-14はその逆向き、つまりマイナス端[5]側へ動く逆行性モーターであることが知られています。細胞分裂では、順行性モーターと逆行性モーターが共同して働くことで、染色体の整列が可能になります。これまで、順行性キネシンの駆動メカニズムはよく調べられていましたが、逆行性キネシンがどのように逆向きへ動くのか、その分子メカニズムはほとんど分かっていませんでした。
順行性キネシンも逆行性キネシンも、「モータードメイン(領域)」と呼ばれる動力部位を持ちます。逆行性キネシンは、モータードメインのアミノ末端側[6]に「ネックへリックス」、カルボキシ末端側[6]に「ネックミミック」と呼ばれるドメインを持っています。共同研究グループは、キネシン-14のネックミミックの5個のアミノ酸を組換えると、モーターの動く向きが逆転し順行性になることを突き止めました。
次にキネシン-14の立体構造をクライオ電子顕微鏡[7]とX線結晶解析[8]を利用して解析しました。その結果、ネックミミックは全キネシン共通のモータードメイン内の構造変化を入力信号として受け、逆行性キネシンだけにあるネックヘリックスのスイングへと変換する役割を果たすことが分かりました。そして、そのスイングの向きが、逆行性モーターの動く向きを決めていることを突き止めました。
本成果は、細胞分裂の分子メカニズムの解明に寄与するだけでなく、ナノマシン[9]設計戦略への応用、さらに細胞分裂を制御する分子モーターに対する新たな抗がん剤設計への応用など、さまざまな展開へとつながると期待できます。
本研究の一部は、日本学術振興会(JSPS)科学研究費補助金、武田科学振興財団、および科学技術振興機構(JST)戦略的創造研究推進事業(CREST)の支援を受けて行われました。成果は、米国の科学雑誌『Structure』に掲載されるのに先立ち、オンライン版(7月21日付け:日本時間7月22日)に掲載されます。
※共同研究グループ
理化学研究所 ライフサイエンス技術基盤研究センター
タンパク質機能・構造研究チーム
上級研究員 仁田 亮(にった りょう)
上級研究員 重松 秀樹(しげまつ ひでき)
研究員 横山 武司(よこやま たけし)
テクニカルスタッフ 青木 真理(あおき まり)
チームリーダー 白水 美香子(しろうず みかこ)
東京大学大学院 総合文化研究科 広域科学専攻 生命環境科学系
准教授 矢島 潤一郎(やじま じゅんいちろう)
大学院生 山岸 雅彦(やまぎし まさひこ)
助教 須河 光弘(すがわ みつひろ)
東京大学大学院 医学系研究科 分子細胞生物学専攻 細胞生物学・解剖学講座
教授 吉川 雅英(きっかわ まさひで)
背景
生物がつくるタンパク質には、エネルギーを使って動くものがあります。このようなタンパク質は「分子モーター」と呼ばれ、筋肉の収縮や細胞内の分子の運び屋として働きます。分子モーターの一種のキネシンは、細胞内の運び屋タンパク質として中心的役割を担い、細胞分裂時には紡錘体の形成や染色体の移動を牽引する重要なタンパク質群です。ほ乳類では45種類のキネシンが見つかっていますが、ほとんどのキネシンは「微小管」というレールの上をプラス端側へ動く順行性モーターで、その駆動メカニズムについてはよく調べられています。これまで仁田亮上級研究員らはその構造基盤の解明において注1)、矢島潤一郎准教授らはその機能解析において注2)世界を先導してきました。
一方で、キネシン-14は、その逆向き、つまり微小管のマイナス端側へ動く逆行性モーターであることが知られていました。細胞分裂では、順行性モーターと逆行性モーターが共同して働くことによって、染色体の緻密な整列が可能になります。逆行性キネシンは、順行性キネシンと非常によく似た三次元構造をしていますが、どのように逆向きへ動くのか、その分子メカニズムは分かっていませんでした。
そこで、共同研究グループは、逆行性モーターであるキネシン-14のバックギアのメカニズムの解明を目指し、詳細な立体構造と機能の解析を試みました。
注1)Nitta, R., Kikkawa, M., Okada, Y., and Hirokawa, N. (2004). KIF1A alternately uses two loops to bind microtubules. Science 305, 678–683.
Ogawa T, Nitta R, Okada Y, Hirokawa N. (2004). A Common Mechanism for Microtubule Destabilizers- M Type Kinesins Stabilize Curling of the Protofilament Using the Class-Specific Neck and Loops. Cell 2004;116:591-602.
Nitta R, Okada Y, Hirokawa N. (2008). Structural model for strain-dependent microtubule activation of Mg-ADP release from kinesin. Nat. Struct. Mol. Biol. 15:1067-75.
Hirokawa N, Nitta R, Okada Y. (2009). The mechanisms of kinesin motor motility: lessons from the monomeric motor KIF1A. Nat. Rev. Mol. Cell Biol. 10:877-84.
注2)Yajima, J., and Cross, R. (2005). A torque component in the kinesin-1 power stroke. Nat. Chem. Biol. 1, 338–341.
Yajima J,, Mizutani K,, Nishizaka T. (2009). A torque component present in mitotic kinesin Eg5 revealed by three-dimensional tracking. Nat Struct Mol Biol. 15:1119-21
研究手法と成果
まず、キネシン-14が逆向きに動くために必要な部位を調べました。順行性キネシンと逆行性キネシンには、「モータードメイン」と呼ばれる共通の動力部位があります(図1 A, B)。このドメインは動力として、アデノシン三リン酸(ATP)がアデノシンニリン酸(ADP)に加水分解されて生じるエネルギーを使います。順行性キネシンにはモータードメインのカルボキシ(C)末端側に「ネックリンカー」と呼ばれる特有の領域があり、その構造変化が順行性の動きに重要であることが分かっています(図1B)。一方、逆行性キネシンには特有の領域として、モータードメインのアミノ(N)末端側に「ネックへリックス」、カルボキシ末端側に「ネックミミック」があります(図1A)。
共同研究グループは、逆行性キネシンに特有のネックヘリックスとネックミミックを順行性キネシンのモータードメインにつなぐと、順行性キネシンが逆向きに動くことを示しました(図1C)。また、この操作で逆行性になったキネシンのネックミミックのはじめの5個のアミノ酸を、順行性キネシンのネックリンカーのものと入れ替えると、モーターの動く向きが逆転し、順行性の向きに動くことを突き止めました(図1D)。
次に、クライオ電子顕微鏡法とX線結晶解析法を利用して、逆行性モーターの分子構造を解析し、どのようにモーターの動く向きが決まるのか、その分子メカニズムを調べました(図2)。
まず、ATP結合に伴うモータードメインの構造変化を、順行性モーターと逆行性モーターで比較しました。その結果、どちらのモータードメインでも、ATP結合部位の周囲で小さな構造変化が起き、その構造変化が隣の長いらせん構造(ヘリックスα4)の回転運動を引き起こすことが分かりました(図3)。その結果、順行性キネシンではネックリンカーが微小管のプラス端方向へスイングします(図3A)。一方、逆行性モーターでは、ヘリックスα4の回転運動がネックミミックに伝搬し、ネックミミックを回転させていました。このときの空間的な位置関係を調べたところ、ネックミミックはヘリックスα4とネックへリックスとの間に位置しており、ネックミミックの回転がネックヘリックスのマイナス端方向へのスイングを誘導することが分かりました(図3B)。つまり、ネックミミックは、全キネシン共通のモータードメイン内の構造変化を入力信号として受け、逆行性キネシンだけにあるネックヘリックスのスイングへと変換する役割を果たしていました。そのスイングの向きが、逆行性モーターの動く向き(マイナス端側)を決めていることが分かりました(図3B)。
細胞分裂の際、複数の微小管が向きを揃えて平行に並び、紡錘体をつくります。このとき逆行性キネシンは、一方の微小管を足場として、もう一つの微小管をマイナス端方向に進めることで、紡錘体の形成・染色体の整列に貢献します。この逆行性キネシン特有の機能を支えているのは、ネックヘリックスのマイナス端へのスイングであることが明らかになりました(図4)。
今後の期待
今回の成果は、細胞分裂における染色体分配の分子メカニズムの解明、特に染色体分配時に形成される紡錘体の形成メカニズムの解明に大きく貢献する成果です。また、細胞分裂を制御するキネシン-14の高分解能構造解析は、それに結合する化合物のスクリーニングへと直接つながり、細胞分裂を制御する新たな抗がん剤設計への応用が期待できます。
また、ナノマシンの設計戦略への応用も期待できます。同じ動力部を持ちながら方向性を制御できるナノマシンは、ドラッグデリバリーなどの新たな戦略として利用される日がくるかもしれません。
原論文情報
- Masahiko Yamagishi, Hideki Shigematsu, Takeshi Yokoyama, Masahide Kikkawa, Mitsuhiro Sugawa, Mari Aoki, Mikako Shirouzu, Junichiro Yajima & Ryo Nitta, "Structural basis of backwards motion in kinesin-1–kinesin-14 chimera: implication for kinesin-14 motility", Structure, doi: 10.1016/j.str.2016.05.021
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 構造・合成生物学部門 構造生物学グループ タンパク質機能・構造研究チーム
上級研究員 仁田 亮(にった りょう)
東京大学大学院 総合文化研究科 広域科学専攻 生命環境科学系
准教授 矢島 潤一郎(やじま じゅんいちろう)
 仁田亮上級研究員
仁田亮上級研究員
 矢島潤一郎准教授
矢島潤一郎准教授
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
東京大学教養学部等事務部
総務課 広報・情報企画係
koho-jyoho [at] adm.c.u-tokyo.ac.jp(係宛)(※[at]は@に置き換えてください。)
補足説明
- 1.分子モーター
細胞内でアデノシン三リン酸(ATP)の分解で生じる化学エネルギーなどを用いて、力学的な仕事をする分子の総称。キネシンの他に、筋肉の運動を担うミオシンや、繊毛・鞭毛の動きを担うダイニンなどがある。 - 2.キネシン-14
キネシンは細胞骨格である微小管の上を移動する分子モーター。細胞分裂や、軸索輸送などの細胞内物質輸送に重要な働きをしている。キネシンは遺伝子ファミリーとして存在し、ヒトやマウスでは45種類の遺伝子が見つかっている。キネシン-14はキネシンファミリーの一つ。 - 3.紡錘体
真核生物の細胞分裂時に形成される分裂装置の一つで微小管により形成される。微小管の上を移動するキネシンは微小管を紡錘形に配列したり、染色体を二つの娘細胞に分配したりする役割を担う。 - 4.微小管
細胞骨格の一つ。キネシンやダイニンを含むモータータンパク質による能動輸送のレールとして機能するため、分子や液胞などの移動の足場、細胞分裂の時には紡錘体を形成し染色体の移動を担っている。α/β-チューブリンニ量体が縦方向に重合した13本の素繊維が筒状に束ねられて形成される直径約25nmの繊維状構造をとる。 - 5.プラス端、マイナス端
微小管は構造的に非対称でプラス端とマイナス端の“向き”がある。α/β-チューブリンニ量体が付加・解離しやすい側をプラス端という。マイナス端を中心体に置き、重合の場であるプラス端を細胞内のさまざまな領域に伸ばすことが多い。この向きを利用して、モータータンパク質が物質を正しい方向に運ぶ。細胞の中では微小管の向きと場所が正しく配置されて適切な物質輸送が可能となる。 - 6.アミノ末端、カルボキシ末端
タンパク質は、アミノ酸同士がカルボキシル基(-COOH)とアミノ基(-NH2)の間のペプチド結合とにより直鎖状に連なった一次構造をしている。両端には他のアミノ酸との結合に使われないカルボキシル基(カルボキシ末端;C末端)、またはアミノ基(アミノ末端;N末端)が存在する。メッセンジャーRNA(mRNA)からタンパク質が合成される反応は、アミノ末端側からカルボキシ末端側に向けて進行する。 - 7.クライオ電子顕微鏡
タンパク質などの生体試料を観察するために開発された電子顕微鏡。タンパク質複合体(試料)を含んだ溶液を薄く展開し、液体エタン(-183℃~-160℃)中で急速凍結して試料をごく薄い氷の層に閉じ込めた上、液体窒素温度(-196℃)で電子顕微鏡により観察する。試料を染色固定する方法に比べてニつの利点がある。第1は低温で電子線を照射するためタンパク質試料の電子線による損傷が軽減される。第2はタンパク質試料を生理的(自然な)な溶液条件で観察できる。 - 8.X線結晶解析
物質の結晶をつくり、それにX線を照射して回折データを解析することにより、物質の内部構造を調べる方法。タンパク質の構造を原子レベルの分解能で詳細に解明するための最も有力な方法の一つである。 - 9.ナノマシン
ナノメートル(nm、1nmは10億分の1メートル))サイズの部品で構成された機械。モーター分子をはじめとするタンパク質は、ナノマシンの部品として有望と考えられている。
参考:2015年8月26日プレスリリース「人工的に設計したタンパク質による金属ナノ結晶の生成」
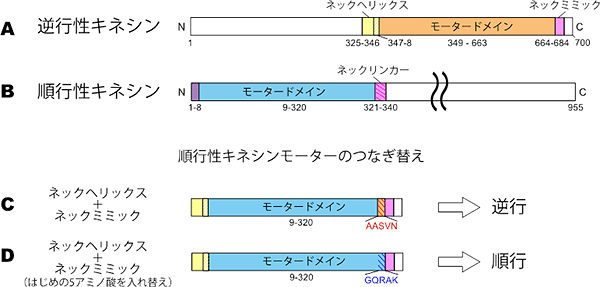
図1 キネシンのドメイン構造
キネシンのドメイン構造の模式図。左側がアミノ末端(N)、右側がカルボキシ末端(C)を指し、数字はアミノ末端から数えたアミノ酸の位置を示す。A、Bはそれぞれ、野生型の逆行性キネシンと順行性キネシン。Cは、順行性キネシンのモータードメインに、逆行性キネシン特有のネックヘリックスとネックミミックをつないだもので、この場合は逆行性となった。Dは、Cからさらにネックミミックのはじめの5個のアミノ酸(AASVN、アラニン-アラニン-セリン-バリン-アスパラギン)を順行性キネシンのネックリンカーのもの(GQRAK、グリシン-グルタミン-アルギニン-アラニン-リシン)に入れ替えたもので、動きは順行性となった。
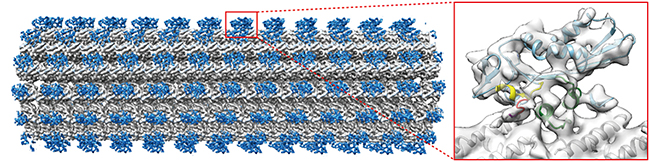
図2 逆行性キネシン–微小管複合体のクライオ電子顕微鏡による構造解析
左:白く太いロープのように見えるのが微小管。青で示した逆行性キネシン(キネシン-14)が、微小管の上をマイナス端(左側)へ移動する。
右:キネシン-14の拡大図。
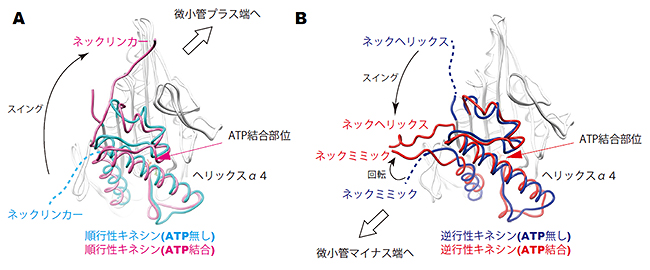
図3 順行性キネシンと逆行性キネシンのモータードメインのATP結合に伴う構造変化
A:順行性キネシン。ATP結合に伴ってネックリンカーが微小管のプラス端方向へスイングする。
B:逆行性キネシン。ATP結合に伴ってネックヘリックスが微小管のマイナス端方向へスイングする。ネックミミックは、ヘリックスα4とネックへリックスとの間に位置しており、ネックミミックの回転がネックヘリックスのスイングを誘導する。
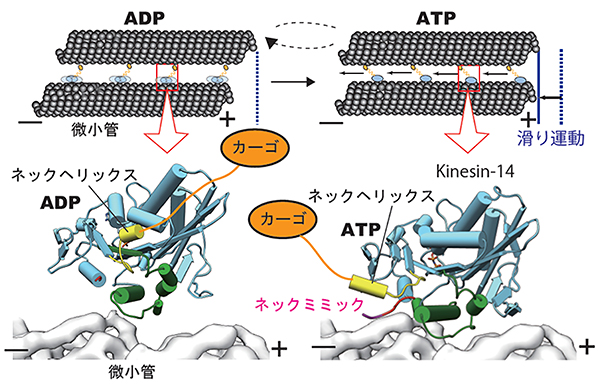
図4 逆行性キネシンの動作メカニズム
上:紡錘体を形成する微小管は、マイナス端とプラス端の向きが揃った状態で平行に並んでいる。このとき逆行性キネシンは、モータードメイン(青色)が一方の微小管に結合し、ネックヘリックスの先にあるカーゴ(※)結合ドメイン(黄色)で別の微小管と相互作用している。
※カーゴ:膜小器官やタンパク質などの「荷物」
下:逆行性キネシンは、ATP結合時にネックヘリックスを微小管のマイナス端へスイングするため、これに伴ってカーゴ結合ドメインに結合した微小管がマイナス端への滑り運動を起こす(一方の微小管が他方の微小管に沿って滑り込む)。ATPが加水分解されてADPになると、モータードメインは微小管から外れて、ネックヘリックスの位置が元に戻る。この繰り返しにより、細胞分裂における染色体の整列を牽引する。
