要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター細胞機能評価研究チームの田村泰久上級研究員、片岡洋祐チームリーダーと健康・病態科学研究チームの高橋佳代上級研究員、渡邊恭良チームリーダーらの共同研究チーム※は、陽電子放射断層画像法(PET)[1]を用いて、ラットにおける「神経新生」の生体イメージングに成功しました。
神経細胞のもととなる神経幹細胞[2]が、神経細胞へと分化することを神経新生と呼びます。ヒトを含めた哺乳類の場合、神経新生は主に胎生期から幼年期にみられます。一方、成体の脳には神経幹細胞は存在せず、新たな神経細胞は産生(再生)されないと考えられてきました。しかし成体でも、脳の限られた領域(側脳室周囲―嗅球[3]および海馬[4])でのみ神経新生が一生涯にわたって起こることが、近年、明らかになりました。中でも海馬は記憶・学習に重要な領域の一つであるため、ここでの神経新生が記憶・学習過程に深く関わっていることが分かっています。また、うつ病やアルツハイマー型認知症などの精神・神経疾患において、海馬での神経新生が低下する一方、抗うつ薬(選択的セロトニン再取り込み阻害剤:SSRI[5]など)の投与により神経新生が回復することが知られています。したがって、生きた個体での神経新生を生体イメージングすることができれば、記憶・学習などの脳機能を客観的に評価でき、さらにうつ病などの診断にも利用できる可能性があります。しかし、これまでヒトを含めた哺乳類での神経新生の定量的な生体イメージング法は確立されていませんでした。
今回、共同研究チームは、神経新生を検出するためのPETプローブである「[18F]FLT(フルオロチミジン)[6]」と、[18F]FLTを脳内に効率よく到達させるための薬剤「プロベネシド[7]」を併用することにより、定量性に優れた神経新生の生体イメージング法を開発しました。この手法を用いて、正常ラットとうつ病モデルラットの海馬での神経新生の変化を測定しました。その結果、うつ病モデルラットでは、海馬への[18F]FLT集積が低下していることが分かりました。さらに、うつ病モデルラットに抗うつ薬のSSRIを投与したところ、海馬への[18F]FLTの集積が正常レベルまで回復することが明らかになりました。これは、PETを用いた神経新生の生体イメージングが、うつ病診断および抗うつ薬の治療効果判定の指標として活用できることを示しています。
本研究は、米国の科学雑誌『The Journal of Neuroscience』に掲載されるのに先立ち、オンライン版(8月3日付け)に掲載されました。
※共同研究チーム
理化学研究所 ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門
イメージング機能研究グループ 細胞機能評価研究チーム
上級研究員 田村 泰久(たむら やすひさ)
テクニカルスタッフ 高田 孔美(たかた くみ)
テクニカルスタッフ 江口 麻美(えぐち あさみ)
研究員 大和 正典(やまと まさのり)
研究員 久米 慧嗣(くめ さとし)
大学院リサーチ・アソシエイト 中野 真行(なかの まさゆき)
チームリーダー 片岡 洋祐(かたおか ようすけ)
イメージング応用研究グループ 健康・病態科学研究チーム
上級研究員 高橋 佳代(たかはし かよ)
チームリーダー 渡邊 恭良(わたなべ やすよし)
背景
神経細胞は、神経細胞のもととなる神経幹細胞から生じます。神経幹細胞が分裂、分化して新たな神経細胞が生まれることを「神経新生」と呼び、ヒトを含めた哺乳類では主に胎生期から幼年期にみられます。一方、成体の脳には神経幹細胞は存在せず、新たな神経細胞は産生(再生)されないと考えられてきました。
しかし近年の研究から、哺乳類の成体脳においても、限られた領域(側脳室周囲―嗅球および海馬)でのみ、神経新生が一生涯にわたって起こることが明らかになりました。
中でも海馬は記憶・学習に重要な領域の一つであるため、海馬での神経新生は記憶・学習の形成過程に必須であることが分かっています。また、うつ病やアルツハイマー型認知症などの精神・神経疾患において、海馬での神経新生が低下する一方、抗うつ薬(選択的セロトニン再取り込み阻害薬:SSRIなど)の投与により神経新生が回復することが知られています。記憶・学習実験が可能な齧歯(げっし)類(ネズミなど)をはじめとし、サルやヒトなどの霊長類における神経新生を、脳組織を傷つけず定量的に生体イメージングすることができれば、海馬の機能と神経新生の関係を生きた個体で継続的に測定できます。さらにヒトへの応用として、神経新生の定量的な生体イメージングがうつ病診断の一つの指標となる可能性や、抗うつ薬の治療効果判定に利用できる可能性もあります。
しかし、海馬は脳の深部に存在し、脳組織を傷つけずに観察することは極めて困難なため、神経新生の定量的な生体イメージング法は確立されていませんでした。そこで共同研究チームは、ヒトへの応用が比較的容易な陽電子放射断層画像法(PET)を利用して、ラットの海馬における神経新生を、脳組織を傷つけずに定量的に生体イメージングする手法の確立を試みました。
研究手法と成果
共同研究チームはPETによる撮像を行う際、神経新生を検出するためのPETプローブとして「[18F]FLT(フルオロチミジン)」を用いることを検討しました。[18F]FLTは分裂細胞に取り込まれる性質があるため、脳におけるそのPETシグナル(18Fが体内で崩壊して放出されるγ線)は神経幹細胞の存在を示すからです。しかし、静脈注射で[18F]FLTを血中に導入しても、脳内に十分な量が到達しないため、このままでは定量的な生体イメージング法には利用できませんでした。
共同研究チームは脳内に十分な量の[18F]FLTが到達しないのは、血液脳関門[8]に存在する薬物トランスポーター[9]に原因があるのではないかと考えました。そこで、ラットにさまざまな薬物トランスポーターの阻害剤を投与し、オートラジオグラフィ法[10]を用いて、[18F]FLTの脳内到達量が増加するかを調べました。その結果、薬物トランスポーターの一種MRP[9]の阻害剤である「プロベネシド」が[18F]FLTの脳内到達量を増加させ、神経新生が起こる側脳室の周囲および海馬での[18F]FLT集積を上昇させる効果を持つことが分かりました(図1)。
次に、プロベネシドが生きたラットのPET撮像においても、同様の効果を持つか調べました。その結果、プロベネシドは生きたラットでも神経新生が起こる側脳室の周囲および海馬での[18F]FLT集積を増加させることが、PET画像においても明らかとなりました(図2)。
これらの結果は、PETプローブとして[18F]FLTを利用し、同時に[18F]FLTを脳内に効率よく到達させるための薬剤・プロベネシドを併用することにより、ラット海馬における神経新生を脳組織を傷つけずに定量的に生体イメージングできることを示しています。
これまでにラットやマウスを使った免疫組織化学染色法[11]による実験で、海馬での神経新生は抑うつ時に低下することや抗うつ薬投与により増加することが分かっています。免疫組織化学染色法では高倍率・高精度に神経新生を観察できますが、組織切片を作製しなければならないため、観察対象の脳を取り出す必要があります。そのため、発症前後や薬剤投与前後の神経新生を同一個体で比較することはできませんでした。
共同研究チームは、確立した神経新生の生体イメージング法が、うつ病モデルラットおよび抗うつ薬投与ラットでの神経新生の変化を定量的に検出できるか検証しました。その結果、うつ病モデルラット群は、海馬での[18F]FLT集積が対照群と比較して有意に低下することが明らかになりました。さらに、うつ病モデルラット群に抗うつ薬のSSRIを投与すると、海馬への[18F]FLT集積が対照群と同等まで回復することも分かりました(図3)。
以上の結果は、本研究で確立したPET撮像法が、生きた個体における神経新生の変化を定量的に検出できる生体イメージング法であることを示します。
今後の期待
PETを用いたラット脳における神経新生の生体イメージングに成功したことで、今後、ヒトでの神経新生の生体イメージング法の確立が期待できます。例えば、ヒトの海馬での神経新生をPET診断することで、記憶・学習などの脳機能を間接的に計測できる可能性があります。これにより、記憶・学習に効果があるとされる健康食品やサプリメントなどの効果を、客観的にヒトで評価するなどの応用が考えられます。また、うつ病診断や抗うつ薬の治療効果判定の一つの指標として、今回のPET撮像法を画像診断に用いることが期待できます。
原論文情報
- Yasuhisa Tamura, Kayo Takahashi, Kumi Takata, Asami Eguchi, Masanori Yamato, Satoshi Kume, Masayuki Nakano, Yasuyoshi Watanabe, Yosky Kataoka, "Noninvasive Evaluation of Cellular Proliferative Activity in Brain Neurogenic Regions in Rats under Depression and Treatment by Enhanced [18F]FLT-PET Imaging", The Journal of Neuroscience, doi: 10.1523/JNEUROSCI.0220-16.2016
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング機能研究グループ 細胞機能評価研究チーム
上級研究員 田村 泰久(たむら やすひさ)
チームリーダー 片岡 洋祐(かたおか ようすけ)
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング応用研究グループ 健康・病態科学研究チーム
上級研究員 高橋 佳代(たかはし かよ)
チームリーダー 渡辺 恭良(わたなべ やすよし)
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.陽電子放射断層画像法(PET)、PETプローブ
陽電子を放出する11Cや18Fなどの放射性同位体を薬などの分子に組み込んで個体に投与し、体内で崩壊して放出されるγ線を測定してその分子の体内分布をみる方法。PETで投与する分子をPETプローブ、あるいはPET分子プローブと呼ぶ。PETはPositron Emission Tomographyの略。 - 2.神経幹細胞
神経系を構成する神経細胞やグリア細胞に分化できる能力と、自己複製により神経幹細胞を増やす能力を併せ持つ細胞。 - 3.側脳室周囲―嗅球
側脳室は、大脳半球の内部に左右対称に存在する一対の空間で、脳脊髄液で満たされている。側脳室周囲は神経新生が起きる場所であり、新たに生まれた神経細胞は嗅球(嗅覚の感覚情報処理に関わる)へと移動することが分かっているため、このように表記される。 - 4.海馬
大脳側頭葉の内下部にあり、両側を合わせた形がギリシャ神話の海神がまたがる海馬に似ていることからこの名が付いた。両側を破壊すると記憶障害が起きることから、記憶に関与すると考えられている。また、学習においても重要な役割を担っていると考えられている。 - 5.選択的セロトニン再取り込み阻害薬:SSRI
セロトニンは神経伝達物質の一つで、本能行動、情動、認知機能に深く関連することが知られている。SSRIはうつ病の治療薬の一つとして多く用いられる医薬品であり、セロトニンの再取り込みを選択的に抑制することにより、シナプス間隙のセロトニン濃度を上昇させ、抗うつ効果を示すことが知られている。SSRIはSelective Serotonin Reuptake Inhibitorsの略。 - 6.[18F]FLT(フロオロチミジン)
[18F]FLTはチミジンの誘導体である3’-deoxy-3’-fluorothymidinede(FLT)を18Fで標識した化合物。FLT(または[18F]FLT)は細胞に取り込まれると、細胞内に発現するチミジンキナーゼ1によりリン酸化され、細胞内に留まる。チミジンキナーゼ1活性は、分裂細胞において亢進されるが、非分裂細胞ではほとんど認められない。したがって、FLTの細胞への集積はチミジンキナーゼ1活性を反映し、これをもとに細胞の分裂能を評価できる。 - 7.プロベネシド
腎臓において尿酸の再吸収を担う薬物トランスポーターを阻害し、尿酸の排泄を促進するため、痛風の治療薬として使われている化合物である。また、薬物トランスポーターであるMRPの阻害剤(基質)としても知られている。 - 8.血液脳関門
脳内血管と脳内細胞(神経細胞、グリア細胞)間の物質交換を制限する機構。脳に必要な物質を血液中から選択して脳へ供給するとともに、有害な物質の侵入を阻止する。血液脳関門には、多様なトランスポーター(輸送体)や受容体が発現し、協奏的に働くことによって、血液と脳実質間での物質輸送を厳密に制御している。 - 9.薬物トランスポーター、MRP
薬物トランスポーターは種々の組織に発現し、薬物の体内動態(吸収、分布、代謝、排泄)に重要な役割を果たす。MRP(Multidrug Resistance-associate Protein)は、代表的な薬物トランスポーターであるATP binding cassette(ABC)トランスポーターの一種で、グルクロン酸抱合体、グルタチン抱合体の代謝物などの比較的水溶性の高い化合物を基質とすることが知られている。プロベネシドにより機能阻害を受ける。 - 10.オートラジオグラフィ法
放射線を出す物質の分布や量を画像化する手法。PETプローブに用いた放射性同位体が減衰する前に組織切片を作製し、放射線で感光するフィルムに密着させることで、PETプローブの組織内蓄積を詳細に観察できる。 - 11.免疫組織化学染色法
組織切片を標的分子に対する抗体で染色し、その組織内での局在を解析する手法。
![オートラジオグラフィ法によるラット脳での [18F]FLT集積量の観察の図](/medialibrary/riken/pr/press/2016/20160830_1/fig1.jpg)
図1 オートラジオグラフィ法によるラット脳での[18F]FLT集積量の観察
ラットにプロベネシドとPETプローブの[18F]FLTを投与した後、脳を切り出してオートラジオグラフィ法で
[18F]FLTの脳内到達量を調べた。プロベネシドを投与しない場合(左画像)に比べて、プロベネシドを投与した場合(右画像)では、神経新生が起こる側脳室の周囲および海馬での
[18F]FLT集積が大きく増加した。写真は9枚の切片を脳の前側(左上)から順番に並べたもので、フィルムの露光時間はいずれも20分。
![PETによるラット脳での [18F]FLT集積量の観察の図](/medialibrary/riken/pr/press/2016/20160830_1/fig2.jpg)
図2 PETによるラット脳での[18F]FLT集積量の観察
ラットにプロベネシドとPETプローブの[18F]FLTを投与し、PETにより[18F]FLTの脳内到達量が増加するかどうかを調べた。プロベネシドを投与しない場合(左画像)に比べて、プロベネシドを投与した場合(右画像)では、神経新生が起こる側脳室(上段)でも海馬(下段)でも[18F]FLT集積が大きく増加した。それぞれのPET画像は、冠状断面(左上)、矢状断面(右上)、水平断面(左下)の三つの断面を示す。各画像の垂直のカラーバーは、PETシグナルの強さの分布を疑似カラーで示したSUV(standardized uptake value)。局所的なPETシグナルの強さがSUVのどの位置にあるかで、PETプローブの集積を評価できる。ここで示した全てのPET画像は、同じSUVに揃えてPETシグナルを表している。
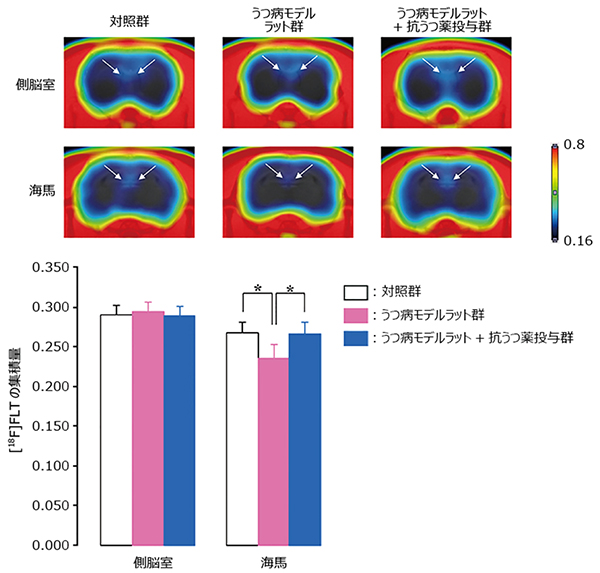
図3 PETによるうつ病モデルラットのモニタリング
上段:各群(対照群、うつ病モデルラット群、うつ病モデルラット+抗うつ薬投与群)における神経新生が起こる側脳室、海馬での[18F]FLT集積のPET画像。側脳室では変化がみられないが、海馬ではうつ病モデルラットでは[18F]FLT集積が減少し、抗うつ剤を投与すると対照群と同じくらいまで集積が増加した。
下段:各群(対照群、うつ病モデルラット群、うつ病モデルラット+抗うつ薬投与群)における神経新生が起こる側脳室、海馬での[18F]FLT集積量を定量的に表したグラフ。側脳室では3群で有意な差がみられないが、海馬ではうつ病モデルラットでは[18F]FLT集積量が1割ほど減少し、抗うつ剤を投与すると対照群と同じくらいまで集積が増加した。
*うつ病モデルラット群と比べて有意に変化した条件(p<0.05)
