要旨
理化学研究所(理研)放射光科学総合研究センター米倉生体機構研究室の米倉功治准主任研究員らの研究チーム※は、生体内のタンパク質などの機能発現を担う電荷情報を解析することができる高精度の構造解析手法を開発しました。
タンパク質の機能を明らかにするためには、立体構造を決める原子配置を解明することが非常に重要です。これまではタンパク質の結晶を作製し、「SPring-8[1]」などの放射光施設でX線回折測定を行うことが、構造決定の一般的な方法でした。しかし、重要な機能を持つ膜タンパク質[2]や巨大なタンパク質複合体は結晶作製が難しいことが問題になっています。一方、低温電子顕微鏡法の単粒子解析[3]では、タンパク質溶液を急速に凍結したものを電子顕微鏡で観察し、そこで得られた二次元分子像から画像の再構成を行うことで、立体構造を得ることができます。この手法では結晶を必要とせず生理的な溶液中のタンパク質の立体構造を明らかにできますが、これまで、得られる構造の空間分解能[4]が悪いという問題がありました。しかし、この状況はこの数年の急速な技術革新により大きく改善され、X線結晶構造解析に匹敵する高い空間分解能で構造が決定できるようになってきました。また、電子線はX線とは異なり、負の電荷を持つため、同じ原子でも、電荷を持つものと中性のもので、散乱のされ方が大きく異なります。電子線による構造解析では、電荷分布の情報を含む分子の三次元静電ポテンシャルマップ[5]が得られます。タンパク質などの生体分子が機能を発揮する上で、アミノ酸や金属イオンの電荷状態は大きな影響を及ぼすため、電荷情報は非常に重要です。
今回、研究チームは、電子線に対する原子の散乱因子[6]を精密化する手法を開発し、低温電子顕微鏡法により決定した構造から、その電荷分布の情報をより詳細に解析することに成功しました。
今後、開発した技術が荷電状態の精密化の汎用的な手法として確立されれば、生体分子の作動メカニズムをより深く解明することにつながり、生命科学の発展、新たな治療法や薬の開発、工学への応用などへの寄与が期待できます。
本研究は、科学技術振興機構(JST)先端計測分析技術・機器開発プログラム、日本学術振興会 科研費挑戦的萌芽研究、科学研究費補助金 基盤研究Bなどの支援を受けて実施されました。
本成果は、国際結晶学会発行の科学雑誌『Journal of Applied Crystallography』(10月発行 Vol.49)に掲載されるのに先立ち、オンライン版(8月24日付け:日本時間8月25日)に掲載される予定です。
※研究チーム
理化学研究所 放射光科学総合研究センター
米倉生体機構研究室
准主任研究員 米倉 功治(よねくら こうじ)
利用システム開発研究部門 生物試料基盤グループ
研究員 眞木 さおり(まき さおり)
背景
タンパク質の立体構造を決める手法として最も一般的なX線結晶構造解析では、研究対象のタンパク質の結晶を作製することが必要です。得られた結晶にX線を照射すると、結晶内のタンパク質分子を構成する原子の周りの電子によってX線が散乱され、回折パターンが得られます。この回折パターンの強度情報から計算した電子密度マップに基づいて、立体構造を決定します。この手法では、数マイクロメートル~百マイクロメートル(μm、1μmは100万分の1メートル)サイズの良質な結晶が必要です。しかし、重要な生命機能を担う膜タンパク質や巨大なタンパク質複合体の結晶作製は非常に難しく解析が困難です。
一方、電子顕微鏡を用いる手法では、結晶を必要とせず構造解析を行うことができます。電子線の波長はピコメートル(pm、1pmは1兆分の1メートル)程度と短く、光学顕微鏡に比べて格段に高い倍率で分子の拡大像が得られます。しかし、生体試料を観察するためには、その自然な状態を保つため、試料溶液を急速凍結して低温に保つことが必要です。二次元の電子顕微鏡像からその立体構造を決定するためには、さまざまな方向から観察した多数の分子像を集め、人体の内部構造可視化の技術として医療分野で広く用いられているCT(コンピュータートモグラフィー)法と同じ原理に基づいて、構造再構成の計算を行います。しかし、この低温電子顕微鏡の単粒子解析と呼ばれる手法で得られる分子像の信号対雑音比(S/N比)は非常に悪いため、膨大な数の像を集めても空間分解能が悪く、乏しい情報しか得られないといった問題がありました。
最近、電子線の検出カメラと統計に基づく画像解析の技術革新により、X線結晶構造解析に匹敵する空間分解能で大きなタンパク質の構造解析が可能になり、大きな注目を集めています。X線は、波長のごく短い光で電気的に中性であるのに対して、電子線は負の電荷を持っています。同じ原子でも電荷を持ったものと中性のものでは、散乱のされ方が大きく異なります。このため、電子線では試料の荷電状態を反映する情報「静電ポテンシャルマップ」が得られ、X線からは得ることができない、物質の荷電状態に関する情報を得ることができます。特に、アミノ酸や金属イオンの荷電状態は、タンパク質などが機能を発揮する上で大きな影響を及ぼします。そのため、電子線解析から得られる情報は非常に有益であると考えられますが、これまでその可能性はほとんど検討されてきませんでした。
研究手法と成果
研究チームは、まず、電子線に対する散乱因子を精密に求めるため、非線形の最適化アルゴリズム[7]を取り入れた計算ソフトウェアScatCurveを開発しました(図1左)。ScatCurveにより、さまざまな値の電荷を持つ原子の散乱因子を正確に求めることができるようになりました。
タンパク質は、20種類のアミノ酸が順番につながった鎖状の分子で、鎖が折り畳まれて複雑な三次元構造を形作ります。アミノ酸の中には、pH(酸性・アルカリ性の程度)が中性で、負の電荷を持つアスパラギン酸、グルタミン酸や、正の電荷を持つアルギニン、リジン、ヒスチジンがあります。これらの荷電アミノ酸では、複数の原子にわたって電荷が分布するため、原子1個が持つ電荷は±1より小さい値として扱う必要があります。しかし、この部分電荷の値は実験的に求められておらず、それを適切に取り扱う手法はありませんでした。
そこで、2015年に米倉准主任研究員らが開発した、三次元微小結晶の電子線結晶構造解析注1)で集めた回折データを基に、部分電荷の最適化とその解析手法の開発を行いました。その結果、有害な過酸化水素を分解する酵素であるカタラーゼの三次元微小結晶の電子線回折データから、実測データに対する原子モデルのエラーを最小化し、最適な部分電荷の値を決定することができました(図1右)。
さらに、この手法の実効性を確認するため、低温電子顕微鏡法の単粒子解析で解析された他のタンパク質の構造に適用しました。β-ガラクトシダーゼは、糖の一種ラクトース(乳糖)を分解する酵素で、単粒子解析により高い空間分解能で構造決定されています。この酵素の荷電アミノ酸や結合しているナトリウムイオン(Na+)やマグネシウムイオン(Mg2+)に開発した手法で電荷を与え構造精密化を行った結果、原子モデルのエラーが有意に減少し、実測データにより適合する原子配置のモデルを構築できることを示しました(図2)。
以上から、開発した手法の有効性と汎用性を確認し、実用的な手法として完成させることができました。
注1)2015年2月23日プレスリリース「微小で薄いタンパク質結晶の電子線構造解析」
今後の期待
今回開発した手法により荷電状態の精密化が可能になれば、生体分子の作動機構のより詳細な解明につながるため、その有用性は非常に大きいと考えます。今後、本成果を新しい基盤技術として確立することができれば、生命科学の発展や医療、創薬、工学などの分野への貢献が見込まれ、次世代の構造生命科学への寄与が期待できます。
原論文情報
- Koji Yonekura, Saori Maki-Yonekura, "Refinement of Cryo-EM Structures Using Scattering Factors of Charged Atoms", Journal of Applied Crystallography, doi: 10.1107/S1600576716011274
発表者
理化学研究所
放射光科学総合研究センター 利用技術開拓研究部門 米倉生体機構研究室
准主任研究員 米倉 功治(よねくら こうじ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.SPring-8
理研が所有する、兵庫県の播磨科学公園都市にある世界最高の大型放射光施設。SPring-8の名前はSuper Photon ring-8GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細く強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。タンパク質の結晶構造解析の分野でも、大きな成果を上げている。 - 2.膜タンパク質
細胞膜を構成しているタンパク質で、全ゲノムをコードするタンパク質の3分の1を占める。細胞膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。細胞外のシグナルを捕える受容体、細胞膜を介して物質の出入を担うチャネルやポンプ、細胞同士の結合に関わる接着分子など、生命活動に重量な役割を果たす。疾病に関連しているものも多く創薬の重要なターゲットとされるが、結晶化が難しく構造研究が最も進んでいない。 - 3.低温電子顕微鏡法の単粒子解析
生体分子を含む溶液を急速に凍結し、電子顕微鏡像から生体分子の立体構造を決定する構造解析手法。結晶格子に縛られない生理的イオン環境下の構造が得られるが、到達できる分解能は高くないことが問題であった。しかし、この状況はここ2~3年で大きく進展し、X線結晶構造解析に匹敵する分解能の構造が決定され、原子モデルの構築ができるようになってきた。この進展は、主として電子線直接検出型の量子検出効率のよい高速カメラの普及と、統計に基づく画像解析ソフトウェアの開発によりもたらされた。 - 4.空間分解能
分解能とは、どのくらい細かくものを“見る”ことできるかの目安。分解能が小さな値では細かく(分解能が高く)、大きな値では粗く(分解能が低く)なる。空間分解能が高いほど、物体をより精細に観測できる。原子の大きさは、1オングストローム(Å、1Åは100億分の1メートル)程度で、原子モデルの構築には、3.5Å程度の空間分解能が必要になる。 - 5.静電ポテンシャルマップ
分子の電位の分布。電子線散乱から得られる。X線回折からは、電子密度マップが得られる。 - 6.原子散乱因子
X線や電子線が原子に散乱される際の散乱曲線。散乱角(空間分解能)に対する強度として表され、原子種によって異なる。X線の散乱因子は、中性の原子と電荷を持つものでほとんど違いは無いが、電子線では両者は大きく異なる。 - 7.非線形の最適化アルゴリズム
加減算や定数のかけ算で表せる一次式(線形)の関係にないデータから、最適な解を推定するアルゴリズム。極所的な解に陥ることもあり、解法が難しいとされる。本研究では、電子線の原子散乱因子を表すパラメーターを求めるために、効率的で堅牢なレーベンバーグ・マーカート(Levenberg-Marquardt)法を用いた。
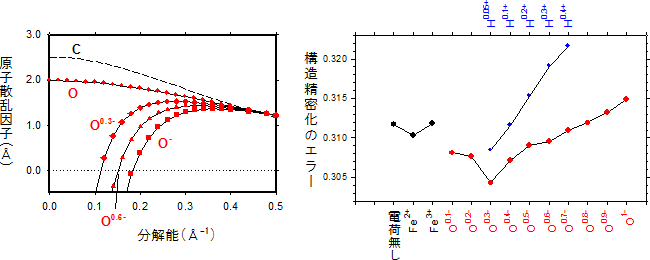
図1 電子線の原子散乱因子とさまざまな部分電荷を与えた際の構造精密化のエラー
左:中性の酸素原子(O)と酸素イオン(O-)では、電子の散乱因子が大きく異なる。グラフでは、0.3(O0.3-)と0.6(O0.6-)の負の部分電荷を持つときの散乱因子を重ねて表示した。開発したソフトウェアScatCurveにより計算した結果で、比較のために炭素原子(C)のカーブも表示している。
右:酵素カタラーゼの原子モデルの荷電アミノ酸、イオンに、さまざまな部分電荷を与えて構造精密化した際のエラー。エラー値が小さいほど、実測データと原子モデルがよく合うことを示す。
O0.3-のとき、最もエラーが小さくなることが分かった。
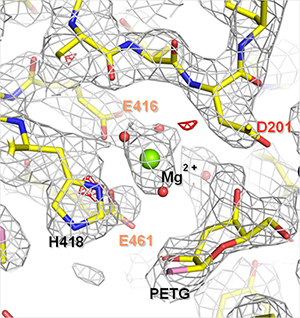
図2 β-ガラクトシダーゼの阻害剤(PETG)とマグネシウムイオン(Mg2+)結合部位の単粒子解析構造
電荷を与えて構造精密化した構造。静電ポテンシャルマップ(灰色の網目)と原子モデルがよく一致しているのが分かる。
Dはアスパラギン酸、Eはグルタミン酸、Hはヒスチジンを表す。
