要旨
理化学研究所(理研)光量子工学研究領域生細胞超解像イメージング研究チームの黒川量雄専任研究員、須田恭之客員研究員、中野明彦チームリーダーらの研究チーム※は、小胞体[1]からゴルジ体[2]へとタンパク質を輸送するCOPⅡ小胞[3]の制御因子Sar1が、生細胞内のどこに局在しているかを三次元イメージングで明らかにしました。
ヒトや酵母を含む真核生物の細胞内で新たに作られるタンパク質の約1/3は、細胞小器官[4]の小胞体で作られ、積荷タンパク質[5]としてCOPⅡ小胞に包まれてゴルジ体へ輸送されます。COPⅡ小胞は、小胞体のER exit sites(ERES)と呼ばれる特別な場所に集まり、COPⅡ小胞の膜の端は小胞体膜とつながっています。また、COPⅡ小胞は、低分子量GTPase(GTP加水分解酵素)[6]であるSar1の活性化によって形成され始めます。
一方で、Sar1が不活性化しないと、小胞体からゴルジ体へのタンパク質輸送が阻害されること、Sar1が小胞体膜に広く分布することが知られています。しかし、今までの光学顕微鏡での観察では解像度が低いため、ERESに集まったCOPⅡ小胞のどこにSar1が局在しているかは不明でした。
今回、研究チームは、多色・超解像・高速で蛍光イメージングが可能な「高感度共焦点顕微鏡システムSCLIM[7]」を用いて、生きた出芽酵母細胞内のCOPⅡ小胞のどこにSar1が局在しているかを高解像度三次元画像で詳しく観察しました。その結果、Sar1はCOPⅡ小胞の膜の端の小胞体膜とつながっている領域に局在し、その領域以外のCOPⅡ小胞の膜には局在しないことが分かりました。また、Sar1の局在は、Sar1自身の活性化・不活性化のサイクルによってもたらされることも明らかにしました。
細胞生物学にとって、タンパク質局在を明らかにすることは重要な課題です。今後、SCLIMを駆使し、生きた細胞内の三次元タンパク質局在情報のさらなる解明が期待できます。
本研究は、英国の科学雑誌『Journal of Cell Science』(9月1日号、日本時間9月2日付け)に掲載されます。
背景
生命の基本単位の細胞が生命活動を維持するには、多種多様なタンパク質がそれぞれ働くべき場所に運ばれ、機能することが必要です。ヒト、植物、酵母などの真核生物の細胞内には、多様な細胞小器官があります。その一つである小胞体では、細胞内で新たに作られるタンパク質の約1/3が合成されています。合成されたタンパク質は積荷タンパク質として、膜交通(小胞輸送)機構によりゴルジ体へと輸送されます。
積荷タンパク質が小胞体からゴルジ体へ輸送される基本的な仕組みは、全ての真核生物で共通しています。積荷タンパク質は、小胞体の特別な場所のER exit sites(ERES)に集まるCOPⅡ小胞(輸送小胞)に積み込まれた後、ゴルジ体へ輸送されます。COPⅡ小胞は小胞体から離れ細胞質内を漂い、積荷タンパク質を受け取るゴルジ体のシス槽へたどり着き、繋留され(つなぎとめられ)、そこでCOPⅡ小胞を被覆するタンパク質が離れた後にゴルジ体の膜と膜融合すると、これまで考えられていました。しかし、実際には、細胞質内を漂っているCOPⅡ小胞はほとんど観察されていません。
そこで研究チームは2014年、ゴルジ体の各槽(シス槽、メディアル槽、トランス槽)[2]が細胞質内に散在しダイナミックに動いている出芽酵母をモデル細胞に選び「高感度共焦点顕微鏡システムSCLIM」を用いて小胞体からゴルジ体への積荷タンパク質輸送の可視化を行いました。その結果、ゴルジ体のシス槽が小胞体上のERESのCOPⅡ小胞に接触し「ハグアンドキスアクション(hug-and-kiss-action、ゴルジ体の接触に続く繋留と膜融合)」が起き、積荷タンパク質がシス槽へ運ばれるという新しいモデルを提案しました(図1)注1)。
小胞体上でのCOPⅡ小胞形成とその後のゴルジ体への繋留と膜融合には、低分子量GTPase(GTP加水分解酵素)であるSar1が重要な役割を果たしています。Sar1は小胞体膜に広く分布し、COPⅡ小胞の形成開始には活性化したSar1が必要である一方、Sar1が不活性化しないとCOPⅡ小胞のゴルジ体への繋留と膜融合は達成されないことが知られています。しかし、今までの光学顕微鏡での観察では解像度が低いため、ERESに集まったCOPⅡ小胞のどこにSar1が局在しているかは不明でした。今回、研究チームは、生きた出芽酵母内のCOPⅡ小胞膜のどこにSar1が局在しているのかを可視化するため、その詳しい三次元イメージングの実現を目指しました。
注1)2014年4月14日プレスリリース「ゴルジ体シス槽は小胞体に接触し積荷タンパク質を受け取る」
研究手法と成果
研究チームは、多色・超解像・高速で蛍光イメージングが可能なSCLIMを用いて、生きた出芽酵母細胞内のSar1の局在解析を行いました。
まず、GFP(緑色蛍光タンパク質)で標識したSar1と、mRFP(赤色蛍光タンパク質)で標識したCOPⅡ被覆タンパク質Sec13を持つ出芽酵母株を作製しました。そして、出芽酵母の細胞膜周辺に存在する小胞体上のSar1-GFPの二次元局在変化を調べました。すると、Sar1-GFPは小胞体膜全体に分布していること、Sec13-mRFPで標識されるCOPⅡ小胞が集まるERES周辺でより強い蛍光シグナルを示すことが分かりました。
次にSar1の三次元局在を解析するために、Sar1-GFPとSec13-mRFPの高解像度三次元画像を得ました。Sec13-mRFPで標識されるCOPⅡ小胞はSar1-GFPが分布する小胞体膜の上にあり、一部の領域でSar1-GFPとSec13-mRFPのシグナルが重なっていることがわかりました(図2)。
さらに、三次元画像を解析しSar1がCOPⅡ小胞のどこに局在しているのかを調べました。その結果、Sar1はCOPⅡ小胞の膜全体には局在しておらず、COPⅡ小胞の膜の端にある小胞体膜とつながっている領域に限局していることが分かりました(図3)(図4)。
次に、このCOPⅡ小胞の膜におけるSar1の限局がどのような機構で制御されているかを解析しました。Sar1は、GTP(グアノシン三リン酸)と結合した活性化状態ではその構造が変化し、Sar1のN末端が小胞体膜に刺さることで小胞体膜全体に局在します。Sar1自身のGTPase活性によりGTPをGDP(グアノシン二リン酸)に加水分解すると、小胞体膜から遊離します。このように、Sar1は自身の活性化・不活性化のサイクル(GDP/GTPのサイクル)によって、膜への局在を変化させることが知られています。また、Sar1のGTPase活性の促進をCOPⅡ被覆タンパク質Sec23が担っていることから、Sar1のGDP/GTPのサイクルによる膜結合能変化が、COPⅡ小胞の膜におけるSar1の限局を制御しているのではないかと考えました。
そこで、研究チームは、GTPの加水分解ができないSar1の変異タンパク質Sar1H77Lを細胞内に誘導発現した出芽酵母株を作製しました。すると、この株ではSec13-mRFPの局在が凝集し“COPⅡ小胞が集まった異常な膜構造”を形成することが分かりました。続いてSar1H77LをGFPで標識し、この変異タンパク質の三次元局在を調べたところ、Sar1H77L-GFPはCOPⅡ小胞の膜の端領域に限局せず、COPⅡ小胞が集まった異常な膜構造全体に局在することが明らかとなりました(図5)。このことから、COPⅡ小胞膜上でのSar1のGTP加水分解による不活性化によって、COPⅡ小胞の膜の端領域へのSar1の限局が制御されていることが示されました。
今後の期待
本研究により、同じ膜構造の中でタンパク質局在が精密に制御されていることが明らかになりました。細胞生物学にとって、タンパク質局在を明らかにすることは重要な課題です。今後、SCLIMを駆使し、生きた細胞内の三次元タンパク質局在情報のさらなる解明が期待できます。
原論文情報
- Kazuo Kurokawa, Yasuyuki Suda, and Akihiko Nakano, "Sar1 localizes at the rims of COPII-coated membranes in vivo", Journal of Cell Science, doi: 10.1242/jcs.189423
発表者
理化学研究所
光量子工学研究領域 エクストリームフォトニクス研究グループ 生細胞超解像イメージング研究チーム
専任研究員 黒川 量雄(くろかわ かずお)
客員研究員 須田 恭之(すだ やすゆき)
チームリーダー 中野 明彦(なかの あきひこ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.小胞体
シート状またはチューブ状の膜からなる細胞小器官の一つ。粗面小胞体では膜交通で運ばれる積荷タンパク質の合成を行う。 - 2.ゴルジ体
扁平な袋(槽)からなる細胞小器官の一つでタンパク質の翻訳後修飾や仕分け、脂質の合成を行う。多くの生物種では積み重なった層板(スタック)構造をしている。積荷タンパク質を受ける側をシス槽、積荷タンパク質が仕分けされ出ていく側をトランス槽、その間の槽をメディアル槽と呼ぶ。 - 3.COPⅡ小胞
小胞体で新しく作られた積荷タンパク質を積み込む輸送小胞。COPⅡと呼ばれる被覆タンパク質により覆われている。 - 4.細胞小器官
真核細胞の内部に存在する一定の機能、形態をもつ膜構造の総称。 - 5.積荷タンパク質
膜交通(小胞輸送)で運ばれるタンパク質の総称。小胞体で作られる。 - 6.GTPase(GTP加水分解酵素)
GTPはグアノシン三リン酸のことで、生物体内に存在するヌクレオチドの一種。GTPaseは、GTPの高エネルギーリン酸エステルを加水分解し、GDP(グアノシン二リン酸)と無機リン酸を生成する酵素で、細胞内信号伝達に関わるGタンパク質などを含む大きな分子ファミリーを形成している。 - 7.高感度共焦点顕微鏡システムSCLIM
研究チームが独自開発した蛍光顕微鏡システム。スピニングディスク方式共焦点スキャナー、拡大レンズ、高性能のダイクロイックミラー、フィルターシステムによる分光器、冷却イメージインテンシファイアー(電子増倍管)と複数のEMCCDカメラシステムから構成される。複数蛍光の同時取得と高S/N比の蛍光画像取得が可能。SCLIMは、Super-resolution Confocal Live Imaging Microscopyの略。
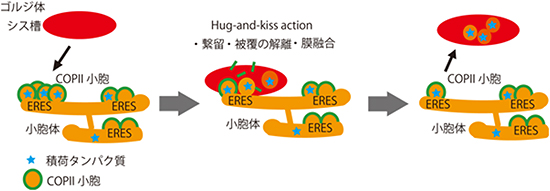
図1 新しい小胞体からゴルジ体への積荷タンパク質の輸送モデル
ゴルジ体のシス槽は①ERESのCOPⅡ小胞に接触し、②それによりCOPⅡ小胞のシス槽への繋留、被覆タンパク質の解離、小胞とゴルジ体の膜融合が起きる(Hug-and-kiss action)。その結果、③積荷タンパク質は小胞体からゴルジ体へ輸送される。
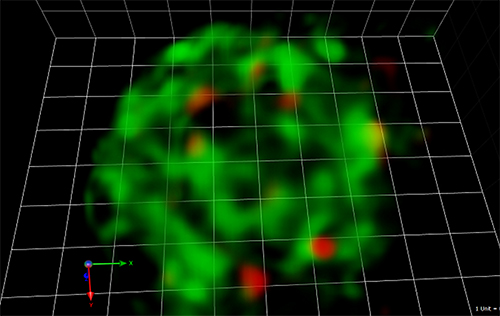
図2 Sar1-GFPとSec13-mRFPの三次元局在イメージング
緑色の部分は、小胞体膜上に局在するCOPⅡ小胞の制御因子Sar1。赤色の部分は、COPⅡ被覆タンパク質Sec13。COPⅡ小胞はSar1が局在する小胞体膜の上にあることが分かる。格子は1辺636ナノメートル(nm、1nmは10億分の1メートル)。
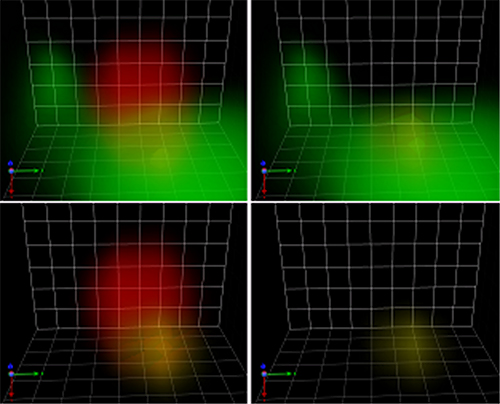
図3 Sar1-GFPとSec13-mRFPの三次元局在の高解像度画像
左上:緑の部分はCOPⅡ小胞の制御因子Sar1、赤の部分はCOPⅡ被覆タンパク質Sec13を示す。黄色の部分はSar1とSec13が共に局在している領域。
右上:左上の図からSec13(赤)だけの領域を取り除いた画像。緑の部分はSar1、黄色の部分はSar1とSec13が共に局在している領域を示す。
左下:左上の図からSar1(緑)だけの領域を取り除いた画像。赤の部分はCOPⅡ小胞、黄色の部分はSar1とSec13が共に局在している領域。
右下:左上の図からSar1とSec13が共に局在している領域を残した画像。Sar1は、COPⅡ小胞膜全体ではなく特定の箇所に局在していることが分かる。
格子の1辺は84nm。
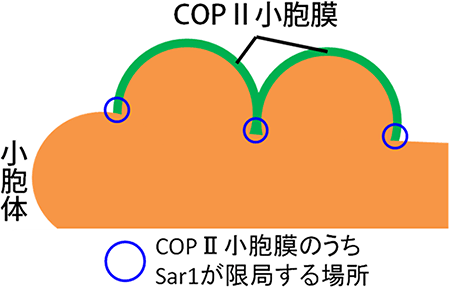
図4 COPⅡ小胞膜のうちSar1が限局する場所の模式的
Sar1はCOPⅡ小胞膜のうち、小胞体膜と接するCOPⅡ小胞膜の端に限局する
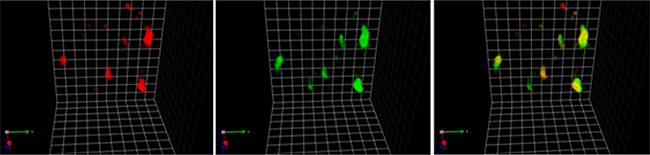
図5 活性化型Sar1-GFPとSec13-mRFPの三次元局在
左:COPⅡ被覆タンパク質Sec13-mRFP(赤)の三次元局在。COPⅡ小胞が集まった異常な膜構造となっている。
中:GTPの加水分解ができない活性化型Sar1H77L-GFP(緑)の三次元局在。
右:左と中の画像を重ね合わせたもの。活性化型Sar1H77L-GFPは、Sec13-mRFPで標識されているCOPⅡ小胞が集まった異常な膜構造全体に局在している。
格子の1辺は612nm。
