要旨
理化学研究所(理研)多細胞システム形成研究センター非対称細胞分裂研究チームの恒川雄二研究員、松崎文雄チームリーダー、米国ソーク生物学研究所の鈴木啓一郎研究員、ベルモンテ教授らの国際共同研究グループ※は、ゲノム編集ツールであるCRISPR-Cas9[1]システムを利用し、マウス・ラット生体内の神経細胞など非分裂細胞[2]でも有効な新しい遺伝子操作技術を開発しました。
近年、ゲノムの標的遺伝子を書き換える「ゲノム編集[3]」技術が急速に進歩し、ゲノム中の塩基配列を自由に選んで設計・改変することが可能な時代に入ってきました。ゲノム編集技術のさらなる発展は、医療・エネルギー・食品などさまざまな分野に大きな利益をもたらすと期待されており、次世代のバイオテクノロジーとして注目を集めています。しかし、既存の方法は、損傷を受けたゲノムDNAを修復する機構(DNA修復機構)の一種であり、細胞が分裂する最中に起こる「相同組換え」のしくみを利用してゲノム上の任意の場所に目的の遺伝子を挿入していたことから、生理的に細胞分裂をしていない細胞、すなわち生体内のほとんどの細胞にこの技術を適用することは困難でした。
そこで今回、国際共同研究グループは、非分裂細胞内においても活性を持つDNA修復機構を活用することで、非分裂細胞でもゲノムの標的配列を必要な配列に書き換えられるのではないかと仮説を立て、検証を行いました。そして、非分裂細胞にも適用可能なゲノム改変技術を開発し、「HITI(ヒティ)[4]」と名付けました。まず、HITI技術でヒトの分裂培養細胞において、従来法より約10倍高い効率で遺伝子挿入ができることが分かりました。次にHITI技術をマウス生体に応用し、脳、筋肉、心臓など全身のさまざまな組織や器官で、狙ったゲノム部位に必要な遺伝子を挿入することに成功しました。さらに、HITI技術を応用することで、網膜の視細胞の変性により進行性の視覚障害をきたす網膜色素変性症[5]ラットモデルの視覚障害を一部回復することに成功し、本技術を用いた医療応用への可能性を示しました。
今後本技術を用い、モデル動物の脳神経で直接遺伝子改変を行うことで、複雑な思考力をつかさどる脳機能の解明、脳の一部が関与する疾患メカニズムの解明につながると期待できます。また、成人の神経や筋肉や網膜など終末分化細胞に異常を持つさまざまな難治性遺伝病に対し、その原因となる異常遺伝子を病変部位で直接修復する医療への応用が期待できます。
本研究は、国際科学雑誌『Nature』に掲載されるのに先立ち、オンライン版(11月16日付け:日本時間11月17日)に掲載されます。
背景
“生命の設計図”と呼ばれる遺伝子をコードするゲノム情報を操作することにより遺伝子機能を解析する試みが、1970年代から行われてきました。近年ではゲノム配列をデザイン・改変する技術を「ゲノム編集」技術と呼び、基礎生物学に必須な技術として用いられています。
重篤な損傷であるゲノムDNAの二本鎖切断[6]を修復する機構として、生物はDNA二本鎖切断修復機構を先天的に備えています。この修復機構には、無傷な相同配列を鋳型として組換えを起こす「相同組換え[7]」(図1A左)と、相同配列に依存せず切断末端を直接結合する「非相同末端結合[8]」(図1A右)の、主に二つの経路が存在します。細胞が持つこれら二つの修復機構をうまく利用することで、狙ったゲノム上の塩基配列を書き換える「ゲノム編集」が可能となります。
具体的には、切断されたDNA末端を直接つなぎ合わせる際に、数塩基の欠失や挿入などのエラーが起こりやすい非相同末端結合経路による修復を利用することで、標的遺伝子の破壊「遺伝子ノックアウト[9]」ができます(図1B右)。一方、相同性を持つ外来DNA(ドナーDNA)を人為的に導入しておくと、相同組換え経路により誤ってゲノムに取り込まれますが、これを利用して標的配列を自由自在に改変する「遺伝子ノックイン[10]」が可能となります(図1B左)。
これらの遺伝子改変を効率よく行うために、ゲノムの標的配列のみを特異的に切断し、DNA二本鎖切断修復を人為的に引き起こすタンパク質「部位特異的ヌクレアーゼ[11]」が開発されてきました。部位特異的ヌクレアーゼの中でも特にCRISPR-Cas9は、特別な技術や設備がなくても作製可能なため、瞬く間に世界中のさまざまな分野の研究者がこの技術を活用するようになり、生命科学全般に大きな影響を及ぼしました。
非相同末端結合の機構を利用した遺伝子ノックアウト技術は、細胞周期に関わらずどんな状態の細胞でも利用できると考えられています。それに対して、既存の遺伝子ノックイン技術は、分裂の盛んな細胞で働く相同組換えを応用したものであるため、特に分裂する培養細胞やES細胞、iPS細胞では有効なツールとして幅広く利用されてきました。また、この技術を利用し、受精卵の段階でゲノム編集をすることで、任意の遺伝子操作を施した遺伝子改変動物の作製も可能となり、ヒトの病気を模倣した疾患モデル細胞や疾患モデル動物を人工的に作製することがより簡便にできるようになりました。
しかし、従来法の相同組換えによる遺伝子ノックインには“高い細胞分裂活性”が必要です。生体では、皮膚の表皮細胞や腸の上皮細胞などを除くほとんどの細胞、特に神経細胞や心筋細胞などは、生理的に細胞分裂を行っていません。そのため、成体のほとんどの部位では既存の遺伝子ノックイン技術を適用できず、次世代の技術として開発が期待されていました(図2)。
研究手法と成果
国際共同研究グループは、CRISPR-Cas9システムを用いて、相同組換え活性のみられない非分裂細胞内においても活性を持つ「非相同末端結合経路」を巧みに利用することで、非分裂細胞でもゲノムの標的配列を必要な配列に書き換えられるのではないかと仮説を立て、検証しました。これまで、分裂細胞で非相同末端結合経路を利用した遺伝子ノックイン技術の報告は数例ありましたが、詳細な解析はされておらず、応用できる細胞種の検討も行われていませんでした。本研究ではこれらの遺伝子ノックイン法を種々の細胞種で検討しました。また、非相同末端結合経路を利用した遺伝子ノックイン技術に対しては、誤った向きで目的の遺伝子が挿入されてしまうのを防ぐため、導入する遺伝子ベクターの遺伝子配列を工夫し、逆方向の挿入を抑制して安定的に遺伝子を目的の向きで目的の部位に挿入できるように設計しました(図3)。この方法は、相同配列を必要としない標的部位特異的な遺伝子ノックイン技術であることから、「HITI(ヒティ)」(Homology-Independent Targeted Integration)と名付けました。
まず始めに分裂する培養細胞を用いて、HITIと、相同配列を利用した既存の遺伝子ノックイン方法を比較検討しました。その結果、HITIは従来法と比べて10倍程度の高い効率で遺伝子ノックインを行うことが可能であることを見出しました。次に、相同組換え活性を必要としないことと、高い遺伝子ノックイン効率を活かして、従来の相同組換え法では不可能であった非分裂細胞である生後マウスの神経細胞での遺伝子ノックインを試みました。マウス胎児脳由来の神経細胞を培養し、同様にさまざまな遺伝子ノックイン方法を比較・検討したところ、HITIを用いた時のみ高効率(遺伝子導入細胞あたり最大60%)で、目的の部位に遺伝子が挿入されたことを確認しました。また、生きたマウス胎児の脳でも目的の部位への遺伝子挿入を確認しました。さらに、生体内での遺伝子導入に優れたアデノ随伴ウイルス(AAV)ベクター[12]を用いて、HITIシステムを細胞内に導入するHITI-AAVを作製しました。これを生きたままの成体マウスへ局所注射することにより、脳の一部など組織・器官の狙った部位のみ遺伝子ノックインすることに成功しました(図4)。また、HITI-AAVを静脈注射で投与すると、心臓、肝臓、筋肉など全身の組織・器官で標的配列を3~10%の細胞で改変できることを確認しました。
次に、本技術の遺伝性疾患治療に対する有効性を示すために、遺伝性疾患の「網膜色素変性症」のラットモデルへの応用を試みました。網膜色素変性症はまだ有効な治療法が確立されていない、網膜の視細胞が変性していく進行性の難病です。日本では4,000人~8,000人に1人という高い割合で発症するといわれています注1)。
生後3週齢の網膜色素変性症モデルラットの網膜下にHITI-AAVを直接投与して、疾患原因遺伝子の変異の修復を試みました。4-5週後に解析した結果、疾患原因遺伝子の発現および視覚障害の部分的な回復がみられ、従来の遺伝子ノックイン技術を用いた場合より有意に効果が高いことを確認しました。このことから、HITIは難治性遺伝病に対する新しい遺伝子治療法に応用できる可能性があるといえます。
注1)難病情報センターホームページより
今後の期待
本研究では、非分裂細胞における遺伝子ノックインに成功し、生きたままのマウス・ラットの体内の、さまざまな臓器などにおいて遺伝子改変を行うことが可能になりました。
ほ乳類の脳では数百、数千万もの神経が複雑にネットワークを作っています。全てのニューロンにおいて遺伝子改変を行っていた既存の動物モデルでは、それぞれの神経ネットワークを見ることや、細胞内に局所的に存在するタンパク質を観察することは、森の中から一本の木を見つけるように非常に困難な作業でした。開発したHITI技術により、成体脳の標的領域において神経細胞の一部を疎らに散在して遺伝子改変を行うことも可能となりました。これにより特定の神経細胞を活性化させるシステムを導入したり、神経ネットワークを可視化などの実現が期待できます。さらに、齧歯類以外のモデルほ乳類では、遺伝子ノックインによる遺伝子改変動物の作製例はありません。今後、HITIをよりヒトに近いモデル(霊長類など)の脳に応用することで、複雑な思考力をつかさどる脳機能の解明、脳の一部が関与する疾患メカニズムの解明につながると期待できます。
現時点では、HITIは成体内の一部の臓器で3~10%程度の細胞のゲノムを改変できる技術です。今後、HITIの分子機構の解明を行う事で更なる技術改良を加え、当該技術の遺伝子ノックイン効率の上昇を目指しています。その上で安全性を十分検討した後に、成人の神経や筋肉や網膜など終末分化細胞(分化の最終段階に達した細胞)に異常を持つさまざまな難治性遺伝病に対し、その原因となる異常遺伝子を病変部位で直接修復する医療への応用が期待できます。
※国際共同研究グループ
理化学研究所
多細胞システム形成研究センター非対称細胞分裂研究チーム
チームリーダー 松崎 文雄(まつざき ふみお)
研究員 恒川 雄二(つねかわ ゆうじ)
ソーク生物学研究所
ベルモンテ研究室(Gene Expression Laboratory-B)
教授 ファン カルロス イズピスア ベルモンテ(Juan Carlos Izpisua Belmonte)
研究員 鈴木 啓一郎(すずき けいいちろう)
研究員 レイナ ヘルナンデス-ベニテス(Reyna Hernandez-Benitez)
スタッフ研究員 ジュン ウー(Jun Wu)
研究員 畠中 史幸(はたなか ふみゆき)
研究員 山本 真子(やまもと まこ)
研究員 荒岡 利和(あらおか としかず)
研究員 栗田 昌和(くりた まさかず)
研究員 菱田 友昭(ひしだ ともあき)
研究員 モー リー(Mo Li)
技術員 相澤 絵美(あいざわ えみ)
技術員 エイプリル ゴーブル(April Goebl)
技術員 ルパ デビ ソリガラ(Rupa Devi Soligalla)
スタッフ研究員 コンセプシォン ロドリゲス エステバン(Concepcion Rodriguez Esteban)
キャラウェイ研究室(Systems Neurobiology Laboratories-C)
教授 エドワード M. キャラウェイ(Edward M. Callaway)
研究員 ユンセック J. キム(Euiseok J. Kim)
Scientific Core Facilities Senior Director's Office
シニアスタッフ研究員 W.トラヴィス ベリグレン(W. Travis Berggren)
カリフォルニア大学サンディエゴ校
シレイ眼科研究所・ゲノム医学研究所
教授 カン ジャン(Kang Zhang)
研究員 ジェ ズー(Jie Zhu)
大学院生 シン フー(Xin Fu)
研究員 ティンシュアイ ジャン(Tingshuai Jiang)
技術員 マーヤム ジャファリ(Maryam Jafari)
医科工学研究所
教授 クン ジャン(Kun Zhang)
大学院生 ジュー リー(Zhe Li)
研究員 シーチャン グォ(Shicheng Guo)
研究員 ソン チェン(Song Chen)
中国科学院
教授 グアンフイ リウ(Guang-Hui Liu)
教授 ジン チュ(Jing Qu)
アブデュラ王立工科大学
教授 ピエール マジストレッティ(Pierre Magistretti)
カトリック大学サンアントニオ·デ·ムルシア
教授 ペドロ ギージェン(Pedro Guillen)
研究主任 エストレジャ ヌニェス(Estrella Nuñez)
教授 ジェロニモ ラハラ(Jeronimo Lajara)
バルセロナ大学
教授 ジョセップ M. キャンピストル(Josep M. Campistol)
原論文情報
- Keiichiro Suzuki*, Yuji Tsunekawa*, Reyna Hernandez-Benitez*, Jun Wu*, Jie Zhu, Euiseok J. Kim, Fumiyuki Hatanaka, Mako Yamamoto, Toshikazu Araoka, Zhe Li, Masakazu Kurita, Tomoaki Hishida, Mo Li, Emi Aizawa, Shicheng Guo, Song Chen, April Goebl, Rupa Devi Soligalla, Jing Qu, Tingshuai Jiang, Xin Fu, Maryam Jafari, Concepcion Rodriguez Esteban, Travis Berggren, Jeronimo Lajara, Estrella Nuñez, Pedro Guillen, Josep M. Campistol, Fumio Matsuzaki, Guang-Hui Liu, Pierre Magistretti, Kun Zhang, Edward M. Callaway, Kang Zhang and Juan Carlos Izpisua Belmonte, "In vivo genome editing via CRISPR-Cas9 mediated homology-independent targeted integration", Nature, doi: 10.1038/nature20565
*These authors contributed equally to this work.
発表者
理化学研究所
多細胞システム形成研究センター 非対称細胞分裂研究チーム
研究員 恒川 雄二 (つねかわ ゆうじ)
米国ソーク生物学研究所
研究員 鈴木 啓一郎 (すずき けいいちろう)
 米国ソーク生物学研究所の主要メンバー
米国ソーク生物学研究所の主要メンバー左からJun Wu、Reyna Hernandez-Benitez、
鈴木啓一郎、Juan Carlos Izpisua Belmonte
 恒川雄二 研究員
恒川雄二 研究員
お問い合わせ先
理化学研究所 多細胞システム形成研究推進室 広報担当
Tel: 078-306-3310 / Fax: 078-306-3090
cdb-pr [at] cdb.riken.jp(※[at]は@に置き換えてください。)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.CRISPR-Cas9
外来性遺伝子に対する原核生物の獲得免疫機構のひとつであるシステム。Cas9タンパク質と、ガイドRNAと呼ばれる標的配列と相同な20塩基を含むshort RNAを共発現することで、核ゲノム内の標的配列を特異的に切断できる技術。clustered regularly interspaced short palindromic repeat (CRISPR)- CRISPR-associated protein 9(Cas9)の略。 - 2.非分裂細胞
神経細胞や心筋細胞など分裂を止めた細胞のこと。終末分化細胞とも呼ばれる。 - 3.ゲノム編集
ゲノム配列を改変する技術。近年では、CRISPR-Cas9などの部位特異的ヌクレアーゼを用いて改変したい標的配列に二本鎖切断を人工的に導入することで、効率よく標的遺伝子の配列を改変できる。 - 4.HITI
細胞が備えている非相同末端結合機構を利用し、外来DNAを標的配列に組み込ませる遺伝子ノックイン技術。本研究で名付け、生体内、特に非分裂細胞のゲノム編集に有効な技術であることを発見した。Homology Independent Targeted Integrationの略。 - 5.網膜色素変性症
網膜の視細胞の変性により徐々に視野が狭くなり、視力を失うこともある進行性遺伝性疾患。 - 6.DNA二本鎖切断
二本鎖DNAの両鎖が切断される重篤なDNA損傷。主に2つの二本鎖切断修復機構により修復される。 - 7.相同組換え
無傷な相同配列を鋳型として組換えを起こす、エラーの少ない二本鎖DNA修復機構のこと。 - 8.非相同末端結合
相同配列に依存せず切断末端を直接結合する二本鎖DNA修復機構のこと。 - 9.遺伝子ノックアウト
既知である遺伝子配列をもとにその遺伝子を破壊すること。これにより破壊された遺伝子の機能を推論できる。相同組換えで標的遺伝子に変異を入れるか、もしくは非相同末端結合で標的部位にランダムに欠失・挿入を入れることで標的遺伝子を破壊する。 - 10.遺伝子ノックイン
既知である遺伝子配列を基に、その遺伝子を改変し、新たな機能を持たせること。本研究以前では、相同組換えを利用することでのみ標的遺伝子の配列を任意の配列に改変することが可能であった。 - 11.部位特異的ヌクレアーゼ
CRISPR-Cas9に代表されるゲノムの標的配列のみを特異的に切断・改変するタンパク質。 - 12.アデノ随伴ウイルスベクター
ヒトに感染しても重篤な症状を引き起こさないアデノ随伴ウイルスを改良し、安全性に優れ且つ生体内のさまざまな細胞に高効率でDNAを導入できる遺伝子の運び屋。分裂細胞・非分裂細胞共にDNAを運搬することが可能である。
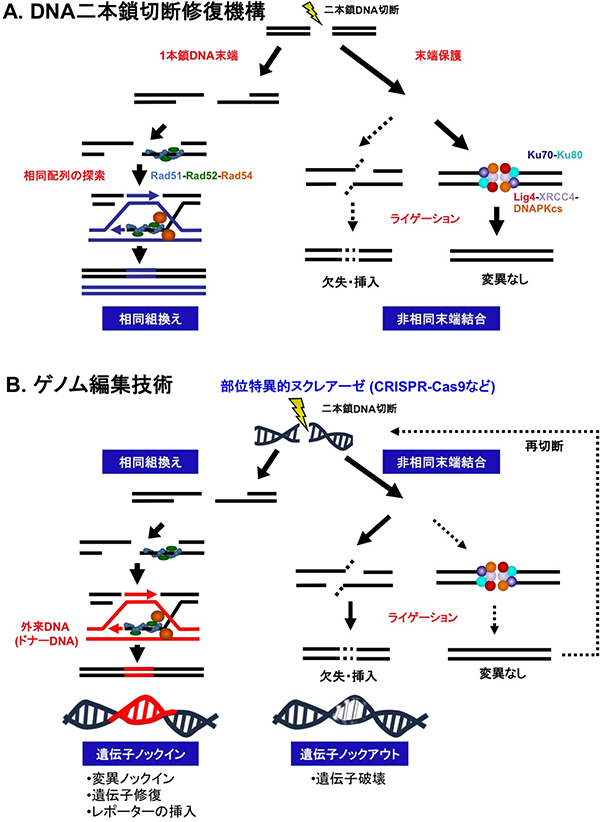
図1 DNA二本鎖切断修復機構と既存のゲノム編集技術
A. ゲノムDNAに二本鎖切断が起こると、生物はこれを修復する機構として、無傷な相同配列を鋳型として組換えを起こす相同組換え修復(左)と、相同配列に依存せず切断末端を直接結合する非相同末端結合修復(右)の機構を先天的に備えている。ライゲーションとは、DNAリガーゼ(本図中では赤丸で示したLig4)を用いてDNA分子を連結する反応を行うこと。
B. ゲノム編集技術はAのDNA二本鎖切断修復機構を利用することで、遺伝子ノックイン(変異ノックイン、遺伝子修復、レポーターの挿入、左)や遺伝子ノックアウト(遺伝子破壊、右)といった標的配列の改変ができる。
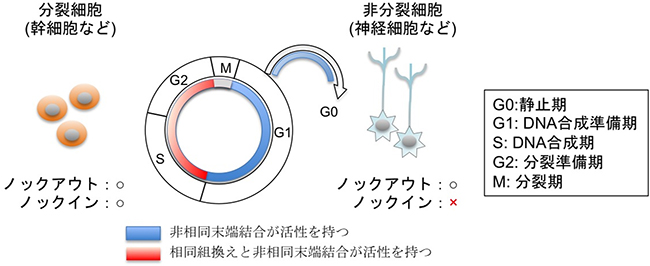
図2 細胞周期とゲノム編集技術
DNA二本鎖切断修復は、細胞周期に依存して二つの修復経路が働く。DNA複製後の姉妹染色体存在下(S-G2期、赤のライン)では相同組換えが活性化し、非相同末端結合も活性化する。G0/G1期(青のライン)では、非相同末端結合経路のみ働く。このため、神経細胞などの非分裂細胞は相同組換え活性を持たず、非相同末端結合による遺伝子ノックアウトは可能であるが、遺伝子ノックインの報告はなかった。
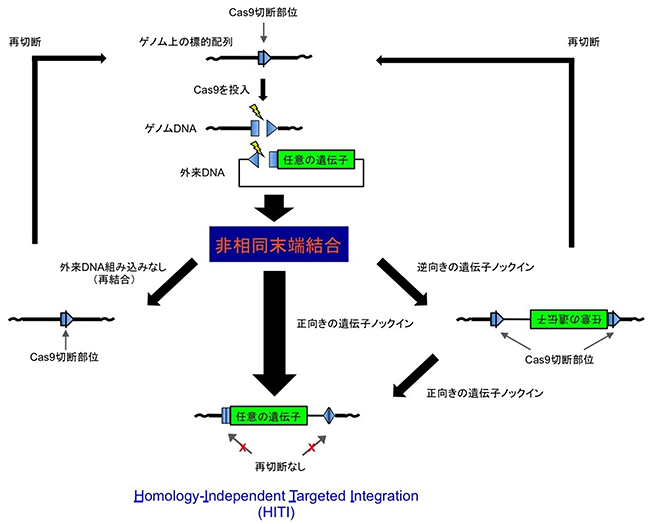
図3 非相同末端結合を利用したHITIの仕組み
ゲノム上の標的配列を切断するCRISPR-Cas9システムを利用したHITI法。挿入したい任意の遺伝子の隣に、ゲノム上の標的配列と同じ20塩基程度の長さの配列を逆向きに挿入した外来DNAを細胞に導入する。導入された外来DNA及びゲノムDNA部位の標的部位が、CRISPR-Cas9によって細胞内で同時に切断されることで、ゲノム標的部位と外来DNAが共にDNA損傷として認識され、非相同末端結合機構が切断断片を結合する事で、1)外来DNA組み込みなしの再結合、2)正向きの遺伝子ノックイン(HITI)、3) 逆向きの遺伝子ノックイン、のいずれかが起こる。1)と3)はCas9切断配列が再登場するため、最初のステップに戻る。結果的に2)のHITIが効率よく起こる。
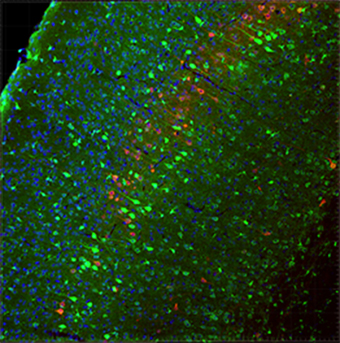
図4 HITIによる成体マウス脳のゲノム編集
ゲノム編集した成体マウスの脳の一部の染色写真。神経特異的に発現するTubb3遺伝子の下流に蛍光タンパク質GFPをHITI-AAVでノックインした。緑がノックインに成功した神経細胞を示している。
