要旨
理化学研究所(理研)構造生物学研究室の村松知成研究員と横山茂之上席研究員らの研究チーム※は、「重症急性呼吸器症候群(SARS)コロナウイルス[1]」の主要なペプチド結合加水分解酵素「3CLプロテアーゼ[2]」が基質(酵素が作用する物質)を認識する際に示す新たなアミノ酸配列特異性を発見しました。
SARSコロナウイルスはヒトの細胞に感染すると、自己複製のために必要なさまざまなタンパク質を合成します。その中には2種類の巨大なポリタンパク質があり、それぞれ1本のポリペプチド鎖(アミノ酸がペプチド結合でつながったもの)の中に複数のさまざまな酵素類を含んでいます。それら酵素の一つ、プロテアーゼ[2]はペプチド結合(-NH-CO-)の切断を通じて、さまざまなタンパク質のN末端[3]やC末端[3]を正しく形成する重要な働きをしています。この反応に関わる主要な3CLプロテアーゼはポリタンパク質の一部のため、自己の持つ酵素活性により切り出されて成熟型(活性型)となります。この作用を「自己プロセシング」と呼びます。自己プロセシングを機能させるために、3CLプロテアーゼは基質のポリタンパク質の中で自己のN末端側とC末端側の切断点付近のアミノ酸配列を厳密に認識しています。これまでの研究から、3CLプロテアーゼの基質認識メカニズムは全ての基質に対して同じであり、N末端側の切断部位の解析結果で、全てのメカニズムが説明できると考えられていました。
今回、研究チームはX線結晶構造解析[4]により、3CLプロテアーゼが自己プロセシングでC末端側を切断する際に、これまでと異なる認識様式で、他の切断部位ではみられないアミノ酸配列の特異性を利用していることを発見しました。さらに、C末端側で3CLプロテアーゼが認識するアミノ酸配列を、通常のN末端側で認識するアミノ酸配列に置き換えたところ、成熟型3CLプロテアーゼの活性が1/2に低下することが分かりました。つまり、C末端側での特殊な認識様式は生成する成熟型3CLプロテアーゼの活性にも有利であることを示しています。今回発見した特殊な認識様式と認識配列は、自己プロセシングの効率を低下させず、生成される成熟型3CLプロテアーゼのC末端領域の自己阻害活性を抑制する“SARSウイルスの巧みな戦略”であると考えられます。これを逆手にとれば、この自己プロセシングのみに用いられるメカニズムをターゲットとする極めて特異性の高い創薬の開発が期待できます。
成果は、米国の科学雑誌『Proceedings of National Academy of Science USA (PNAS)』に掲載されるのに先立ち、オンライン版(10月31日付け:日本時間11月1日)に掲載されました。
本研究は、文部科学省タンパク3000プロジェクト、文部科学省ターゲットタンパク研究プログラム、文部科学省及び国立研究開発法人日本医療研究開発機構創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)、JSPS科研費JP20570115の支援により行われました。
※研究チーム
理化学研究所
横山構造生物学研究室
上席研究員 横山 茂之 (よこやま しげゆき)
研究員 村松 知成 (むらまつ ともなり)
研究員 西井 亘 (にしい わたる)
研究員 寺田 貴帆 (てらだ たかほ)
ライフサイエンス技術基盤研究センター 構造・合成生物学部門
タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
副チームリーダー 竹本 千重 (たけもと ちえ)
生命分子システム基盤研究領域(研究当時)
研究員(研究当時) Yong-Tae Kim(ヨンテ・キム)
研究員(研究当時) Hongfei Wang(ホン・フェイ・ワン)
背景
2002~2003年にかけて中国南部の広東省を起源とした重症の非定形性肺炎が世界的規模で集団発生し、重症急性呼吸器症候群(SARS)として報告されました。原因は新型のコロナウイルスであることが突き止められ、2003年7月5日に終息宣言が出されました注)。
SARSコロナウイルスはヒトの細胞に感染すると、自己複製のために必要なさまざまなタンパク質を合成します。合成されるタンパク質には、2種類の巨大なポリタンパク質(分子量486 kDaおよび790 kDa)が含まれています。巨大なポリタンパク質は1本のポリペプチド鎖(アミノ酸がペプチド結合でつながったもの)の中に複数のさまざまな酵素類を含み、それぞれがウイルスの持つペプチド結合加水分解酵素(プロテアーゼ)によって切り出されます。
この反応に関与する主要なプロテアーゼは「3CLプロテアーゼ」です。3CLプロテアーゼはポリタンパク質の一部のため、自己の持つ酵素活性により切り出され、活性化されます。この作用を「自己プロセシング」と呼びます。
自己プロセシングを機能させるために、3CLプロテアーゼは基質(酵素が作用する物質)のポリタンパク質の中で自己のN末端側とC末端側の切断点付近のアミノ酸配列を厳密に認識しています。ただし、3CLプロテアーゼが認識するのは、切断点から上流(N末端側)1~4個のアミノ酸残基(P1~P4)と切断点から下流(C末端側)の1個のアミノ残基(P1')の範囲のみです。これまでの研究から、3CLプロテアーゼの基質認識メカニズムは全ての基質に対して同じであり、N末端側の切断部位の解析結果で、全てのメカニズムが説明できると考えられていました。
研究チームは今回、3CLプロテアーゼの基質認識メカニズムが全ての基質に対して同じなのか検証するため、C末端側の基質認識メカニズムを詳しく調べました。
注)国立感染症研究所ホームページより
研究手法と成果
プロテアーゼが認識する基質のアミノ酸残基の切断点からN末端側に向かってP1部位、P2部位、P3部位…、切断点からC末端側に向かってP1' 部位、P2' 部位、P3' 部位…と呼びます。それらに対応する酵素上の構造をそれぞれ、S1部位、S2部位、S3部位…、S1' 部位、S2' 部位、S3'… 部位と呼びます(図上段)。
N末端側の自己プロセシング配列結合構造では、3CLプロテアーゼが認識する基質(ポリタンパク質)のP1~P4部位とP1' 部位の5つのアミノ酸残基であることが既に分かっています。基質側の配列において最も重要なのはP1部位(グルタミン、Gln)で、次に重要なのがP2部位(ロイシン、Leu)です。
今回研究チームが調べたC末端側の自己プロセシング配列結合構造でも、基質のP4~P1部位とP1’部位と3CLプロテアーゼの結合がみられました。また、P1部位(Gln)と3CLプロテアーゼの(S1部位)の結合はN末端側の自己プロセシング配列の結合様式と全く同じでした。さらに、P2部位はLeu ではなくフェニルアラニン(Phe)ですが3CLプロテアーゼ(S2部位)と結合していました。
ところが、C末端側の認識においては、これまで3CLプロテアーゼが認識しないと考えられていたP3' 部位(Phe)と3CLプロテアーゼ(S3' 部位)との結合がみられました(図中段右)。N末端側の自己プロセシング配列結合構造でも、P3' 部位はPheですが、3CLプロテアーゼとは結合していません(図中段左)。C末端側の基質では、P2部位(Phe)とP3' 部位(Phe)の結合が3CLプロテアーゼ側の構造変化を起こし、P3' 部位のPheに対する“ポケット”を形成していました(図下段右)。一方、P2部位がLeuであるN末端側の自己プロセシング配列の結合では、3CLプロテアーゼ側にLeuに対応するポケットが形成されていました(図下段左)。C末端側の基質ではP2部位がPheなので、結合するために3CLプロテアーゼ側に構造変化が生じ、さらにP2部位のPheも加わって、P3’部位のPheに対応するポケットができたと考えられます。
また、研究チームは、新たに発見したC末端側の自己プロセシング配列特異性を生化学的手法により確認しました。切断点の前後にC末端側の自己プロセシング配列由来の10アミノ酸残基を持つ人工的な基質と3CLプロテアーゼを、大腸菌無細胞タンパク質合成系[5]で作製し、切断反応を調べました。その結果、P2部位がPheの基質では、P3' 部位のPheをアラニン(Ala)やアスパラギン(Asn)に置換すると、切断反応の効率が1/5に低下しました。次に、あらかじめP2部位のPheを、N末端側と同じLeuに置換したところ、P3' 部位をAlaおよびAsnに置換しても切断活性には影響がないことが分かりました。すなわちC末端側の切断には、P2部位がPheの場合にのみ、P3' 部位にアミノ酸残基の特異性が現れることが明らかになりました。
これまでは、N末端側のアミノ酸配列で全てのメカニズムが説明できると考えられ、基質としてP2部位がLeuのものしか研究されず、このようなアミノ酸配列の特異性は発見されませんでした。また、切断部位の配列比較(コンセンサス配列解析[6])によっても、このようなP2部位認識とP3'部位認識の“協同性”は見出すことは困難です。
さらに、C末端側の自己プロセシングにおけるP2部位のPheとP3'部位のPhe(Phe(P2)/Phe(P3'))の認識様式が、生成される成熟型3CLプロテアーゼの活性にどのような影響を及ぼすかを調べました。成熟型3CLプロテアーゼのC末端から4アミノ酸残基の領域は、自己プロセシングにおけるP1~P4残基で、P1~P4残基自体が3CLプロテアーゼの基質認識部位に結合する性質を持つため、阻害活性を持つ可能性があります。そこで、有機合成したテトラペプチド(4個のアミノ酸がつながったペプチド)で調べたところ、テトラペプチドにおいては、P2部位がLeuのものがPheのものよりも阻害活性が10倍高いこと(阻害定数Ki[7]が1/10)が分かりました。したがって、C末端側の自己プロセシング反応においてPhe(P2)/Phe(P3')の認識様式を用いることは、切断後のC末端領域の自己阻害効果を減らすことになります。実際、成熟型3CLプロテアーゼのC末端側のP2部位をLeuに置換した変異体は、酵素活性が1/2に低下しました。
以上から、今回見出された3CLプロテアーゼのC末端側の自己プロセシングにおける特殊な認識様式と認識配列は、自己プロセシングの効率を低下させず、生成される成熟型3CLプロテアーゼのC末端領域の自己阻害活性を抑制する“SARSウイルスの巧みな戦略”であるといえます。
今後の期待
今回見出されたSARSコロナウイルスの3CLプロテアーゼのC末端側の切断点付近における基質認識メカニズムは、生体内でのプロテアーゼでは一般的ではありません。そのため、特殊な基質認識メカニズムに対する阻害剤を開発すれば、特異的で副作用の少ない薬の開発につながると期待できます。
また、SARSコロナウイルスの近縁ウイルスには、MERSウイルス[8]、手足口病ウイルス[9]、ノロウイルス[10]など重要なウイルスがあります。それらのピコルナウイルス様(プロテアーゼ)スーパークラスター[11]に属するウイルスの3Cプロテアーゼまたは3CLプロテアーゼの基質特異性においても、自己プロセシングの際に特殊な基質認識メカニズムがある可能性があります。それらを詳しく調べることにより、新たな創薬開発に貢献すると期待できます。
さらに、認識部位間での協同性は、コンセンサス配列解析では検出できません。また、生化学的・酵素学的解析においても、あらかじめ協同性を想定しなければ見出すことはできません。今後、プロテアーゼの基質アミノ酸配列特異性の研究における新たな手法の開発が必要であると考えられます。
原論文情報
- Tomonari Muramatsu, Chie Takemoto, Yong-Tae Kim, Hongfei Wang, Wataru Nishii, Takaho Terada, Mikako Shirouzu, and Shigeyuki Yokoyama, "SARS-CoV 3CL protease cleaves its C-terminal autoprocessing site by novel subsite cooperativity", Proc. Natl. Acad. Sci. USA, doi: 10.1073/pnas.1601327113
発表者
理化学研究所
上席研究員研究室 横山構造生物学研究室
上席研究員 横山 茂之 (よこやま しげゆき)
研究員 村松 知成 (むらまつ ともなり)
 横山茂之
横山茂之
 村松知成
村松知成
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
日本医療研究開発機構(AMED)戦略推進部医薬品研究課
Tel: 03-6870-2219
20-DDLSG-16 [at] amed.go.jp(※[at]は@に置き換えてください。)
補足説明
- 1.重症急性呼吸器症候群(SARS)コロナウイルス
重症急性呼吸器症候群の病原体として同定されたコロナウイルス。プラス鎖の1本鎖RNAウイルスで、エンベロープ(ウイルス表面の膜状組織)に存在する突起によって太陽のコロナのような外観を持つ。通称SARSウイルスと呼ばれる。飛沫感染により広がると考えられている。SARSは Severe Acute Respiratory Syndromeの略。 - 2.3CLプロテアーゼ、プロテアーゼ
プロテアーゼはペプチド結合(-CO-NH-)を加水分解により切断する酵素の総称。動物、植物、バクテリア、古細菌、ウイルスなどに存在する。3CLプロテアーゼはライノウイルス3Cプロテーゼとの類似性から3CL(3C like)プロテアーゼと命名された。 - 3.N末端、C末端
タンパク質はアミノ酸同士が脱水縮合して形成されたポリマーであり、隣接するアミノ酸は、それぞれのアミノ基とカルボキシル基がペプチド結合(-NH-CO)をしている。このポリマーの末端のフリーのアミノ基側をN末端、カルボキシル基側をC末端と呼ぶ。 - 4.X線結晶構造解析
物質の結晶を作り、それにX線を照射して回折データを解析することにより、物質の内部構造を調べる方法。タンパク質の構造を原子レベルの分解能で詳細に解明するための最も有力な方法の一つ。 - 5.大腸菌無細胞タンパク質合成系
大腸菌の細胞内でタンパク質を合成させるのではなく、試験管内で、大腸菌細胞抽出液を用いて、タンパク質をコードするDNAから転写反応でmRNAの合成、その翻訳反応でタンパク質の合成を連続的に行わせる技術。 - 6.コンセンサス配列解析
核酸(DNA、RNA)やタンパク質について、機能に関する部分の共通の配列を推定する方法。同じ機能を持つ複数の分子種の塩基配列(核酸)やアミノ酸配列(タンパク質)を並べて比べることにより、その特徴を抽出する。 - 7.阻害定数(Ki)
酵素学的手法により得られる定数で、阻害効果の強さを表す。小さい方が強い。 - 8.MERSウイルス
中東呼吸器症候群の病原体であり、SARSコロナウイルスに似たコロナウイルス(ベータ型)で、2012年に英国ロンドンで確認された。死亡率が40~50%と高いのが特徴。MERSは Middle East respiratory syndromeの略。 - 9.手足口病ウイルス
主に乳児や幼児にみられる、手の平、足の裏、口内に水疱が発生する手足口病の病原体であり、コクサッキーウイルスの一種。 - 10.ノロウイルス
非細菌性急性胃腸炎を引き起こすウイルスの一属。プラス鎖の1本鎖RNAウイルスに分類され、エンベロープを持たない。 - 11.ピコルナウイルス様(プロテアーゼ)スーパークラスター
ピコルナウイルス科(コックサッキーウイルス、ライノウイルス、エンテロウイルス)、類縁のカリシウイルス科(ノロウイルス)、コロナウイルス科(SARS、MERS)は類似のプロテアーゼ3C/3CLプロテアーゼを持つことから、ピコルナウイルス様(プロテアーゼ)スーパークラスターと呼ばれる。
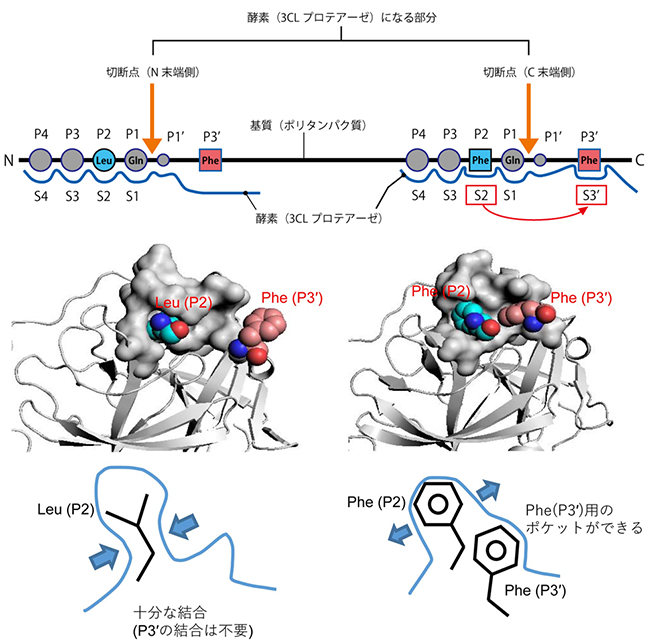
図 SARSコロナウイルスの3CLプロテアーゼによる自己プロセシング部位認識
上段: N末端側の自己プロセシング配列結合構造(左側)と新たに発見したC末端側切断点の自己プロセシング配列結合構造(右側)。基質(ポリタンパク質)の一部の領域を3CLプロテアーゼがN末端側切断点とC末端側切断点で切り出し、成熟型3CLプロテアーゼが作られる。
中段: 基質(ポリタンパク質)のP2部位およびP3'部位を表した空間モデル。3CLプロテアーゼを灰色、基質結合に関与する領域を表面モデル、それ以外をリボンモデルで表している。左側のN末端側の自己プロセシング配列では、P2部位がロイシン(Leu)、P3'部位はフェニルアラニン(Phe)である。それに対し、右側のC末端側の自己プロセシング配列では、P2部位とP3'部位の両方ともPheである。
下段:左がN末端側、右がC末端側。3CLプロテアーゼを青線、Leu(左)及びPhe(右)を黒線で表している。N末端側では、3CLプロテアーゼは基質のP2部位のLeuにしっかりと結合できるため、P3'部位との結合は必要ない。C末端側では、基質のP2部位のPheの結合により酵素側に構造変化が起こり、P2部位も加わりP3’部位用のポケットができる。
