要旨
理化学研究所(理研)統合生命医科学研究センターゲノムシーケンス解析研究チームの中川英刀チームリーダー、古田繭子研究員、和歌山県立医大外科学第2講座の山上裕機教授らの共同研究グループ※は、再発性または多発性肝臓がんの病変について全ゲノムシーケンス解析[1]を行い、発症した肝臓がんが、同じがん細胞に由来する転移による再発性のがんなのか、異なるがん細胞に由来する多発性がんなのかを、正確に診断できることを明らかにしました。
日本では、年間約4万人が肝臓がんと診断され、3万人以上が亡くなっています注1)。B型やC型肝炎ウイルスに感染すると、慢性肝炎から肝硬変を経て、高い確率で肝臓がんを発症します。慢性肝炎や肝硬変は強い発がんリスクがあるため、同じ肝臓内にがんが独立して多発する可能性があります(多発性発がん、多中心性発がん)。また、手術などの治療後に転移として同じ肝臓内に再発してくることが最も多いのも特徴です(肝内転移)。このように肝臓内に多発して肝腫瘍が出てくる場合が多いのですが、これらの肝臓がんが、肝内転移による再発性肝臓がんなのか、もしくは多発性(多中心性)肝臓がんなのかを、臨床情報、画像検査、病理検査によって正確に診断することはいまだ容易ではありません。
今回、共同研究グループは、23人の肝臓がんの患者から発生した49個の再発性または多発性肝臓がんの病変について、次世代シーケンサー(NGS)[2]を用いて全ゲノムの配列の解読を行い、同じ患者に発生した肝腫瘍で共通する体細胞変異の割合を調べました。その結果、同じ患者由来の二つまたは三つの腫瘍間で共通する変異が多い群(20~80%共通)と極めて少ない群(1%未満共通)とに明確に分かれ、共通する変異が多い群は肝内転移による再発性肝臓がん、少ない群は多発性(多中心性)肝臓がんと診断できました。このゲノム診断の結果と、手術前の臨床診断および病変の病理診断の結果は、約1/3の組み合わせで一致しませんでした。しかし、転移性腫瘍は原発巣と共通したゲノム異常を持つので、ゲノム診断がより正確であると考えられます。
再発性/多発性肝臓がんの正確な診断ができることによって、今後、再発性/多発性肝臓がんの治療方針が変わる可能性があります。
成果は、肝臓病専門の国際科学雑誌『Journal of Hepatology』のオンライン版(11月18日付け)に掲載されました。
注1)国立がん研究センターがん対策情報センター「日本のがん最新統計まとめ2013」より
※共同研究グループ
理化学研究所 統合生命医科学研究センター
ゲノムシーケンス解析研究チーム
チームリーダー 中川 英刀 (なかがわ ひでわき)
研究員 古田 繭子 (ふるた まゆこ)
和歌山県立医科大学 外科学第2講座
教授 山上 裕機 (やまうえ ひろき)
講師 上野 昌樹 (うえの まさき)
助教 速水 晋也 (はやみ しんや)
広島大学 大学院医歯薬保健学研究院 応用生命科学部門 消化器・代謝内科学
教授 茶山 一彰 (ちゃやま かずあき)
講師 川上 由育 (かわかみ よしいく)
東京大学 医科学研究所附属 ヒトゲノム解析センター
教授 宮野 悟 (みやの さとる)
背景
肝臓がんは、日本における部位別がん死亡者数で、男性では3位、女性では6位です。また、年間約4万人が肝臓がんと診断され、3万人以上が亡くなっています。主な原因は、B型肝炎ウイルス(HBV)またはC型肝炎ウイルス(HCV)の持続感染であり、慢性肝炎発症から肝硬変を経ると、高い確率で肝臓がんを発症します。アジア・アフリカでは、HBV感染による肝臓がんが約70%を占めていますが、日本の肝臓がんの主要因はHCV感染が約60%を占めています。
肝臓がんの10年生存率は日本では約15%です。外科的に切除できたとしても残った肝臓に再発や多発することが多く、再発例については再切除や動脈塞栓術、化学療法などが行われます。肝臓がん発生の原因である慢性肝炎や肝硬変は強い発がんリスクがあるため、同じ肝臓内にがんが独立して多発する可能性があります(多発性発がん、多中心性発がん)。これは、日本に多いC型感染からの肝臓がんの特徴です。また、肝臓がんは、手術などの治療後に転移として同じ肝臓に再発してくることが最も多いがんです(肝内転移)。原発巣から肝臓内の他の部位に転移をして、多発性の肝臓がんを発症する場合も多いです。しかし、このような再発または多発性の肝臓がんが、肝内転移による再発性か多発性なのかを、臨床情報、画像検査、切除標本の病理検査によって正確に診断することはいまだ容易ではありません。
近年のDNA解読技術の飛躍的な進歩に伴い、次世代シーケンサー(NGS)を用いて、さまざまな病気のゲノム変異を包括的に解析することが可能になってきています。がんはゲノム異常が蓄積することによって発症し進行する“ゲノムの病気”であり、世界中でがんの網羅的ゲノム解析やゲノム情報に基づく薬の開発・個別化医療が精力的に行われています。2008年、がんのゲノム変異の全容解明とカタログ化を目指し、世界最大規模のがんゲノム国際共同体である「国際がんゲノムコンソーシアム(ICGC)」が発足しました。共同研究グループもICGCに参加し、肝臓がんのゲノム解析を担当し、300例の肝臓がんの全ゲノムを解読するなど研究を進めてきました注2)。そして、ICGCや世界のがん研究機関、がん専門病院では、NGSと情報解析技術を利用した全ゲノムシーケンス解析研究が精力的に行われており、全ゲノムシーケンスが研究の分野のみならず、診断や個別化医療の分野においても、今後、重要な解析手法になるものと考えられております注3)。
注2)2016年4月12日プレスリリース「肝臓がん300例の全ゲノムを解読」
注3)2015年12月9日プレスリリース「がんの全ゲノムシーケンス解析の新たなガイドラインを作成」
研究手法と成果
共同研究グループはまず、23人の肝臓がんの患者から切除した49個の再発性または多発性肝臓がんの病変について、DNAとRNAを抽出し、NGSを用いて、それら腫瘍の全ゲノムの配列の解読を行いました。NGSによって算出された大量のデータは、東京大学医科学研究所のスーパーコンピュータ「Shirokane」を用いて解析されました。すると、一つの腫瘍には平均して約1万カ所の体細胞変異が検出でき、これらの情報をもとに、同じ患者に発生した肝腫瘍で共通する突然変異の割合を調べました(図1)。
その結果、同じ患者由来の二つまたは三つの腫瘍間で共通する変異が多い群(20~80%共通)と極めて少ない群(1%未満共通)と明確に分かれました(図2)。共通する変異が多い群は同じがん細胞由来のものと考えられ肝内転移による再発性肝臓がんと診断でき、極めて少ない群は多発性肝臓がん(別のがん細胞由来)と診断することができました(図1)。このゲノム診断の結果は、手術前の臨床情報(腫瘍の大きさ、位置、再発までの期間、血管浸潤の状態など)からの診断および切除標本の病理評価での診断結果とは、約1/3の組み合わせで一致していませんでした(図2)。しかし、転移性腫瘍は原発巣と共通したゲノム異常を持つものなので(同じがん細胞由来)、今回のゲノム解析での診断がより正確なものと考えられます。
今後の期待
肝内転移による再発性肝臓がんなのか、多発性(多中心性)肝臓がんなのかを正確に診断できることによって、今後、再発性や多発性の肝臓がんの治療方針が変わる可能性があります。転移の場合は、非常に予後が悪く、再度、肝臓や別の臓器に複数再発してくる可能性が高いため、切除後に積極的に全身化学療法などを行うことが考えられます。一方、多発性(多中心性)発がんの場合は、再度肝臓内に新規の初期肝臓がんが発生する可能性はあるものの、悪性度が低いがんのため、治療後に、予防的な化学療法は行わずに、経過観察や頻回の検査で対処していくことが考えられます。
また、今後、DNAシーケンス技術の革新に伴うコスト低下により、全ゲノムシーケンスが、研究分野のみならず、“ゲノムの病気”ともいえるがんのさまざまなフェーズでの診断や個別化医療の分野においても、標準的な検査手法、解析手法になるものと予測され、このようなゲノム情報を用いた正確ながんの診断手法が普及していくものと考えられます。
原論文情報
- Mayuko Furuta, Masaki Ueno, Akihiro Fujimoto, Shinya Hayami, Satoru Yasukawa, Fumiyoshi Kojima, Koji Arihiro, Yoshiiku Kawakami, Christopher P Wardell, Yuichi Shiraishi, Hiroko Tanaka, Kaoru Nakano, Kazuhiro Maejima, Aya Sasaki-Oku, Naoki Tokunaga, Keith A Boroevich, Tetsuo Abe, Hiroshi Aikata, Hideki Ohdan, Kunihito Gotoh, Michiaki Kubo, Tatsuhiko Tsunoda, Satoru Miyano, Kazuaki Chayama, Hiroki Yamaue, and Hidewaki Nakagawa, "Whole genome sequencing discriminate hepatocellular carcinoma with intrahepatic metastasis from multicentric tumors", Journal of Hepatology, doi: 10.1016/j.jhep.2016.09.021
発表者
理化学研究所
統合生命医科学研究センター ゲノムシーケンス解析研究チーム
チームリーダー 中川 英刀 (なかがわ ひでわき)
研究員 古田 繭子 (ふるた まゆこ)
和歌山県立医科大学 外科学第2講座
教授 山上 裕機 (やまうえ ひろき)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
和歌山県立医科大学 事務局総務課 広報室
Tel: 073-441-0710 / Fax: 073-441-0713
waidai [at] wakayama-med.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.全ゲノムシーケンス解析
次世代シーケンサーを使って、個人(約30億塩基)やがんの全ゲノム情報を解読し、配列の違いや変化を同定すること。データが大量になるため、「SHIROKANE」のようなスーパーコンピュータを使って情報解析を行うのが一般的である。全ゲノムシーケンス解析の場合、タンパク質をコードする1~2%の範囲のエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能で、究極のゲノム解析手法といえる。がんの場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシーケンス解析を行い、その差分を調べる。 - 2.次世代シーケンサー(NGS)
ヒトゲノムの全配列約30億塩基を1,000米ドル以下のコストで解読すべく、欧米の政府や企業が技術開発を行った結果、より高速高精度の性能を持つシーケンサーが開発された。従来の方法に比べ、超大量のDNAシーケンス反応を並列して行うことができる。今回は主に、6日間で約1兆個(ヒトゲノム10人分)の塩基配列を解読できるスペックのNGSを使用した。NGSはNext generation sequencerの略。
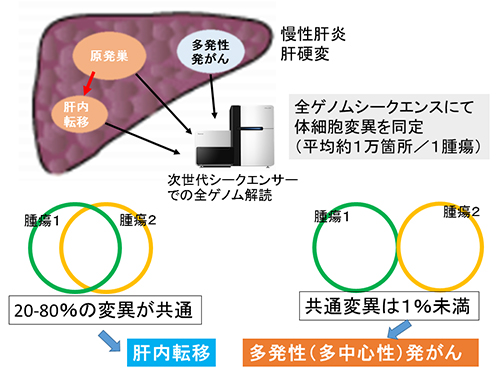
図1 再発性/多発性肝臓がんのゲノム診断
再発性、多発性肝臓がんの切除標本より、DNAを抽出し、NGSを用いて全ゲノムシーケンス解析を行い、1腫瘍あたり約1万カ所の体細胞変異を検出した。同じ患者さん由来の二つまたは三つの腫瘍間で共通する変異が多い(20~80%)症例は、同じがん細胞由来と考えられ肝内転移と診断でき、共通変異が極めて少ない症例(1%未満)は、多発性発がん(多中心性発がん)と判定できる。
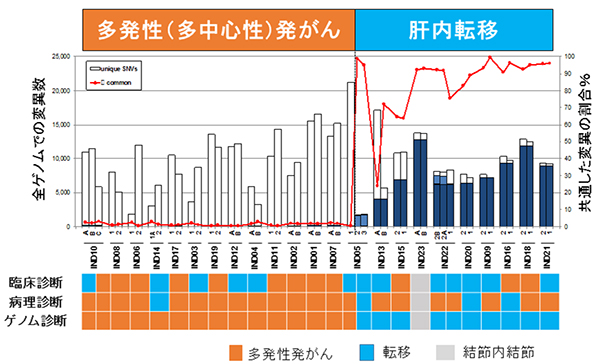
図2 肝臓腫瘍間の共通変異の割合と臨床病理診断の比較
上段:棒グラフは各腫瘍の体細胞変異の個数を示す。青塗り部は同じ患者に発生した肝腫瘍間で共通している体細胞変異を示す。赤い折れ線グラフは共通した変異の割合(%)を示す。同じ患者由来の二つまたは三つの腫瘍間で共通する変異が多い群(20~80%共通)と極めて少ない群(1%未満共通)と明確に分かれ、多い群は肝内転移による再発性肝臓がん、極めて少ない群は多発性(多中心性)肝臓がんと診断できる。
下段:臨床診断・病理診断・ゲノム診断の結果の比較したもの。約1/3の症例でゲノム診断の結果と異なっていた。結節内結節は、同じ肝腫瘍内に二つの病変があるもの。
