要旨
理化学研究所(理研)統合生命医科学研究センター 融合領域リーダー育成(YCI)プログラム[1]の伊川友活上級研究員、免疫器官形成研究グループの古関明彦グループディレクター、京都大学再生医科学研究所再生免疫学分野の河本宏教授らの共同研究チーム※は、マウスを用いて免疫細胞の1種であるT細胞が作られるときの運命維持に「ポリコーム複合体[2]」が重要であることを明らかにしました。
T細胞は他の免疫細胞と同様、血液のもととなる造血幹細胞[3]から作られます。造血幹細胞は骨髄中でT細胞へある程度運命付けられた後、胸腺[4]に移動し分化・成熟します。2010年に伊川友活上級研究員らは、T細胞系列への運命決定に転写因子[5]「Bcl11b[6]」が必要であることを明らかにしましたが、運命決定された後のT前駆細胞を維持するメカニズムは分かっていませんでした。
そこで共同研究チームは、さまざまな細胞の運命制御に関わるポリコーム複合体に注目しました。まず、T細胞特異的にポリコーム複合体遺伝子「Ring1A/B[7]」を欠損させたマウスを作製し、T細胞分化における役割を解析しました。その結果、Ring1A/B欠損マウスの胸腺ではT細胞が全く作られず、未分化な前駆細胞段階で分化が停滞しました。このRing1A/Bを欠損したT前駆細胞を調べたところ、同じリンパ球であるB細胞の特徴を示す遺伝子の発現が上昇していました。そこでB細胞への分化能を調べるために、Ring1A/Bを欠損したT前駆細胞を放射線照射した免疫不全マウスに移植したところ、T細胞は全く生成されない代わりに、骨髄および脾臓[8]において抗体産生能を持つB細胞が生成されました。次に、B細胞分化に重要な遺伝子「Pax5[9]」を欠損させたところ、Ring1A/Bを欠損させてもT細胞は正常に分化し、B細胞へ運命転換しなくなりました。このことからRing1A/Bは胸腺において、主にPax5の発現を抑制することによりT細胞の運命を維持していると考えられます。
ポリコーム複合体はこれまで、個体発生時の形態形成において重要であることは知られていましたが、今回、免疫細胞の生成・維持にも不可欠であることが示されました。ポリコーム複合体はT細胞急性リンパ性白血病[10]や急性骨髄性白血病[11]など、さまざまな白血病細胞で変異がみられるため、T細胞などの免疫細胞が作られるときのポリコーム複合体の機能をさらに解明することにより、白血病の発症機構の解明や新しい治療法の開発に繋がると期待できます。
成果は、米国の科学雑誌『Genes & Development』オンライン版(12月2日付け)に掲載されます。
背景
T細胞は免疫細胞の1種でTリンパ球とも呼ばれ、感染防御などさまざまな免疫反応において重要な役割を果たします。T細胞がその機能を発揮するために、分化・成熟過程において細胞の運命が厳格に制御・維持されています。多能性を持つ造血幹細胞が段階的に分化能を限定され、最終的にT細胞にしかなれない前駆細胞となってT細胞が作られます。
伊川友活上級研究員らは、2010年にBcl11bという転写因子がT細胞系列への運命決定に必要であることを報告しました注1)。しかし、T細胞系列へ運命決定された後のT前駆細胞を維持するメカニズムは分かっていませんでした。
一方、個体発生過程において「ポリコーム複合体」がさまざまな遺伝子の発現を調節することにより、細胞の運命を制御することが知られています。ポリコーム複合体はPRC1[2]、PRC2[2]の2種類あり、どちらもDNAに結合し、互いに協調し合いながらヒストン(DNAが巻きついて結合しているタンパク質)を修飾することによりエピジェネティック[12]に遺伝子発現を制御することが分かっています。これまでPRC1を構成するタンパク質の個別研究からPRC1の部分的な機能が研究されてきましたが、PRC1全体としての機能は不明でした。
そこで、研究チームはポリコーム複合体の中でもPRC1の機能に中心的な役割を果たす遺伝子「Ring1A/B」を欠損させることにより、PRC1がT細胞の分化・運命制御にどのように関わるのかを調べました。
注1)2010年7月2日プレスリリース「T細胞になるという運命決定を支配するマスター遺伝子を同定」
研究手法と成果
共同研究チームはまず、T細胞特異的にポリコーム複合体遺伝子Ring1A/Bを欠損させたマウスを作製し、T細胞分化における役割を解析しました。その結果、マウスの胸腺ではT細胞がほとんど作られず、未分化な前駆細胞(T前駆細胞)段階で分化が停滞し、胸腺細胞数も減少していました(図1)。
Ring1A/Bを欠損させた細胞では、ポリコーム複合体の直接の標的遺伝子の1つ「Cdkn2a」が発現し、細胞の増殖が阻害されることが知られています。そこで、Ring1A/BとCdkn2aの両方を欠損させたマウスでは、T前駆細胞からT細胞への分化が回復するのではないかと考え解析しました。ところが予想に反し、T細胞への分化はほとんど回復しませんでした。このことから、Cdkn2a以外にも重要な標的遺伝子が存在すると考えられました。そこでDNAマイクロアレイ法[13]を用いて、Ring1A/Bを欠損したT前駆細胞の遺伝子発現を網羅的に解析した結果、B細胞の特徴を示す遺伝子群(Ebf1、Pax5など)の発現が有意に上昇していることが分かりました。
共同研究チームは、Ring1A/Bを欠損させたT前駆細胞がB細胞への分化能を持つかを調べるため、放射線照射した免疫不全マウスに野生型T前駆細胞とRing1A/Bを欠損させたT前駆細胞を移植しました。移植6週間後にマウスを解析したところ、野生型T前駆細胞を移植したマウスからはT細胞が生成されました。一方、Ring1A/Bを欠損させたT前駆細胞を移植したマウスからはT細胞はほとんど生成されず、骨髄や脾臓において、抗体産生能を持つB細胞が生成されました(図2)。このことはRing1A/Bを欠損させたT前駆細胞がB細胞へ運命転換したことを示しています。
次に、B細胞関連遺伝子がT前駆細胞においてRing1A/Bの標的遺伝子であるかを調べるために、T細胞特異的Ring1A/B欠損マウスにB細胞分化に重要な遺伝子「Pax5」欠損マウスを掛け合わせて、Ring1A/BとPax5の三つの遺伝子を欠損させたマウスを作製し解析しました。その結果、T前駆細胞からT細胞が正常に分化するまでに回復しました。さらにこのT前駆細胞からB細胞は生成されませんでした。このことから、Ring1A/Bは正常なT細胞分化過程においてPax5を含めたB細胞関連遺伝子の発現を抑制することにより、T細胞の運命を維持していると考えられます(図3)。
今後の期待
細胞の系列は、一般的には転写因子がまず方向性を決めて、エピジェネティック制御がその状態を維持すると考えられています。本研究成果は、T細胞とB細胞とではそのメカニズムが大きく異なることを示しています。すなわち、T細胞系列の分化・成熟にはB細胞系列の転写因子をエピジェネティックに抑制することが不可欠であり、「B細胞系列への分化は初期設定で決められているが、T細胞系列への分化にはB細胞への分化能を強力に阻止する必要がある」と考えられます。T細胞とB細胞というリンパ球の二大系列形成への分化における大きな相異の発見は、分化決定という現象の理解を深く掘り下げる役割を果たすと期待できます。
一方、ポリコーム複合体による遺伝子発現制御メカニズムが破綻することにより、細胞のがん化を引き起こすと考えられています。例えば、T細胞急性リンパ性白血病や急性骨髄性白血病など、さまざまな白血病においてポリコーム複合体の変異が報告されています。しかし、その詳細は明らかではありません。今後、ポリコーム複合体による免疫細胞の分化制御の詳細な仕組みを明らかにすることにより、白血病の発症機構や治療法の開発への応用が可能になると期待できます。
原論文情報
- Tomokatsu Ikawa, Kyoko Masuda, Takaho A Endo, Mitsuhiro Endo, Kyoichi Isono, Yoko Koseki, Rinako Nakagawa, Kohei Kometani, Junichiro Takano, Yasutoshi Agata, Yoshimoto Katsura, Tomohiro Kurosaki, Miguel Vidal, Haruhiko Koseki and Hiroshi Kawamoto, "Conversion of T cells to B cells by inactivation of polycomb-mediated epigenetic suppression of B lineage program", Genes & Development
発表者
理化学研究所
統合生命医科学研究センター 融合領域リーダー育成プログラム
上級研究員 伊川 友活(いかわ ともかつ)
統合生命医科学研究センター 免疫器官形成研究グループ
グループディレクター 古関 明彦(こせき はるひこ)
 伊川 友活
伊川 友活
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.融合領域リーダー育成(YCI)プログラム
理研統合生命医科学研究センターが独自に推進する若手研究者のためのリーダー育成プログラム制度。免疫と他分野との融合研究を推進する若手研究者を育成するために設立された。ホストラボ制度、メンター制度などユニークなシステムを持つ。YCI はYoung Chief Investigatorの略。 ホームページ参照 - 2.ポリコーム複合体、PRC1、PRC2
ポリコームタンパク質が集合した複合体。もともと形態形成に関わるホメオティック遺伝子の発現を調節する因子として発見されたが、現在ではさまざまな細胞の遺伝子発現を制御することにより、発生・分化に重要な働きをすることが知られている。PRC1はCBX、PCGF、RING1、PHCというタンパク質を含み、ヒストンH2Aの119番目のアミノ酸残基であるリジンのユビキチン化を引き起こす。PRC2はEED、EZH、SUZ12などのタンパク質を含み、ヒストンH3の27番目のアミノ酸残基リジンのメチル化を行う。PRC1とPRC2が協調して遺伝子発現を抑制すると考えられている。 - 3.造血幹細胞
血液を作る大元の細胞のこと。幹細胞とは自己複製能と多分化能を兼ね備えた細胞と定義される。白血球や赤血球、血小板などすべての血液細胞を作りだす。成体では骨髄に主に存在する。 - 4.胸腺
T細胞が作られる臓器で心臓の上に位置する。T細胞のもとになるT前駆細胞は、胎生期には肝臓から、生後は骨髄から胸腺へ移動する。胸腺で分化成熟したT細胞は末梢組織へ移出される。 - 5.転写因子
遺伝子の発現を制御する分子。多くはDNAとの結合部位を持ち、標的遺伝子のエンハンサー、プロモーター、サイレンサーなどの配列に結合して、標的遺伝子の発現を増強または抑制する。 - 6.Bcl11b
Zinc finger領域と呼ばれる構造を持つ転写因子。胸腺リンパ腫の研究から、がん抑制遺伝子として同定された。T細胞の分化・成熟、2型自然リンパ球の機能などに関わる。白血病との関連も示唆されている。 - 7.Ring1A/B
ポリコーム複合体PRC1を構成する因子Ring1A/Bの遺伝子で、Ring1AとRing1Bの二つの遺伝子を同時に表している。Ring1A/Bは、ヒストンH2Aの119番目のリジンをユビキチン化する酵素で、PRC1の中で中心的な役割を果たす。 - 8.脾臓
免疫機能や造血機能を持つ臓器。さまざまな病原体に対する免疫応答の場となっている。老化した赤血球を取り除いたり、血小板を蓄える働きもある。 - 9.Pax5
B細胞分化に必須の転写因子Pax5の遺伝子。さまざまなB細胞関連遺伝子の発現や免疫グロブリン遺伝子の再構成などに関わるB細胞生成のマスター遺伝子である。 Pax5の変異や転座はB細胞急性リンパ性白血病を引き起こすことが知られている。 - 10.T細胞急性リンパ性白血病
白血病(血液のがん)の中でもTリンパ球ががん化した病気。造血幹細胞からT細胞に成熟する段階の若い細胞ががん化することにより起こる。 - 11.急性骨髄性白血病
骨髄系の造血細胞が腫瘍化し無制限に増殖する疾患。造血幹細胞から好中球・好酸球・好塩基球・単球・赤血球・血小板を作る過程の若い細胞ががん化することにより起こる。 - 12.エピジェネティック
DNA配列に依らない遺伝子の調節機構のこと。アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4塩基からなるDNAの塩基配列だけでは説明できない遺伝子発現調節の仕組みで、DNAのメチル化やヒストンの修飾などがこれにあたる。 - 13.DNAマイクロアレイ法
塩基配列が既知の多種類の遺伝子のDNAをプローブとして、プレート上に規則正しく固定しておく。調べたい細胞からmRNAを採取し、逆転写酵素でcDNAに変換したあと蛍光標識する。これをプレート上に貼付けられたDNAと反応させ、蛍光強度を読み取ることにより、遺伝子の発現量を網羅的かつ定量的に調べることができる。
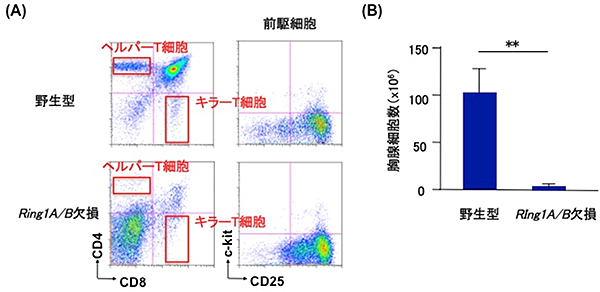
図1 T細胞特異的にRing1A/Bを欠損させたマウスの胸腺細胞
(A)Ring1A/Bを欠損させると胸腺でT細胞(ヘルパーT細胞とキラーT細胞)がほとんど作られなくなり、前駆細胞段階で分化が停滞する。
(B)野生型およびRing1A/B欠損マウスの胸腺細胞数。Ring1A/Bを欠損すると胸腺細胞数が激減する。
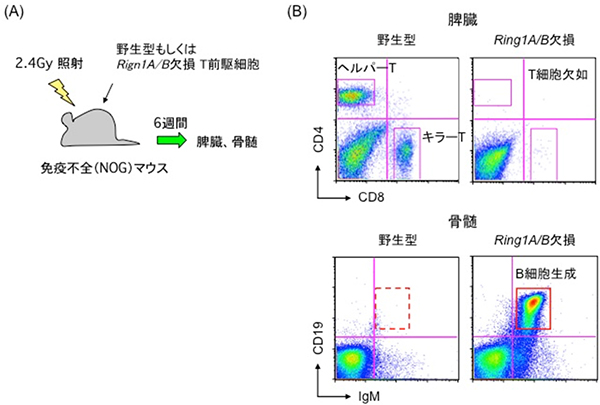
図2 Ring1A/Bを欠損させたT前駆細胞のB細胞への運命転換
(A)実験系の模式図。野生型もしくはRing1A/Bを欠損させたT前駆細胞を免疫不全マウスへ移植した。移植6週間後に、マウスの脾臓および骨髄を解析した。
(B)脾臓において、野生型マウスからはT細胞(ヘルパーT細胞とキラーT細胞)が生成されたが、Ring1A/B欠損マウスからはT細胞がほとんど生成されなかった。一方、骨髄においてRing1A/B欠損マウスからB細胞が生成された。
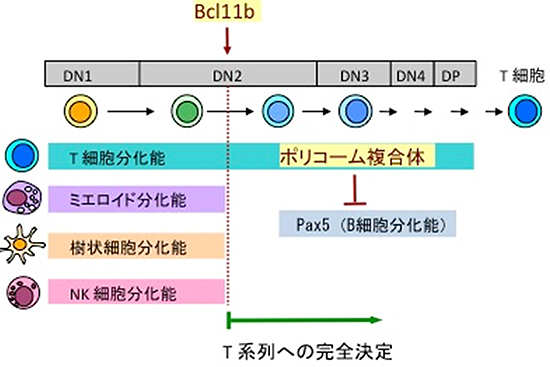
図3 胸腺におけるT細胞分化のモデル
胸腺においてT細胞分化はDouble negative(DN)1→DN2→DN3→DN4→Double positive(DP)の順に分化が進む。DN2段階において転写因子「Bcl11b」の作用によりT細胞系列へ運命決定される。ポリコーム複合体はB細胞への分化能を抑制することにより、T細胞系列へ運命決定された前駆細胞の運命を維持する。ミエロイドは骨髄系細胞、NK細胞はナチュラルキラー細胞を指す。
