要旨
理化学研究所(理研)バイオリソースセンター新規変異マウス研究開発チームの牧野茂開発研究員、権藤洋一チームリーダーらの研究チーム※は、マウス細胞を用いて、ゲノム編集技術[1]により目的とするフレームシフト変異[2]を導入したところ、想定外のタンパク質が翻訳[3]されるという現象を発見しました。
近年、ゲノムを自在に改変できるゲノム編集技術が、急速に発展普及しています。この技術は簡便で、これまでゲノム改変が困難であった生物種においても利用できることから、遺伝子機能を解明する基礎研究から医療応用まで、極めて広範囲にわたる生命科学研究において利用が進んでいます。将来は、ゲノムを自在に改変し遺伝子治療への扉を開くと期待されています。一方で、標的とする配列以外のゲノム領域に、意図しない突然変異が導入される問題(オフターゲット効果)には十分に注意が払われ、技術改良が進められています。
今回、研究チームは、ゲノム編集技術「CRISPR-Cas9システム[4]」を用いてマウス細胞の形態形成に関わるGli3[5]という遺伝子の標的破壊(ノックアウト)[6]を行いました。その結果、11系統の変異Gli3マウス培養細胞株を樹立し、その中の8細胞株は父方由来と母方由来のGli3遺伝子が共に翻訳が妨げられるフレームシフト変異を持つことも分かりました。ところが、樹立した株のうち6細胞株のタンパク質発現を確認したところ、6細胞株全てが、ほぼ全長のGLI3タンパク質を「定型外翻訳」[7]によって発現していました。この結果は、“ゲノム編集を行う場合、標的遺伝子の変異配列確認だけでなく、タンパク質発現まで確認することが重要であること”を示しています。さらに研究チームは、ゲノム編集実施前にノックアウトした遺伝子から予想外のタンパク質が発現するかどうか事前に確認できる「in vitro発現確認ベクター」[8]も報告し、その利用を呼びかけています。
本研究は、ゲノム編集利用にあたっての警鐘を鳴らすとともに、分子生物学の中心命題である“セントラルドグマ”[3]の重要なステップである「翻訳」開始について、全く新しい分子機構があることを強く示しています。実際にフレームシフト変異によって定型外翻訳が生じて発症するヒト疾患[9]の報告もあり、そういった疾患の分子機構の解明につながる可能性があります。一方で、ヒトやマウスの全遺伝子の半分にはuORF[10]と呼ばれる配列があり“小さな定型外翻訳”によって発現制御されている可能性が近年示唆されています。本成果はセントラルドグマそのものにパラダイムシフトをもたらす可能性があります。
本成果は、国際科学雑誌『Scientific Reports』(12月21日付け)に掲載されました。
※研究チーム
理化学研究所 バイオリソースセンター
新規変異マウス研究開発チーム
開発研究員 牧野 茂(まきの しげる)
開発研究員 福村 龍太郎(ふくむら りゅうたろう)
チームリーダー 権藤 洋一(ごんどう よういち)
背景
高等生物のゲノムの改変は、これまでES細胞(胚性幹細胞)[11]が樹立されているマウスなど、限られた生物種でのみ実施可能でした。その後、iPS細胞(人工多能性幹細胞)[11]が生物種を問わず作製できるようになり、ゲノム改変の応用範囲が広がりました。しかし依然として、標的とする遺伝子だけを破壊したノックアウトマウスの作製を含め、ゲノム改変効率は極めて低く、多大な時間や労力が必要でした。ところが近年、ゲノム編集技術の登場により、さまざまな生物種で目的の塩基配列を効率よく自在に改変することができるようになり、急速に利用が広がっています。ゲノム編集技術は、遺伝子機能の解明や疾患メカニズムの研究を加速し、創薬、有用生物の創出、さらには究極の遺伝子治療法へつながる技術として期待されています。
このようにゲノム編集技術が急速に発展する中、技術上の問題点や限界の検証も行われています。特に、標的とする配列以外のゲノム領域に、意図しない突然変異が導入される問題(オフターゲット効果)には十分に注意が払われ、技術改良が進められてきました。
研究手法と成果
研究チームは、最も広く利用されているゲノム編集技術である「CRISPR-Cas9システム」を用いて、11系統の変異Gli3マウス培養細胞株を樹立しました。Gli3遺伝子は、形態形成に重要な役割を果たす遺伝子の一つです。その中の8細胞株は、父方由来と母方由来の両方のGli3遺伝子に、翻訳を妨げられる「フレームシフト変異(塩基の挿入や欠失変異)」が導入されていることが分かりました。通常、フレームシフト変異を持つメッセンジャーRNA(mRNA)は不良品として分解され、タンパク質への翻訳は全く起こりません。分解を免れた場合でも、フレームシフトを持つmRNAからは、読み枠がずれるためすぐに終止コドンが現れ、機能を持たない小さなN末端[12]側タンパク質断片だけが翻訳されます(図1)。
研究チームは念のため、樹立したフレームシフト変異を持つ6細胞株で、GLI3タンパク質発現をウェスタンブロット法[13]により確認したところ、予想に反して、ほぼ全長に近い正しいアミノ酸配列をもつGLI3タンパク質が発現することを発見しました(図2)。
研究チームは、フレームシフト変異細胞株で、どのようなタンパク質が合成されるのかを具体的に調べるために、Gli3遺伝子のN末端とC末端[12]に小さな目印(タグ)を結合させた発現ベクター(in vitro発現確認ベクター)を開発しました(図3A)。この方法により発現解析を行ったところ、フレームシフト変異Gli3遺伝子からは、C末端側のタグのみを持ったGLI3タンパク質が発現することを発見しました(図3B)。
この結果により、フレームシフト変異Gli3では、本来の開始コドンより下流に位置する別の開始コドンから翻訳が開始伸張しC末端の本来の終止コドンまで、正しいGLI3のアミノ酸配列を持つ、ほぼ全長のタンパク質が合成されることを明らかにしました(図3C)。
これまでゲノム編集は、オフターゲット変異を起こさないよう改良が進められてきました。
一方、本研究では、標的とするゲノム領域に狙い通りの突然変異を導入しても、想定外の標的タンパク質発現が生じる例を示しました。研究チームの発見により、“ゲノム編集技術を用いて遺伝子のノックアウトを行う際、標的とするDNA配列を調べるだけでなく、標的タンパク質の発現が消失することも慎重に解析することが重要であること ”が明らかになりました。
また、通常、このタンパク質発現確認は、図2に示すように標的遺伝子が産生するタンパク質を特異的に認識する抗体を用いて行いますが、本研究で開発したin vitro発現確認ベクターを用いることで、そういった個別の抗体を予め準備することなく、ゲノム編集の実施前に、想定外のタンパク質発現が生じるかどうか“事前検証”ができます。
今後の期待
フレームシフト変異により生じる“本来より下流の開始コドンから翻訳が開始してしまう現象(定型外翻訳)”は、複数のヒト疾患の原因遺伝子でも報告されています。このため、定型外翻訳はマウスGli3遺伝子だけに限らず、さまざまな生物種における多くの遺伝子で一般的に起こりうる現象であると考えられます。
一方で、ヒトやマウスの正常な遺伝子の上流配列には、小さなオープンリーディングフレーム(uORF)が約半数の遺伝子に存在し、uORFが定型外翻訳と結び付き、本来の遺伝子発現そのものを制御していることが最近明らかになりつつあります。
今後、研究チームは翻訳の開始機構を明らかにし、最も基本的な生命現象であるタンパク質発現制御のメカニズムの解明を目指します。さらに、この翻訳開始機構の解明は、ヒト疾患の詳細な分子機構を理解することにつながり、将来的には治療法や新規薬剤の開発にもつながると期待できます。
原論文情報
- Shigeru Makino, Ryutaro Fukumura, Yoichi Gondo, "Illegitimate translation causes unexpected gene expression from on-target out-of-frame alleles created by CRISPR-Cas9", Scientific Reports, doi: 10.1038/srep39608
発表者
理化学研究所
バイオリソースセンター 新規変異マウス研究開発チーム
開発研究員 牧野 茂(まきの しげる)
チームリーダー 権藤 洋一(ごんどう よういち)
 牧野 茂 開発研究員
牧野 茂 開発研究員
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ゲノム編集技術
部位特異的にDNA二重鎖を切断する酵素(ヌクレアーゼ)を利用し、ゲノム上の標的配列を改変する技術。部位特異的ヌクレアーゼにより導入された二重鎖切断は、細胞にとって極めて有害であるため、速やかに修復される。その過程で起こるエラーにより標的箇所に突然変異が導入される。さらに、ドナーDNA断片を加えることで、希望する配列への置換や挿入も可能になるなど、技術的に応用が進められている。 - 2.フレームシフト変異
塩基の挿入や欠失変異のこと。mRNAから3塩基ずつ一つのアミノ酸へと翻訳されるので、挿入や欠失塩基の数がとくに3の倍数でない数の場合には読み枠がずれ、合成されるタンパク質が本来の配列とは全く異なったものになる。異なったフレームには終止コドンがすぐに現れるため、フレームシフト変異のすぐ下流で翻訳が終了するか、もしくは、いわゆるナンセンス変異依存mRNA分解(nonsense mediated decay)によってmRNAそのものが破壊される場合も多いので「遺伝子破壊ノックアウト変異」となる場合が多い。 - 3.翻訳、セントラルドグマ
ゲノムの中の遺伝子配列からmRNAが「転写」され、さらに、そのコーディング配列からタンパク質へと「翻訳」されるという“セントラルドグマ”における遺伝子発現の重要なステップの一つ。ヒトを含む真核生物でも翻訳における開始因子や伸張因子など多くの研究が1960年代から蓄積されている。教科書にも詳しく記載され,分子レベルにおいてもかなり解明されていると考えられている。 - 4.CRISPR-Cas9システム
ゲノム上の標的領域と相補的なsgRNA(single guide RNA)とCas9ヌクレアーゼの二つにより、ゲノム改変を行うゲノム編集技術の一つ。sgRNAのデザインや作製が簡便な上、技術的開発も進められており、さまざまな生物のゲノム改変で最も多用されている。特に、受精卵や初期胚でも、効率よく特異的に標的配列に二重鎖切断を導入することができるため、ES細胞やiPS細胞のない生物種にも利用できる。さらに、母方由来と父方由来の両方の遺伝子を同時に標的破壊できるほど効率が高いため、一気にホモ接合ノックアウト生物が得られるのも特長となっている。CRISPR-Cas9はクリスパーキャスナインと読む。 - 5.Gli3
形態形成に重要な役割を担うヘッジホグシグナル伝達系において、下流の遺伝子群の発現制御を行う重要な転写因子の一つをコードする遺伝子。ヘッジホグシグナル伝達系に突然変異が生じると、初期発生において形態異常や成体では発がんに関与する。本研究では、その分子機構の詳細な解明を目指して、 Gli3遺伝子の標的破壊を計画した。 - 6.遺伝子の標的破壊(ノックアウト)
2007年ノーベル生理学医学賞を受賞した「ノックアウトマウス」が有名。哺乳類ゲノムにおいて、標的とする遺伝子だけを相同組換えを利用して特異的に破壊する方法。なるべく長い相同配列をターゲッティングベクターに配することにより効率を上げるため、ベクター構築に手間がかかる。また、ノックアウト生物ができるのは、受賞当時はES細胞が利用可能な生物に限られていた。現在では、iPS細胞があればこの相同組換えベクターを用いる方法でノックアウト生物はできる。通常は片方の親由来の遺伝子一つだけ破壊する。そのため、両方の遺伝子とも破壊した「ホモ接合ノックアウト生物」を得るためには、さらに交配によってホモ接合生物を得る必要がある。 - 7.定型外翻訳
“セントラルドグマ”([3]参照)では、mRNA上のオープンリーディングフレームと呼ばれる配列の5’末端のAUGからタンパク質への翻訳が開始し、3塩基ずつ一つのアミノ酸としてタンパク質が伸張し、3’末端の終止コドンまで一つのペプチドとして発現すると分子生物学教科書に記載されている。今回発表した「定型規格から外れた翻訳illegitimate translation」は、本来のAUG以外から翻訳が開始する現象を意味する。その分子機構として、「開始コドンスキャニング漏れleaky scanning」と、「翻訳再開translation reinitiation」の2つの例を挙げ、研究チームが解析した定型外翻訳においては、開始コドンスキャニング漏れによることまで実験的に示した。 - 8.in vitro発現確認ベクター
N末端側に「3xFLAGタグ」を、C末端側に「HAタグ」を配置し、培養細胞系に導入して、目的のタンパク質発現を、試験管内( in vitro)で実験検証するためのベクター(運び屋)。コントロールとなる野生型遺伝子配列や、ゲノム編集で想定しているフレームが変わる変異を導入した遺伝子配列を組込み、タンパク質発現の有無を、両末端のタグを利用して調べる。使った3x FLAGタグとHAタグは広く一般的に用いられているものであり、その発現を確認するためのタグ抗体も市販されていて容易に入手できる。目的とする遺伝子のcDNA配列を組み入れた in vitro発現確認ベクターとタグ抗体さえ準備すれば、どの遺伝子においても、ゲノム編集によって「予想外のタンパク質発現」が起こるかを事前に確認できる。 - 9.フレームシフト変異によって定型外翻訳が生じて発症するヒト疾患
(A)定型外タンパク質発現によって症状が緩和される疾患の例
- X-linked intellectual disability (ID):てんかんを伴う脳神経系疾患。
(Moey et al. Eur J Hum Genet. 2015) - Menkes disease:銅イオン代謝異常を起こすX染色体連鎖優性遺伝疾患。
(Paulsen et al. Am J Hum Genet. 2006) - BRCA1の体細胞変異:乳がんや卵巣がんを引き起こす疾患。
(Buisson et al. Hum Mutat. 2006) - Omenn’s syndrome:免疫不全を伴う劣性遺伝疾患。
(Santagata et al. Proc Natl Acad Sci USA. 2000)
(B)定型外タンパク質発現が異常活性を持つことにより発症する疾患の例
- βサラセミア(地中海貧血):通常劣性遺伝する疾患だが、フレームシフト変異下流からの翻訳産物が異常活性を持つことにより、優性遺伝疾患となる。
(Neu-Yilik et al. 2011) - Long QT syndrome type 2: 不整脈を発症する優性遺伝疾患。
(Stump et al. J Mol Cell Cardiol. 2012) - Rapp-Hodgkin syndrome (RHS):四肢や頭部形態異常を伴う優性遺伝疾患。
(Rinne et al. Hum Mol Genet. 2008) - Ectodermal dysplasia with immune deficiency (EDI):免疫不全症を伴うX染色体連鎖優性遺伝疾患。
(Lopez-Granados et al. Hum. Mutat. 2008)
- X-linked intellectual disability (ID):てんかんを伴う脳神経系疾患。
- 10.uORF
mRNAの翻訳開始コドンから終止コドンまでのタンパク質をコードする領域をORFと呼ぶ。これまで一般的には、真核生物における一つのmRNA上には、タンパク質をコードするORFが一つだけ存在すると考えられてきた。しかし、近年のゲノム配列情報の蓄積と翻訳解析技術の向上により、mRNA上のメインORFの上流に複数の小さなORF(uORF)が存在することが明らかになってきた。uORFは、人やマウスの遺伝子のおよそ50%に存在し、メインORFの発現を抑制する役割があると考えられている (Calvo et al. Proc Natl Acad Sci USA. 2009.)。さらに、uORFは環境に応答してメインORFの発現制御に重要な役割を果たす例も示されたことから、uORFを介した翻訳制御が遺伝子の発現制御の重要なステップであることが明らかになりつつある(Wethmar. Wiley Interdiscip Rev RNA. 2014)。uORFは、upstream Open Reading Frameの略。 - 11.ES細胞(胚性幹細胞)、iPS細胞(人工多能性幹細胞)
ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された細胞株で、体を構成する全ての種類の細胞に分化する能力(多能性)を持つ。マウス、サル、ヒトなどから樹立されている。一方、iPS細胞は成人の皮膚などの組織から採取した細胞に、 Oct3/4、 Sox2、 Klf4を遺伝子導入することにより作製された細胞で多能性を持つ。また、両細胞とも細胞自身で無限に増殖する力自己増殖能を持つ。 - 12.N末端、C末端
タンパク質はアミノ酸同士が脱水縮合して形成されたポリマーであり、隣接するアミノ酸は、それぞれのアミノ基とカルボキシル基がペプチド結合(-NH-CO)をしている。このポリマーの末端のフリーのアミノ基側をN末端、カルボキシル基側をC末端と呼ぶ。細胞内でタンパク質が発現する場合、mRNAの3塩基から成るコドンに応じて、N末端側からC末端側に向け一つずつペプチド結合をしていく。 - 13.ウェスタンブロット法
電気泳動によって分離したタンパク質を特殊な膜に転写した後、ある特定の抗体を利用することで目的タンパク質の存在を検出もしくは定量する方法。
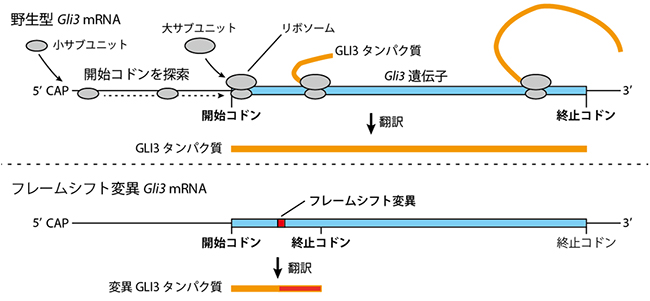
図1 Gli3 mRNAの翻訳とGLI3タンパク質
上:通常(野生型)のmRNAでは、リボソームの小サブユニットはmRNAの5’末端(CAP構造)から、3’末端方向に移動しながら開始コドンを探す。開始コドンが見つかったら、リボソームの大サブユニットと小サブユニットがmRNAを挟む。開始コドンからは、3塩基(コドン)で一つずつアミノ酸へと翻訳が開始伸長し、終止コドンが出現するまでタンパク質合成を行う(翻訳)。
下:フレームシフト変異(塩基の挿入や欠失変異)を持つmRNAでは読み枠がずれる。今回フレームシフトが導入されたGli3遺伝子の場合、すぐ下流に終止コドンが出現し、翻訳されてもごく短いN末端(アミノ基側)タンパク質断片のみが合成されると予想されていた。
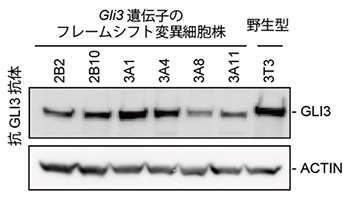
図2 Gli3フレームシフト変異細胞株でのGLI3タンパク質の発現
父方由来と母方由来の両方のGli3遺伝子にフレームシフト変異を導入した細胞株では、野生型株とほぼ同じ分子量のGLI3タンパク質が発現した。遺伝子発現をGLI3抗体で検出しているため、六つのフレームシフト変異株で発現しているタンパク質は、野生型とほぼ同じ大きさのタンパク質であるというだけでなく、アミノ酸配列そのものも本来のGLI3タンパク質と同じ配列であることが分かった。ACTINは対照用のタンパク質。
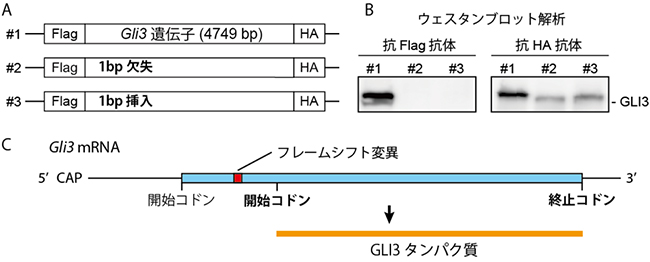
図3 フレームシフト変異Gli3遺伝子からのC末端側GLI3タンパク質の発現
A:N末端にFlag、C末端にHAという小さな目印(タグ)を結合させた、発現ベクター(in vitro発現確認ベクター)の概念図。#1は野生型Gli3遺伝子(4749塩基)、#2は1個の塩基が欠失した変異Gli3遺伝子、#3は1個の塩基を挿入した変異Gli3遺伝子のそれぞれvitro発現確認ベクターを表している。
B:ウェスタンブロット解析による、左はN末端タグ(Flag)に反応するタンパク質合成を示し、右はC末端タグ(HA)のみに反応するタンパク質が合成を示している。フレームシフト変異Gli3(#2と#3)は、C末端タグ(HA)のみを持ったタンパク質が合成されたことが分かる。
C:フレームシフト変異Gli3遺伝子からは、本来の開始コドンより下流の開始コドンから翻訳が開始され、N末端を欠いたほぼ全長のGLI3タンパク質が発現することが明らかになった。
