要旨
理化学研究所(理研)環境資源科学研究センター細胞機能研究チームの岩瀬哲研究員、杉本慶子チームリーダーらの研究チームは、植物が傷口で茎葉を再生させる分子経路の一端を明らかにしました。
植物の高い再生能力は、挿し木や葉挿しなど、農業や園芸分野で古くから植物体の増産に利用されています。しかし、植物がどのように傷口で新しく組織を再生させるか、その分子レベルでのメカニズムはよく分かっていませんでした。
研究チームは2011年、シロイヌナズナ[1]の傷口で細胞の脱分化[2]を促進する転写因子[3]「WOUND INDUCED DEDIFFERENTIATION 1(WIND1)」を発見しました。WIND1によって発現がオンになる遺伝子を探索したところ、転写因子「ENHANCER OF SHOOT REGENERATION 1(ESR1)」が一つの候補に挙がりました。今回、このESR1に着目し、傷口での機能を調べました。その結果、傷口でESR1遺伝子が発現し、カルス[4](脱分化した植物細胞の塊)形成やカルスから生じる茎葉の再生を促進することが分かりました。また、WIND1がESR1遺伝子のプロモーター[5]領域に結合し、ESR1遺伝子の発現を直接的に促進していることが明らかになりました。つまり、シロイヌナズナが傷口で茎葉を再生させる際には、少なくともWIND1とESR1の二つの転写因子が階層的に機能するということです。これらの結果は、植物には傷ができた後に、カルス形成を通して茎葉を再生させる分子経路が存在することを示しています。
今後、WIND1とESR1を直接利用したり、ESR1が制御する遺伝子群を特定していくことで、効率のよい組織培養[6]による植物の量産や有用物質生産などへ繋がる可能性があります。
成果は米国の科学雑誌『The Plant Cell』オンライン版(12月23日付け)に掲載されました。
本研究は、国立研究開発法人農業・食品産業技術総合研究機構生物系特定産業技術研究支援センターのイノベーション創出基礎的研究推進事業、農林水産省の農林水産業・食品産業科学技術研究推進事業、日本学術振興会の科学研究費助成事業の支援を受けて実施されました。
背景
植物の高い再生能力は古くから知られ、現在でも農業や園芸分野で広く利用されています。挿し木や葉挿しなどは、切り取った組織の一部を土に埋めて放置し、再生する植物体を育成してクローン植物を増やす手法です。また、植物の中には、ちぎれた葉から個体を再生させ、繁殖に利用する種もあります。
再生能力が高いことで知られる動物、例えばプラナリアやイモリなどと同様に、植物の再生においても組織が傷を受けることが再生の引き金になっています。しかし、傷がどのように組織の再生を促すのか、その分子レベルでのメカニズムは、近年までほとんど分かっていませんでした。
傷を受けた生物の再生には、一度分化が完了した細胞から分化多能性を持った幹細胞[7]が新しく生み出される「脱分化」という現象を経るものがあります。興味深いことに、植物では脱分化に関与する因子の発現を制御すると、多くの場合、カルスが形成されるだけでなく、茎や葉など、さまざまな組織が再生されます。自然界でもカルス形成の後に組織の再生が観察されることから、カルス形成と組織の再生は連動した経路であることが予想されます。
研究チームは、植物細胞の持つ分化全能性[8]、すなわち一つの細胞が個体をつくる全ての細胞に分化できる能力を発揮する一連のメカニズムについて分子レベルで解析を進めています。2011年には、シロイヌナズナの傷口で細胞の脱分化を促進する転写因子「WOUND INDUCED DEDIFFERENTIATION 1(WIND1)」を発見しました注1)。また2015年には、通常の発生・成長の過程では、全能性の発揮を抑える因子「PRC2(Polycomb repressive complex 2)」が必要であることを明らかにしています注2)。
今回、研究チームは2011年に発見したWIND1を足掛かりに、傷が組織の再生を促す際に関わる因子を探索しました。
注1)2011年3月11日プレスリリース「植物細胞の脱分化を促進するスイッチ因子を発見」
注2)2015年6月30日プレスリリース「植物の分化全能性抑制の分子メカニズムの一端を解明」
研究手法と成果
研究チームは、先行研究としてWIND1遺伝子を過剰発現させた植物体(シロイヌナズナ)でどのような遺伝子が発現しているかをDNAマイクロアレイ法[9]を用いて調べました。その結果、転写因子「ENHANCER OF SHOOT REGENERATION 1(ESR1)」の遺伝子が多く発現していることが分かりました。ESR1遺伝子は、植物ホルモン[10]を添加して茎葉の再生を誘導する組織培養条件で発現量が増え、茎葉の再生を促進する因子であることが報告されています注3)。このため、傷口で発現しカルス形成を誘導するWIND1がESR1遺伝子の発現を制御しているのではないかという仮説を立てました。
傷口でWIND1がESR1遺伝子の発現を制御しているのであれば、傷口でESR1遺伝子の発現が促進されるはずです。実際、RT-qPCR法[11]によってESR1遺伝子の発現量を複数の組織の傷口で測定したところ、どの組織でも、傷つけてから数時間以内に発現量が上昇しました。また、プロモーターレポーター解析[5]においても、傷口の維管束柔組織や前形成層の細胞、維管束の周りの葉肉細胞で特異的にESR1遺伝子のプロモーター領域の活性が確認されました。プロモーターとは、ある遺伝子が発現し転写される際に、その遺伝子の発現を調節するDNA上の領域のことです。さらに、ESR1に緑色蛍光タンパク質(GFP)をつないだESR1-GFPタンパク質をESR1プロモーターで発現させたシロイヌナズナ(ESR1-GFP)でも、傷口の細胞の核で蛍光が観察されました。傷をつけた後のWIND1遺伝子の発現がESR1遺伝子より先に見られたこと、また、WIND1の機能を抑制したシロイヌナズナ(WIND1-SRDX)ではESR1遺伝子の発現が抑えられたことから、実際にWIND1がESR1遺伝子の発現を制御していることが示されました。
次に、WIND1がどのようにESR1遺伝子の発現を制御しているのかを調べました。WIND1が、ESR1遺伝子のプロモーター領域に直接結合して遺伝子発現を制御するのか、または別の因子を介してESR1遺伝子を制御するのかを明らかにすることは、傷ストレスによる茎葉再生の分子経路を理解するために重要です。研究チームは、クロマチン免疫沈降(ChIP)法[12]とゲルシフトアッセイ(EMSA)法[13]という異なる二つの手法によって、WIND1が直接ESR1遺伝子のプロモーター領域に結合することを明らかにしました。これによって、シロイヌナズナの傷口ではWIND1→ESR1という二つの転写因子が階層的に機能する分子経路が存在することが示されました。
さらに、研究チームは、ESR1遺伝子が傷口のカルス形成に関わるかを調べました。ESR1遺伝子の機能を抑制したシロイヌナズナ(esr1とESR1-SRDX)および、ESR1遺伝子が多く発現するようにしたシロイヌナズナ(esr1-DとESR1-GFP)を用い、傷口でのカルス形成能を野生株と比較しました。その結果、野生株と比べ、esr1とESR1-SRDXはカルス形成が抑制され、esr1-DとESR1-GFPはカルス形成が促進されました。これにより、ESR1遺伝子は傷口において、カルス形成を促進する機能を持つことが明らかになりました。
続いて、ESR1-GFPタンパク質をESR1プロモーターで発現させたシロイヌナズナ(ESR1-GFP)を用いて、傷をつけた組織(花茎、葉、子葉および根)を植物ホルモンを添加しない培地で培養しました。用いた野生株の場合、植物ホルモンを添加した培地で培養しないと茎葉は再生しません。ところが、ESR1-GFPは植物ホルモンの添加なしに茎葉が再生しました。ESR1-GFPでは、傷をつけた後のESR1遺伝子の発現量がピーク時には野生株に比べ2倍ほど増えていたことから、傷口でESR1遺伝子の発現量を増加させると茎葉の再生が促進されると予想されました。
これを検証するため、遺伝子発現のタイミングを制御できる遺伝子発現誘導系のシロイヌナズナの葉を用いて、傷をつけた後にESR1遺伝子の発現を誘導しました。その結果、培地に植物ホルモンを添加しない条件でも、傷口からの茎葉再生が著しく促進されました(図1)。このことから、傷口でESR1遺伝子の発現量を増加させると茎葉の再生が促進されることが示されました。
ESR1も転写因子であることから、WIND1と同様に発現を制御する遺伝子(群)が存在すると考えられます。研究チームは、茎葉が著しく再生する組織培養の条件を用いて、ESR1によって茎葉再生が制御される遺伝子をRT-qPCR法で探索しました。この組織培養条件では、ESR1遺伝子の機能を抑制したesr1とESR1-SRDXは、野生株に比べて茎葉の再生が抑えられ、逆にESR1遺伝子が多く発現するようにしたesr1-DとESR1-GFPでは茎葉の再生が促進されます。組織培養条件で茎葉再生に関与することが既に報告されている12個の転写因子の遺伝子について、野生株とesr1を比較したところ、esr1ではESR2、CUC1、RAP2.6L、WUS、STMの5個の遺伝子の発現が抑制されました。この結果から、ESR1が制御する遺伝子には茎葉再生に関わる5個の転写因子が含まれることが分かりました(図2)。
これらの解析から、傷をつけたシロイヌナズナの組織には、WIND1→ESR1という転写因子のネットワークが存在し、そのネットワークによって傷口のカルス形成や茎葉再生が促進されることが明らかになりました。これは、傷を受けた植物が単に傷口でカルス形成を誘導し傷を塞ぐだけでなく、そのカルスから新しい組織を再生させるための分子経路を持つことを明らかにしたといえます。
研究チームは、WIND1が結合するESR1プロモーター領域の配列を特定し、さらにESR1遺伝子の傷口での発現が植物ホルモンのオーキシン[10]とサイトカイニン[10]によって相乗的に促進することなども明らかにしました。サイトカイニン応答に関わるARR1とARR12の機能抑制二重変異体(arr1,arr12)でも、傷ストレス後のESR1の発現量が減少することなども見いだしました(図2)。
注3)Banno, H., Ikeda, Y., Niu, Q. and Chua, N. (2001). Overexpression of Arabidopsis ESR1 Induces Initiation of Shoot Regeneration. Plant Cell 13, 2609–2618.
今後の期待
ESR1遺伝子の機能を抑制したesr1とESR-SRDXでは、カルス形成や茎葉再生が完全に抑えられるわけではありません。これは、WIND1に制御される再生関連因子が他にも存在することを示唆しています。
今後、ESR1に制御される遺伝子の探索だけでなく、ESR1と同様にWIND1によって制御される遺伝子を探索することで、傷からの再生の分子経路がより明確になります。また、植物の新しい再生関連因子の発見も期待できます。さらにWIND1やESR1だけでなく、それらの再生関連因子を用いて、効率的な脱分化・再生技術の開発が可能になると期待できます。
原論文情報
- Akira Iwase, Hirofumi Harashima, Momoko Ikeuchi, Bart Rymen, Mariko Ohnuma, Shinichiro Komaki, Kengo Morohashi, Tetsuya Kurata , Masaru Nakata, Masaru Ohme-Takagi, Erich Grotewold, and Keiko Sugimoto, "WIND1 Promotes Shoot Regeneration through Transcriptional Activation of ENHANCER OF SHOOT REGENERATION1 in Arabidopsis", The Plant Cell, doi: 10.1105/tpc.16.00623
発表者
理化学研究所
環境資源科学研究センター 細胞機能研究チーム
チームリーダー 杉本 慶子(すぎもと けいこ)
研究員 岩瀬 哲(いわせ あきら)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.シロイヌナズナ
アブラナ科の植物であり、「ぺんぺん草」で知られるナズナの近縁種である。有している遺伝子の総量が比較的少なく、発芽から開花し種子が採れるまでの時間が比較的短いことから、植物のモデル生物(普遍的な生命現象の解明に用いられる代表的な生物)の一つになっている。2000年に、植物として初めて全ゲノムが解読された。 - 2.脱分化、分化
細胞の「分化」とは、未熟な性質を持った細胞がより特定の機能を持つ細胞に変化することを意味する。例えば、一つの受精卵は細胞分裂を繰り返しながら、さまざまな機能を持った組織細胞を形成していくが、これは受精卵が分化していく過程である。「脱分化」は逆に、一度分化し特定の機能を持った細胞がより分化状態の低い細胞に変化することを指す。例えば、形態的にも機能的にも分化が完了し、細胞分裂能を失った細胞が、細胞分裂を再開し、再び何かの細胞に分化する能力(分化の多能性)を獲得した場合、その細胞は脱分化したといえる。脱分化は、少し前の分化状態に戻ったり、受精卵のような状態に戻ったりなど、さまざまな度合いがある。また、細胞の分化の道筋を戻る状態だけでなく、がん細胞の形成などのように、もともと分化の道筋にはない現象も脱分化とみなされる。 - 3.転写因子
特定のDNA配列に結合し、遺伝子発現を制御するタンパク質の一群。遺伝子発現を促進する場合と抑制する場合があり、特に前者を転写活性化因子または転写促進因子、後者を転写抑制因子と呼ぶ。 - 4.カルス
植物が傷口につくる細胞の塊のこと。癒傷(ゆしょう)組織ともいう。現在では、植物の組織培養で形成される不定形の細胞塊のことを広く示す。カルス形成は傷などのストレスによって誘発される。植物ホルモンを含む培地では、傷口以外からもカルスが生じることがある。 - 5.プロモーター、プロモーターレポーター解析
ある遺伝子が発現し転写される(DNA→RNA)際に、その遺伝子の発現を調節するDNA上の領域のことをプロモーターと呼ぶ。ある特定の遺伝子のプロモーター領域に、β-グルクロニダーゼ(GUS)遺伝子や緑色蛍光タンパク質(GFP)遺伝子などのレポーター遺伝子をつないで生体内で発現させ、レポーター遺伝子の発現をモニターする解析方法をプロモーターレポーター解析と呼ぶ。この方法によって、その遺伝子がいつ、どの部位で、どのような刺激に応答して遺伝子発現が行われるかなどが観察できる。 - 6.組織培養
動物や植物などの組織の一部を取り出して、試験管内の培地で維持したり、培養して増やしたりする技術。植物分野では、種子をつけない植物を大量に増やしたり、ウイルスに感染していない植物を作り出すなど、広く応用されている。多くの場合、植物ホルモンを添加する。 - 7.幹細胞
自己複製能と多分化能を併せ持つ細胞のこと。細胞分裂後の娘細胞は、元の細胞と同じ性質を維持する(自己複製)が、一方の細胞は他の細胞種に分化できる能力(多分化能)を持つ。植物では、主に芽の先、形成層、根の先に幹細胞を持っており、分裂と分化をしながらレンガを積み上げるように体づくりをしている。 - 8.分化全能性
一つの細胞が個体を構成する全ての細胞種に分化できる潜在能力のこと。受精卵は分化全能性を持っている。植物細胞では、葉肉細胞のプロトプラストや花粉の細胞からカルス形成を経て個体を再生できることから、分化を完了した細胞においても分化全能性を発揮できる。 - 9.DNAマイクロアレイ法
どんな遺伝子がどれ位発現しているかを網羅的に捉える手法の一つ。ある生物が持つ全部の遺伝子や発現を知りたい遺伝子を選んで、DNAを一つひとつプレートに貼り付けておく。調べたい細胞からmRNAを取り出して、逆転写酵素でcDNAに変換した後、さらに蛍光を発する分子をくっつけておく。このmRNA由来の蛍光標識したcDNAを、プレート上に貼付けられたDNAと反応させる。蛍光強度を読み取ることで、遺伝子の発現量を網羅的かつ定量的に調べることができる。 - 10.植物ホルモン、オーキシン、サイトカイニン
植物ホルモンは、植物によって生産され低濃度で植物の生理過程を調節する成長調節物質の総称。オーキシンやサイトカイニンも含まれる。サイトカイニンは、オーキシン存在下で細胞分裂や茎葉形成を促進する一群の因子と定義される。 - 11.RT-qPCR法
RT-qPCR;quantitative reverse transcription PCR。遺伝子の発現量を測る方法。遺伝子の発現産物であるmRNAを逆転写反応(RT: reverse transcription)によってcDNAに変換し、これを鋳型にポリメラーゼ連鎖反応(PCR)をする。DNAの増幅率を経時的にモニターすることで、細胞や組織内の少量のmRNAの定量を行なうことができる。 - 12.クロマチン免疫沈降(ChIP)法
生体内におけるタンパク質とゲノムDNAの結合部位を検出するための実験手法。ホルムアルデヒドによってDNAとDNAに結合しているタンパク質を架橋したのちに、DNAの断片化を行い、タンパク質の抗体を用いてタンパク質-DNA複合体を回収する。さらにDNAとタンパク質を脱架橋し、DNAのみを回収し配列を調べることでタンパク質がゲノムのどこに結合していたか分かる。ChIPはChromatin Immunoprecipitationの略。 - 13.ゲルシフトアッセイ(EMSA)法
試験管内でタンパク質とDNAの結合を検出するための実験手法。DNAがタンパク質に結合すると、電気泳動度合いが変化することを利用して結合を検知する。EMSAは、Electrophoresis Mobility Shift Assayの略。

図1 ESR1遺伝子の発現を促進させたシロイヌナズナの葉
ESR1遺伝子を発現誘導できるシロイヌナズナの葉を傷つけ、ESR1遺伝子の発現を誘導しながら21日間培養した。その結果、傷口にカルスが形成され茎葉が再生した。植物ホルモン無添加の培地を用いた。スケールバーは1mm。
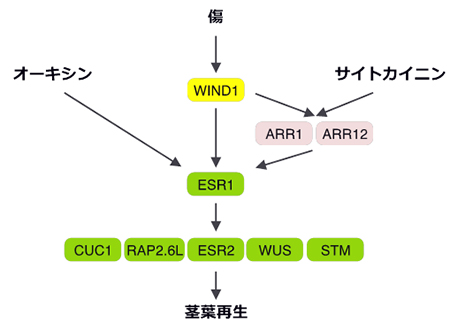
図2 茎葉再生を誘導するWIND1-ESR1経路
傷ストレスによって発現する転写因子WIND1は、ESR1遺伝子のプロモーターに直接結合してESR1遺伝子の転写を活性化する。このとき、オーキシンとサイトカイニンの両方が適度に存在することで、ESR1遺伝子の発現がさらに促進する。ESR1遺伝子は下流の因子の少なくとも5個の遺伝子の発現を制御することで、傷口でのカルス形成を促し茎葉の再生を促進していると考えられる。
