要旨
理化学研究所(理研)田中生体機能合成化学研究室の田中克典准主任研究員、坪倉一輝大学院生リサーチ・アソシエイト、ケンワード・ヴォン特別研究員らの国際共同研究グループ※は、生きているマウスの体内において狙った臓器で選択的に金属触媒による有機反応(金属触媒反応)を起こすことに成功しました。
有機合成化学の分野では、薬などさまざまな分子を自在に合成するために、これまでに多くの金属触媒が開発されてきました。一般的に金属触媒反応は、無水かつ反応を妨げる分子がない条件のフラスコ内で行われます。一方、体内では、水、血清、細胞、タンパク質、糖鎖、脂質などさまざまな分子が混在するため、金属触媒は活性を失い反応を進めることは困難でした。
今回、国際共同研究グループは糖鎖クラスター[1]を3価の金触媒(Au3+)の“運び屋”として利用し、狙った臓器で選択的に金属触媒反応を行うことを考えました。まず、末端にシアル酸またはガラクトースを持つ二種類の糖鎖クラスターに金触媒を結合し、“金の運び屋”を合成しました。これらをヌードマウス[2]に静脈注射したところ、金触媒は30分以内に、それぞれ肝臓、腸管表面に植え付けられました。続いて蛍光基を持つプロパルギルエステル[3]を静脈注射したところ、血液中を通って体全体を巡りますが、肝臓、腸管に到達した時に、先に植え付けていた金触媒と反応して臓器表面にあるリジン残基などのアミノ基との間で金触媒アミド化反応を起こしました。これにより、選択的に臓器を蛍光で標識できました。
本手法を用いて特定の臓器で金属触媒反応を起こせば、がんなどの疾患部位で直接、薬などの生理活性分子を効率的に合成できます。その結果、従来の創薬研究で問題だった副作用や化合物の体内での安定性の問題が解決できると考えられます。今後、ドラッグデリバリーシステム(DDS)[4]に基づいた、体内での有機反応による創薬の実現に貢献すると期待できます。
本研究成果は、ドイツの科学雑誌『Angewandte Chemie International Edition』にHot Paperとして選出されました。同誌に掲載されるのに先立ち、オンライン版に近日掲載予定です。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)の研究領域「分子技術と新機能創出」(研究総括:加藤隆史)研究課題名「生体内合成化学治療:動物内での生理活性分子合成」(研究者:田中克典)の一環として行われました。
背景
有機合成化学の分野では、薬などさまざまな分子を自在に合成するために、これまでに多くの金属触媒が開発されてきました。近年、金属触媒のなかでも遷移金属(周期表で第4族から第12族までに属する元素)触媒を用いた新しい有機合成反応が盛んに研究されています。例えば、ルテニウム(Ru)触媒を用いた野依良治博士らの不斉還元反応やロバート・グラブス教授(米国カルフォニア工科大学)らのメタセシス反応、あるいはパラジウム(Pd)触媒を用いた鈴木章博士、宮浦憲夫博士の鈴木・宮浦カップリング反応はノーベル化学賞を受賞しました。これらの金属触媒の開発により、複雑な構造を持つ薬や機能性材料を簡便かつ自在に合成することが可能となっています。
もし金属触媒反応を体内で行うことができれば、患者の体内の狙った臓器で速やかに薬を合成することが可能になり、副作用を軽減できるかもしれません。また、これまで体内で不安定だった薬が、狙った疾患部位で安定な化合物として合成できるかもしれません。これは疾患を直接、有機反応で治すことにつながり、従来の創薬研究の問題点を解決する治療戦略となると期待されています。
これまで金属触媒反応は、無水かつ反応を妨げる分子がない条件のフラスコ内で行われてきました(図1-1)。しかし、体内では、水、血清、細胞、タンパク質、糖鎖、脂質などさまざまな分子が混在するため、金属触媒はその活性を失い、特定の部位で効率的に金属触媒反応を進行させることは不可能だと考えられてきました(図1-2)。
研究手法と成果
体内の狙った臓器で選択的に金属触媒反応を起こすには、二つの問題を解決しなければなりません。一つ目は、どのように体内で不安定な金属触媒を短時間で臓器に運ぶかという問題です。それには、一般に臓器表面の分子を見分ける抗体に金属触媒を結合して運ぶ方法が考えられます。しかし、抗体は巨大分子(分子量:約15万)のため、目的の臓器に到達するには1日程度を要し、血液中を巡る間に金属触媒が壊れてしまいます。また、臓器に到達しても、臓器の細胞内に取り込まれてしまうため、臓器表面で金属触媒反応を効率的に行うことができません。二つ目は、体内にさまざまな分子が存在する中で、どのような金属触媒反応を選択的に進行させるかという問題です。
一つ目の問題に対して田中克典准主任研究員(理研田中生体機能合成化学研究室)らは、2016年に可溶性タンパク質のアルブミン[5]上でアスパラギン結合型糖タンパク質糖鎖(N-結合型糖鎖)[6]をクラスター化することにより、マウス体内での糖鎖の排出経路を制御したり、臓器選択的な集積を厳密に制御できることを明らかにしました(図2-1)注1)注2)。この際、糖鎖クラスターは30分程度で臓器へ到達しました。特に、末端にシアル酸を持つ糖鎖クラスターは肝臓に、末端にガラクトースを持つ糖鎖クラスターは腸管に速やかに到達することを見いだしています。
また、田中准主任研究員らは同年、化合物のプロパルギルエステルが疎水性の1級アミンとのみ反応して、対応するアミド化合物が生成されることを発見しました注3)。さらにこの反応が3価の金触媒(Au3+)の存在下で活性化され、生体内のさまざまなアミンと反応(金触媒アミド化反応)して30分以内でアミド化合物が生成されることを見いだしました(図2-2)。
そこで、これらの知見をもとに国際共同研究グループは、糖鎖クラスターを金触媒を狙った臓器へ運ぶ「運び屋」として利用し、臓器で選択的に金触媒アミド化反応を行うことを考えました。まず、末端にシアル酸を持つ糖鎖クラスターと末端にガラクトースを持つ糖鎖クラスターに金触媒を付けた「金の運び屋」を合成しました。
図3のように、金の運び屋をヌードマウスの静脈から導入したところ、体内で金触媒の活性を落とすことなく、30分以内に肝臓または腸管に到達し、金触媒を植え付けることができました。その後、蛍光基を持つプロパルギルエステルを静脈注射したところ、血液中を通って体全体を巡りますが、肝臓、腸管に到達した時に、先に植え付けていた金触媒と反応して臓器表面にあるリジン残基などのアミノ基との間で金触媒アミド化反応を起こしました。
図4-2は、図3-1の方法で選択的に肝臓を蛍光標識したマウスの非侵襲的な蛍光イメージング[7]の画像で、肝臓が蛍光標識されていることが確認できます。また、図3-2の方法で選択的に腸管を蛍光標識したヌードマウスでは、腸管が蛍光標識されていることが確認できます(図4-3)。一方、図4-1は、蛍光基を持つプロパルギルエステルのみを静脈注射した蛍光イメージングの画像で、蛍光強度が全体的に著しく弱く、体内でプロパルギルエステルのアミド化反応による蛍光標識が起きていないことを示しています。
さらに、図4-2で観察したヌードマウスから蛍光標識した肝臓を取り出し、組織切片を蛍光顕微鏡で確認しました。その結果、蛍光標識は金の運び屋として使った糖鎖クラスターが認識する受容体が発現している中心静脈周辺で起きていることが分かりました(図5)。
以上の結果から、金の運び屋として使った糖鎖クラスターの種類により、選択的に肝臓や腸管が蛍光標識できることが明らかとなりました。この手法により、生きている動物体内において狙った臓器で選択的な金属触媒反応を起こすことに成功しました。
注1)2016年2月23日プレスリリース「生体内部を高度に認識できる糖鎖複合体」
注2)2016年11月28日プレスリリース「糖鎖は不均一であることが重要」
注3)2016年10月13日プレスリリース「水中・室温・無触媒で起こるアミド化反応」
今後の期待
今回、国際共同研究グループが開発した方法を用いて狙った臓器で選択的に金属触媒による有機反応を起こせば、がんなどの疾患部位で、直接、薬などの生理活性分子を合成できると期待できます。
また、金触媒だけではなく、さまざまな金属触媒反応にも展開できると考えられ、体内での薬の合成が可能となります。その結果、薬が疾患部位以外で作用して起きる副作用の問題、あるいはペプチドなど不安定な薬の体内での安定性の問題を解決できると期待できます。このように、今後、体内での創薬研究が実現される可能性が生まれました。
※国際共同研究グループ
理化学研究所
田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
大学院生リサーチ・アソシエイト 坪倉 一輝(つぼくら かずき)
特別研究員 ケンワード・ヴォン(Kenward Vong)
特別研究員 アンバラ・プラディプタ(Ambara Pradipta)
特別研究員(研究当時)小椋 章弘(おぐら あきひろ)
テクニカルスタッフⅡ 浦野 清香(うらの さやか)
国際プログラム・アソシエイト レギーナ・シブガトウリナ (Regina Sibgatullina)
ライフサイエンス技術基盤研究センター
センター長 渡邊 恭良(わたなべ やすよし)
生命機能動的イメージング部門 イメージング基盤・応用研究グループ
健康・病態科学研究チーム
研究員 野崎 聡(のざき さとし)
生体機能評価研究チーム
研究員 田原 強(たはら つよし)
チームリーダー 尾上 浩隆(おのえ ひろたか)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
早稲田大学 理工学術院
教授 中尾 洋一(なかお よういち)
原論文情報
- Kazuki Tsubokura, Kenward K. H. Vong, Ambara R. Pradipta, Akihiro Ogura, Sayaka Urano, Tsuyoshi Tahara, Satoshi Nozaki, Hirotaka Onoe, Yoichi Nakao, Regina Sibgatullina, Almira Kurbangalieva, Yasuyoshi Watanabe, and Katsunori Tanaka, "In vivo gold complex catalysis within live mice", Angewandte Chemie International Edition, doi: 10.1002/anie.201610273
発表者
理化学研究所
准主任研究員研究室 田中生体機能合成化学研究室
准主任研究員 田中 克典(たなか かつのり)
大学院生リサーチ・アソシエイト 坪倉 一輝(つぼくら かずき)
特別研究員 ケンワード・ヴォン
 左から坪倉一輝、ケンワード・ヴォン、田中克典
左から坪倉一輝、ケンワード・ヴォン、田中克典
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.糖鎖クラスター
本研究では、同一あるいは数種類の単分子糖鎖がある基盤上に複数個並べられた構造を糖鎖クラスターと呼ぶ。 - 2.ヌードマウス
先天的に胸腺を欠くマウス。胸腺を欠損するためにT細胞が作られず、免疫不全を起こす。他の動物種の細胞を拒絶する力も弱いので、ヒトの組織やがん細胞の移植実験によく用いられる。 - 3.プロパルギルエステル
プロパルギルオキシ基は、-O-C2H2C≡CHで表される三重結合を持つアルコキシ基。プロパルギルエステルは、カルボン酸(R-CO-OH)のOHがプロパルギルオキシ基で置換されたR-CO-O-C2H2C≡CHの構造式で表されるエステル。 - 4.ドラッグデリバリーシステム(DDS)
体内の薬物分布を量的・空間的・時間的に制御する薬物伝達システム。特定の組織への効果や副作用の軽減が期待でき、開発が進められている。 - 5.アルブミン
血清中の大部分を占め、分子量が6万程度の極めて安定な可溶性タンパク質。さまざまな薬物と配位する疎水性ポケットが存在し、血中内を運搬する。表面に反応性の高いリジン残基が30個程度存在するため、糖鎖などの機能性低分子を付着させる生体高分子としてもよく使用される。生体内に静脈注射すると、皮下の毛細血管を通り、体全体に広く分布する。血流の状態をよく反映するため、核磁気共鳴画像法(MRI)などを用いた疾患の診断薬としても利用される。 - 6.アスパラギン結合型糖タンパク質糖鎖( N-結合型糖鎖)
タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖。細胞内ではタンパク質のフォールディング(ポリペプチドの折り畳みによる高次構造の構築)や細胞内での輸送を制御することが分かっている。一方、細胞外ではタンパク質の血中内安定性、タンパク質/タンパク質相互作用、免疫調節、細胞増殖、がんの浸潤など多くの生物学的現象に重要な役割を果たしていると考えられるが、その標的については未知な点が多い。特に、糖鎖末端のシアル酸が重要な意味を持つ可能性が知られていたが、国際共同研究グループの成果によって、全ての糖鎖の部分構造が動物内での臓器選択性や動態、あるいは血中安定性に著しい影響を及ぼしていることが明らかとなっている。 - 7.非侵襲的な蛍光イメージング
動物を生きたままで動態や集積をイメージングにより可視化する方法の一つ。本研究で実施した近赤外線領域に吸収を持つ蛍光イメージングや、PET(Positron Emission Tomography)、SPECT(Single Photon Emission Computed Tomography)、あるいはMRIが代表例である。
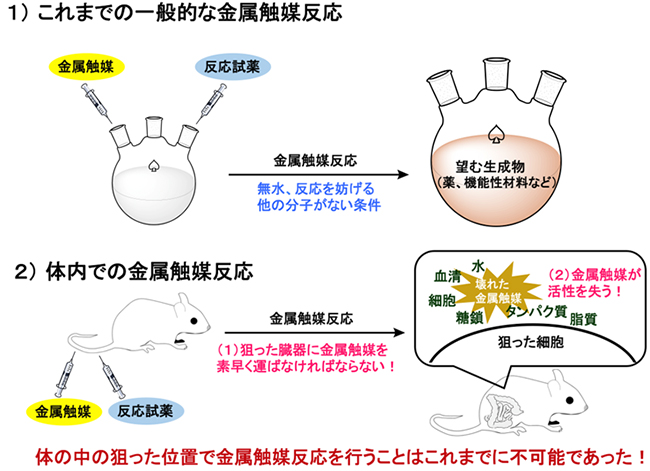
図1 従来のフラスコ内での金属触媒反応と体内での金属触媒反応
1)従来、薬や機能性材料などの分子を合成するには、フラスコ内に金属触媒と反応試薬を入れ、無水かつ反応を妨げる分子がない条件で反応液を撹拌し金属触媒反応を進行させた。
2)体内の狙った臓器で金属触媒反応を行うには、臓器に金属触媒を素早く運ぶ必要があるが、金属触媒が臓器に到達しても、体内の水、血清、細胞、タンパク質、糖鎖、脂質などによって、すぐに金属触媒が活性を失う。そのため、体内で金属触媒反応を実現することは不可能と考えられてきた。
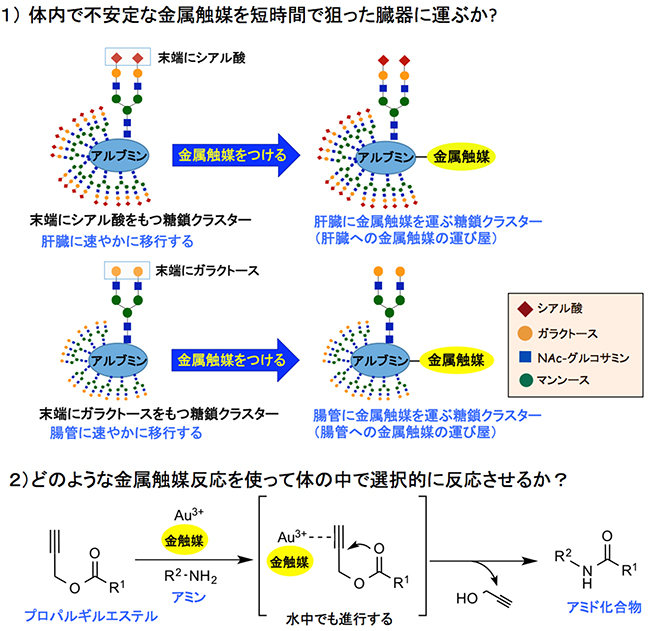
図2 糖鎖クラスターによる金属触媒の運び屋と3価の金触媒によるアミド化反応
1)末端にシアル酸を持つアスパラギン結合型糖タンパク質糖鎖(N-結合型糖鎖)をアルブミン表面に10分子導入すると、この糖鎖クラスターは肝臓に速やかに到達する。一方、末端にガラクトースを持つN-結合型糖鎖をアルブミン表面に10分子導入すると、腸管に到達する。これら二つの糖鎖クラスターに金属触媒をつけることによって、肝臓や腸管に選択的に金属触媒を運ぶ「金属触媒の運び屋」が作られる。
2)プロパルギルエステルに3価の金触媒(Au3+)と1級アミンを反応させると、水中でも速やかにアミド化合物が生成される。
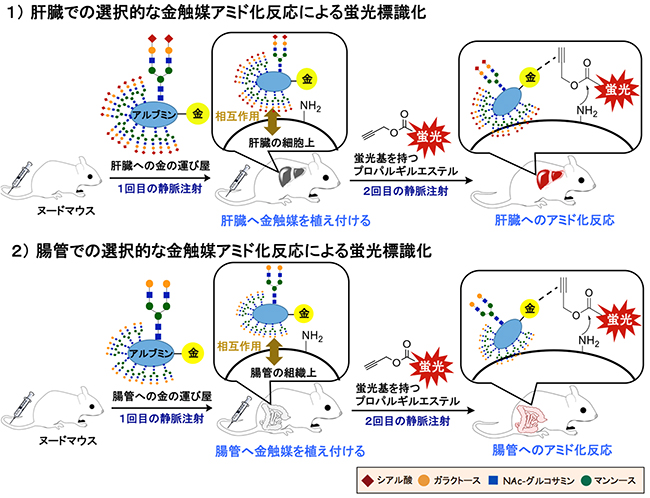
図3 金触媒アミド化反応による肝臓や腸管への選択的な蛍光標識
1)「肝臓への金の運び屋」となる末端にシアル酸を持つ糖鎖クラスターをヌードマウスに静脈注射で導入し、選択的に肝臓に金触媒を植え付ける。続いて、蛍光基(Cy7.5蛍光基やTAMRA蛍光基)を持つプロパルギルエステルを静脈注射で導入すると、プロパルギルエステルは血液中を通って体全体を巡るが、肝臓に到達した時に、あらかじめ植え付けた金触媒によってアミド化反応が起こり、肝臓を蛍光標識できる。
2)「腸管への金の運び屋」となる末端にガラクトースを持つ糖鎖クラスターをヌードマウスに静脈注射し、選択的に腸管に金触媒を植え付ける。続いて、蛍光基(Cy7.5蛍光基やTAMRA蛍光基)を持つプロパルギルエステルを静脈注射で導入すると、プロパルギルエステルは血液中を通って体全体を巡るが、腸管に到達した時に、あらかじめ植え付けた金触媒によってアミド化反応が起こり、腸管を蛍光標識できる。
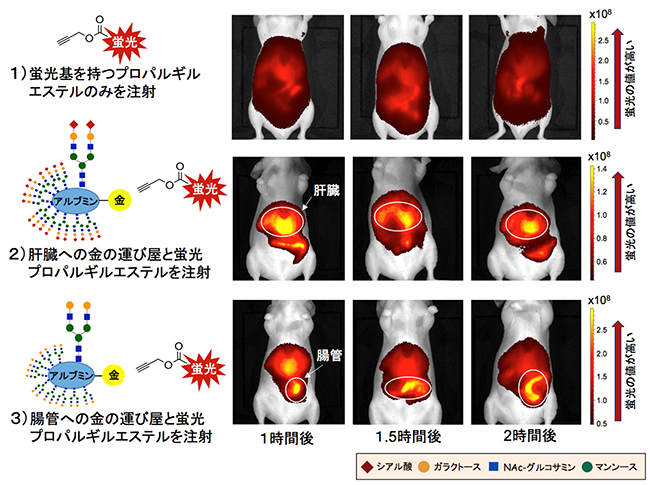
図4 肝臓や腸管での選択的な金触媒アミド化反応による蛍光標識の生体内イメージング
図3の方法で蛍光標識したヌードマウスの臓器への集積過程を非侵襲的な蛍光イメージングで経時的に観察した。腹面から撮影した画像。
1)コントロール実験として、蛍光基を持つプロパルギルエステルのみを静脈注射した画像。蛍光強度は著しく弱く、臓器の蛍光標識が起きていないことが分かる。
2)「肝臓への金の運び屋」と蛍光基を持つプロパルギルエステルを静脈注射した画像(図3-1の方法)。肝臓に強い蛍光が見られ、肝臓で選択的に金触媒によるアミド化反応が進行したことが分かる。
3)「腸管への金の運び屋」と蛍光基を持つプロパルギルエステルを静脈注射した画像(図3-2の方法)。反応時間の経過に伴って、腸管に強い蛍光が見られ、腸管表面で選択的に金触媒によるアミド化反応が進行したことが分かる。

図5 金触媒アミド化反応で蛍光基が結合した肝臓切片の顕微鏡観察
肝臓で選択的に金触媒アミド化反応を行った後、マウスを剖検し、肝臓切片を蛍光顕微鏡で観察した。画像は、それぞれ左から明視野画像、核をDAPI(青)で染色した画像、金触媒アミド化反応で肝臓細胞にTAMRA蛍光基(赤)を結合させた画像。
1)コントロール実験として、蛍光基を持つプロパルギルエステルのみを静脈注射したマウスの肝臓切片では、TAMRA蛍光基(赤)がほとんど見えないことから、金触媒アミド化反応は起っていないことが分かる。
2)「肝臓への金の運び屋」の糖鎖クラスターと蛍光基を持つプロパルギルエステルを静脈注射したマウスの肝臓切片。肝臓の中心静脈付近にTAMRA蛍光基(赤)が顕著に観察される。肝臓の中心静脈付近には、糖鎖クラスターが相互作用する受容体が発現しており、糖鎖クラスターが正確に肝臓へ金触媒を運び、金触媒アミド化反応が起こったことを示している。
