要旨
理化学研究所(理研)田中生体機能合成化学研究室の田中克典准主任研究員、レギーナ・シブガチュリナ国際プログラム・アソシエイト、リリア・ラティポバ客員研究員らの国際共同研究グループ※は、マウスを用いて、複数の種類の糖鎖からなる「不均一な糖鎖クラスター」が、その種類の違いによって生体内でのタンパク質の排出や臓器選択的な集積をコントロールする「分子認識機構」として機能していることを明らかにしました。
生体内の糖鎖のほとんどは、1種類の分子としてはではなく、異なる構造を持つ複数個の糖鎖がタンパク質や細胞の表面に付いた状態で存在しています。これを「糖鎖の不均一性」と呼びます。特に細胞は、多くの種類の糖鎖分子からなる糖鎖クラスター[1]で表面が覆われています。しかし、糖鎖の不均一性は生体内で分解などを受けて偶然生じた結果なのか、タンパク質や細胞の生体内での動態や集積に重要な影響を及ぼす意味のある高次構造なのかは、明らかになっていませんでした。
国際共同研究グループは、田中克典准主任研究員らが開発した「理研クリック反応[2]」を用いて糖鎖の付加位置や量を制御することで、アルブミン[3]の表面に多様な不均一な糖鎖クラスターを合成しました。また、6種類の不均一な糖鎖クラスターをマウスへ注射し、非侵襲的な蛍光イメージング[4]を行いました。その結果、クラスターの構造の違いによって、膀胱や腸管からの排出速度や生体内での集積箇所が変化するなど、糖鎖の不均一性がタンパク質の動態や臓器選択的な集積に大きく影響していることが分かりました。これは、生体内に「糖鎖の不均一性効果」という分子認識機構が存在することを示しています。今後、この糖鎖特有の分子認識機構が抗体やペプチドなどに代わる新しいドラッグデリバリーシステム(DDS)[5]の設計につながると期待できます。
本研究成果は、ドイツの科学雑誌『Advanced Science』に掲載されるのに先立ち、オンライン版(11月28日付け:日本時間11月28日)に掲載されます。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)の研究領域「分子技術と新機能創出」(研究総括:加藤隆史)研究課題名「生体内合成化学治療:動物内での生理活性分子合成」(研究者:田中克典)の一環として行われました。
※国際共同研究グループ
理化学研究所
田中生体機能合成化学研究室
准主任研究員 田中 克典 (たなか かつのり)
客員研究員 リリア・ラティポバ (Liliya Latypova)
国際プログラム・アソシエイト レギーナ・シブガチュリナ (Regina Sibgatullina)
特別研究員(研究当時)小椋 章弘 (おぐら あきひろ)
特別研究員 藤木 勝将 (ふじき かつまさ)
テクニカルスタッフⅡ 浦野 清香 (うらの さやか)
大学院生リサーチ・アソシエイト 坪倉 一輝 (つぼくら かずき)
ライフサイエンス技術基盤研究センター
センター長 渡辺 恭良 (わたなべ やすよし)
生命機能動的イメージング部門 イメージング基盤・応用研究グループ
健康・病態科学研究チーム
研究員 野崎 聡 (のざき さとし)
生体機能評価研究チーム
研究員 田原 強 (たはら つよし)
グループディレクター 尾上 浩隆 (おのえ ひろたか)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ (Almira Kurbangalieva)
大学院生 アルス・カビブラクマノバ (Alsu Khabibrakhmanova)
背景
糖鎖とは、最も単純な糖である単糖(シアル酸やガラクトースなど)が数個、ときには数百個以上も枝分かれしながら連なったものです。単糖の種類や数、並び方、枝分かれの違いによって、糖鎖はとても多くの種類に分けられます。タンパク質や細胞の表面には「アスパラギン結合型糖タンパク質糖鎖(N-結合型糖鎖)[6]」と呼ばれる糖鎖が付いています。N-結合型糖鎖は、ウイルスの認識、細胞同士の接着、タンパク質の安定性などに深く関わっており、生命の維持活動に欠かせない分子です。
しかし実際には、1種類の糖鎖分子が生体内で重要な機能を示すことはほとんどありません。異なる構造を持つ複数個のN -結合型糖鎖の分子が、タンパク質や細胞の表面に付いています(図1)。これは「糖鎖の不均一性」と呼ばれています。特に細胞は、多くの種類の糖鎖分子からなる糖鎖クラスターで表面が覆われています。
一方で、糖鎖分子の種類は無数ともいえるほど多く、構造の複雑な糖鎖分子を有機合成することは簡単ではありません。また、N -結合型糖鎖は天然からごく少量しか得ることができないため、これまでに糖鎖の不均一性を解析することはできませんでした。そのため、糖鎖の不均一性は生体内で分解などを受けて偶然生じた結果なのか、タンパク質や細胞の生体内での動態や集積に重要な影響を及ぼす意味のある高次構造なのかは明らかになっていませんでした。
研究手法と成果
これまでに田中克典准主任研究員らは、独自に開発した「理研クリック反応」を用いて、アルブミンのリジン残基に単一なN-結合型糖鎖を10分子導入して、アルブミン上に細胞表面の糖鎖構造を疑似化した「均一な」糖鎖クラスターを合成することに成功しています。また、ヌードマウス[7]内でこれら糖鎖クラスターの非侵襲的な蛍光イメージングを行うことにより、アルブミン表面の糖鎖の構造が、糖鎖の排出の経路や臓器選択的な集積を制御することを明らかにしています注)。
今回、国際共同研究グループは、アルブミンの表面に対して、2種類の異なるN-結合型糖鎖を全体で10分子になるように導入して、「不均一な」糖鎖クラスターを合成することを試みました(図2)。その結果、理研クリック反応を使った二つの効率的な糖鎖導入法(図2)により、2種類の糖鎖の導入位置が異なる不均一な糖鎖クラスターや、2種類の糖鎖間の距離を厳密に制御した不均一な糖鎖クラスターを合成することに成功しました。
国際共同研究グループは、6種類の不均一な糖鎖クラスターを合成しました(図3)。糖鎖クラスター1と2は、シアル酸とガラクトースを末端に持つ2種類のN-結合型糖鎖の位置を入れ替えた糖鎖クラスターです。糖鎖クラスター3は、シアル酸とガラクトースを末端に持つ2種類のN-結合型糖鎖の位置関係がクラスター上で定まっています。糖鎖クラスター4では、一つの糖鎖分子の構造が先で分岐しており、末端にシアル酸とマンノースが分子内で共存しています。この分岐を2種類の糖鎖構造で置き換えたのが糖鎖クラスター5です。また、糖鎖クラスター1~5では、アルブミンに導入した糖鎖が全部で10分子であるのに対して、全部で4分子にした糖鎖クラスター6も合成しました。
合成した不均一な糖鎖クラスターをヌードマウスに静脈注射し、非侵襲的な蛍光イメージングを使ってその動態解析を行いました。その結果、アルブミン表面へ導入した二つの異なる糖鎖分子の位置関係や総合的な個数(糖鎖の価数)によって排出の経路や速度、あるいは肝臓への集積が大きく影響を受けることを発見しました(図3)。
糖鎖クラスター1は体内を巡った後、膀胱と腸管から尿と便としてほぼ同等量で排泄されましたが、2種類のN-結合型糖鎖のタンパク質への付加位置を変化させた糖鎖クラスター2は、1に比べて、腸管から便としての排泄速度が上がることが分かりました。さらに、シアル酸とガラクトースを末端に持つ2種類のN-結合型糖鎖の位置関係をクラスター上で固定することにより(糖鎖クラスター3)、腸管への移行がより一層促進されました。
一つの糖鎖分子の末端にシアル酸とマンノースの両方を持つ糖鎖クラスター4では、肝臓の非実質肝細胞[8]に選択的に集積しました。しかし、この分岐を2種類の糖鎖分子で置き換えた糖鎖クラスター5の場合には、即座に膀胱から尿として排泄されることが分かりました。さらに、糖鎖クラスター5に導入した糖鎖の総合的な分子数を半分以下に減らすことによって(糖鎖クラスター6)肝臓に強く集積することが分かりました。
これらの結果は、不均一な糖鎖クラスター、つまり糖鎖の不均一性がタンパク質の集積や動態に大きく影響すること示しています。生体内では、複数の種類の糖鎖がタンパク質や細胞表面にクラスター化することによって、たくさんの不均一性のコンビネーションを生み出していると考えられます。糖鎖の不均一性のコンビネーションが生体内でのパターン認識[9]を可能とすることで、タンパク質の動態や臓器への選択的な集積をコントロールするための「糖鎖の不均一性効果」という分子認識機構が機能することが示されました。
注)2016年2月23日プレスリリース「生体内部を高度に認識できる糖鎖複合体」
今後の期待
本成果は、生体内で「糖鎖の不均一性効果」という糖鎖特有の「分子認識機構」が存在することを示しています。今後、この分子認識機構が抗体やペプチドなどに代わる、がんや疾患に特異的な新しいドラッグデリバリーシステム(DDS)の分子設計につながると期待できます。
原論文情報
- Liliya Latypova, Regina Sibgatullina, Akihiro Ogura, Katsumasa Fujiki, Alsu Khabibrakhmanova, Tsuyoshi Tahara, Satoshi Nozaki, Sayaka Urano, Kazuki Tsubokura, Hirotaka Onoe, Yasuyoshi Watanabe, Almira Kurbangalieva and Katsunori Tanaka, "Sequential double “clicks” toward structurally well-defined heterogeneous N-glycoclusters: The importance of cluster heterogeneity on pattern recognition in vivo", Advanced Science, doi: 10.1002/advs.201600394
発表者
理化学研究所
准主任研究員研究室 田中生体機能合成化学研究室
准主任研究員 田中 克典 (たなか かつのり)
国際プログラム・アソシエイト レギーナ・シブガチュリナ (Regina Sibgatullina)
客員研究員 リリア・ラティポバ (Liliya Latypova)
 左から田中准主任研究員、シブガチュリナ国際プログラム・アソシエイト、リリア・ラティポバ客員研究員
左から田中准主任研究員、シブガチュリナ国際プログラム・アソシエイト、リリア・ラティポバ客員研究員
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.クラスター
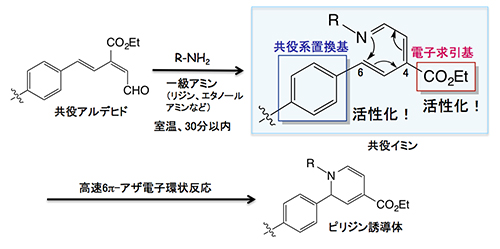
本プレス発表では、同一、あるいは数種類の単分子糖鎖が、ある基盤上に複数個並べられた構造をクラスターと呼ぶ。同一の糖鎖がクラスターを構築するとき、「均一な」糖鎖クラスター、数種類の糖鎖がクラスターを構築する場合に、「不均一な」糖鎖クラスターと呼ぶ。 - 2.理研クリック反応(6π-アザ電子環状反応)
不飽和アルデヒドとリジン残基のような1級アミンが反応すると、1-アザトリエンが生成する。1-アザトリエンは、末端炭素原子と窒素原子が結合してピリジン誘導体を与える(アザ電子環状反応)。この反応は古くからよく知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率もよくなかったことから積極的に有機合成に利用されることはなかった。しかし1998年に、田中准主任研究員らがアザ電子環状反応を強力に促進させる置換基効果を発見して以来、有機合成に限らず生体分子や細胞の標識、あるいは複合化のための反応として利用されている。現在、理研クリック反応として、国際共同研究グループが中心となり診断や放射線治療に向けた研究を展開している。
- 3.アルブミン
血清中の大部分を占め、分子量が6万程度の極めて安定な可溶性タンパク質。さまざまな薬物と配位する疎水性ポケットが存在し、血中内を運搬する。表面に反応性の高いリジン残基が30個程度存在するため、糖鎖などの機能性低分子を付着させる生体高分子としても良く使用される。生体内に静脈注射すると、皮下の毛細血管を通り、体全体に広く分布する。血流の状態を良く反映するため、核磁気共鳴画像法(MRI)などを用いた疾患の診断薬としても利用される。 - 4.非侵襲的な蛍光イメージング
動物を生きたままで動態や集積をイメージングにより可視化する方法の一つ。本発表で実施した近赤外線領域に吸収を持つ蛍光イメージングや、PET(Positron Emission Tomography)、SPECT(Single Photon Emission Computed Tomography)、あるいはMRIが代表例である。 - 5.ドラッグデリバリーシステム(DDS)
体内の薬物分布を量的・空間的・時間的に制御し、コントロールする薬物伝達システム。特定の組織への効果や副作用の軽減が期待でき、開発が進められている。 - 6.アスパラギン結合型糖タンパク質糖鎖( N-結合型糖鎖)
タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖。細胞内では、タンパク質のフォールディング(ポリペプチドの折り畳みによる高次構造の構築)や細胞内での輸送を制御することが分かっている。一方、細胞外では、タンパク質の血中内安定性、タンパク質/タンパク質相互作用、免疫調節、細胞増殖、がんの浸潤など多くの生物学的現象に重要な役割を果たしていると考えられるが、その標的については未知な点が多く、詳細な機能解明については今後の研究成果が待たれる。特に、糖鎖末端のシアル酸が重要な意味を持つ可能性が知られていたが、国際共同研究グループの成果によって、全ての糖鎖の部分構造が動物内での臓器選択性や動態、あるいは血中安定性に著しい影響を及ぼしていることが明らかとなっている。 - 7.ヌードマウス
先天的に胸腺を欠くマウス。胸腺を欠損するためにT細胞が作られず、免疫不全を呈する。他の動物種の細胞を拒絶する力も弱いので、ヒトの組織やがん細胞の移植実験によく用いられる。 - 8.非実質肝細胞
主な肝機能を担う肝臓の大部分を占める細胞群を実質幹細胞という。一方、類洞内皮細胞やクッパー細胞、星細胞(伊東細胞)は非実質肝細胞と呼ばれ、肝臓での異物認識・排除や免疫調節、または肝繊維化過程などに関与する。 - 9.パターン認識
本発表では、ある一つの分子が特定の受容体を認識する場合において、糖鎖クラスターのような複数個の分子が二つ以上の受容体を「パターン」で認識する場合を指す。複数個と複数個の認識である。
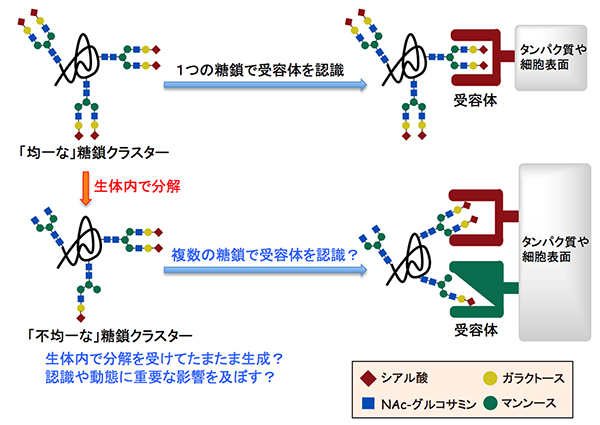
図1 「糖鎖の不均一性」が生体内での認識や動態に与える影響
「均一な」糖鎖クラスターは、タンパク質や細胞表面の特定の受容体と相互作用する。一方で「均一な」糖鎖クラスターは、生体内で酵素などに分解を受けて「不均一な」糖鎖クラスターに次第に変化する。これは偶然なのか、あるいは複数の糖鎖で受容体を認識することによって動態や集積に重要な影響を及ぼす意味のある高次構造なのか、これまでに明らかになっていなかった。
N-型結合型糖鎖を構成する各シンボルは、赤菱形:シアル酸、黄色丸:ガラクトース、青四角:N-アセチルグルコサミン、緑丸:マンノースを示す。
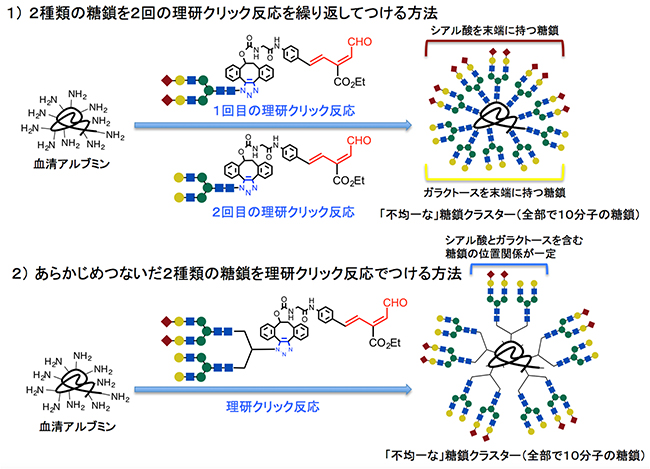
図2 「理研クリック反応」を用いた「不均一な」糖鎖クラスターの二つの合成法
「理研クリック反応」を用いた二つの「不均一な」糖鎖クラスター合成法を確立した。N-型結合型糖鎖を構成する各シンボルは、赤菱形:シアル酸、黄色丸:ガラクトース、青四角:N-アセチルグルコサミン、緑丸:マンノースを示す。
1)アルブミンに対して、理研クリック反応によりまず一つのN-結合型糖鎖(シアル酸を末端に持つ糖鎖)を5分子導入した後、再度理研クリック反応を用いて異なるもう1分子のN-結合型糖鎖(ガラクトースを末端に持つ糖鎖)を5分子導入した。全体で10分子の糖鎖がタンパク質上に導入された。さらに、アルブミンに反応させる糖鎖の順番を変えること(1回目でガラクトースを末端に持つ糖鎖分子を導入、2回目でシアル酸を末端に持つ糖鎖分子)によって、2種類の糖鎖の導入位置が異なった不均一な糖鎖クラスターを合成することができた(図3の糖鎖クラスター1と2の構造の違いを参照)。
2)アルブミンに対して、あらかじめシアル酸とガラクトースを末端に持つ2種類のN-結合型糖鎖をつないだ5分子を理研クリック反応によって一挙に導入し、全体で10分子の糖鎖になるように導入した。この方法により、アルブミン上の2種類の糖鎖の位置関係を一定にすることができた。
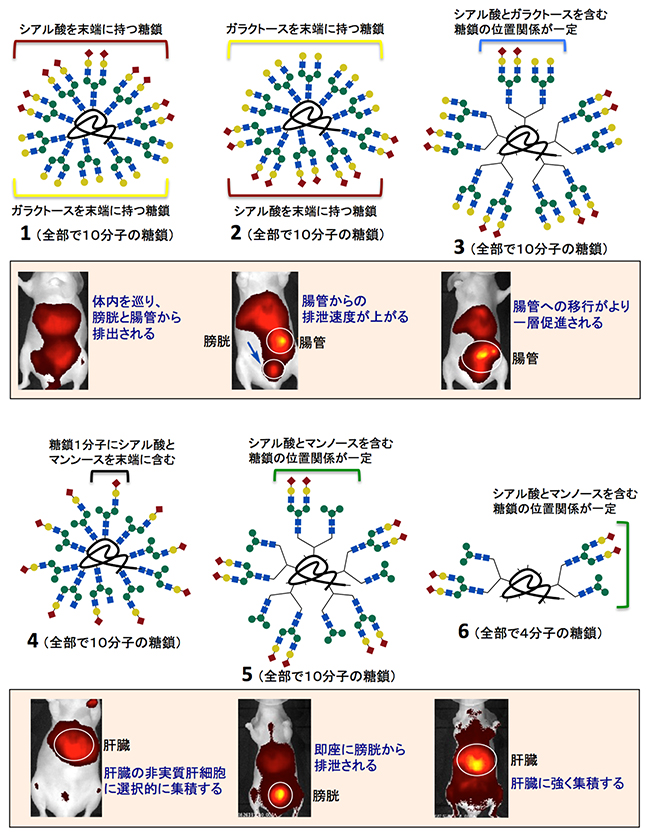
図3 合成した「不均一な」糖鎖クラスターとマウス内での非侵襲的な蛍光イメージング
図2の方法で合成した「不均一な」糖鎖クラスターをヌードマウスに静脈注射し、臓器への集積や排出過程を経時的に観察した。図は3時間後に腹面から撮影した蛍光イメージを示す。N-型結合型糖鎖を構成する各シンボルは、赤菱形:シアル酸、黄色丸:ガラクトース、青四角:N-アセチルグルコサミン、緑丸:マンノースを示す。
(1)シアル酸、およびガラクトースを末端に持つN-型糖鎖が5分子ずつアルブミンに導入された構造。体内を巡った後、膀胱と腸管から排泄された。
(2)糖鎖クラスター1に付いている2種類のN-型糖鎖の付加位置をそっくりそのまま入れ替えた構造。糖鎖クラスター1に比べて、腸管からの排泄速度が向上した。
(3)糖鎖の種類や総数は糖鎖クラスター1や2と同じ(10分子)であるが、2種類のN-結合型糖鎖の位置がクラスター上で固定された構造。腸管への移行がより一層促進された。
(4)末端にシアル酸とマンノースの両方を持つ糖鎖分子を10分子並べたクラスター構造。肝臓の非実質肝細胞に選択的に集積した。
(5)シアル酸とマンノースを末端に持つ2種類のN-結合型糖鎖の位置がクラスター上で固定された構造(糖鎖の総数は10分子)。即座に膀胱から排泄された。
(6)糖鎖クラスター5と同じ構造であるが、糖鎖の総数を4分子に減らしたクラスター構造。排泄は顕著に押さえられ、肝臓に選択的に集積した。
