要旨
理化学研究所(理研)環境資源科学研究センター触媒・融合研究グループの五月女宜裕研究員(袖岡有機合成化学研究室研究員)、袖岡幹子グループディレクター(袖岡有機合成化学研究室主任研究員)、創発物性科学研究センター物質評価支援ユニットの橋爪大輔ユニットリーダーらの共同研究グループ※は、新しいニッケル錯体触媒[1]を開発し、X線結晶構造解析、分光学的手法、計算科学により、ニッケル錯体の結晶および反応溶液中の構造が歪んだ八面体であることを明らかにしました。また、電子密度分布解析[2]によるニッケル錯体の電子構造の可視化にも成功しました。
右手と左手のように、実像と鏡像を重ね合わせることができない分子を「キラル分子(不斉分子)」といいます。例えば、生体において核酸(DNA、RNA)はD体[3]の糖で構成され、タンパク質は主にL体[3]のアミノ酸で構成されています。そのため生物はキラル分子を識別できることから、生体高分子と選択的に相互作用するキラル分子の作製は、医薬や農薬の開発において重要です。特に、少量の金属塩と不斉配位子[4]の組み合わせを選択することで、さまざまなキラル分子を作り出す「触媒的不斉反応[5]」が近年盛んに開発されています。しかし、金属錯体触媒が反応基質をどのように活性化するのか、その仕組みの解明に向け、金属錯体触媒の電子構造について実験的に検討されたことはありませんでした。従来の研究では反応収率や選択性を指標に、金属塩と不斉配位子の種類や混合割合を調整する試行錯誤により、有用な触媒を見つけてきました。
今回、共同研究グループは「不斉[3+2]環化付加型反応[6]」を実現するニッケル錯体触媒を開発し、X線結晶構造解析を行いました。その結果、Ni中心に(Λ)-キラリティ[7]を持つ“歪んだ八面体構造”であることが分かりました。また、電子密度分布解析により、電子不足なdz2軌道[8]を可視化することに成功しました。さらに、分光学的手法で得られたスペクトルを計算科学により検証することで、開発したニッケル錯体が反応溶液中でも歪んだ八面体構造をしていることを示しました。開発した触媒により、既存の分子とは置換基パターンの異なる新しいキラル分子の合成が実現されました。また一連の解析手法により、ニッケル錯体触媒が反応基質をどのように活性化するのか、実験的かつ定量的に理解することができました。
本成果は今後、金属錯体触媒の論理的かつ効率的な開発につながると期待できます。
本研究成果は、国際科学雑誌『Nature Communications』(4月6日付け:日本時間4月6日)に掲載される予定です。
※共同研究グループ
理化学研究所
環境資源科学センター
触媒・融合研究グループ
研究員 五月女 宜裕(そうとめ よしひろ)(袖岡有機合成化学研究室 研究員)
グループディレクター 袖岡 幹子(そでおか みきこ)(袖岡有機合成化学研究室 主任研究員)
先進機能元素化学研究チーム
チームリーダー 内山 真伸(うちやま まさのぶ)(内山元素化学研究室 主任研究員)
専任研究員 村中 厚哉(むらなか あつや)(内山元素化学研究室 専任研究員)
創発物性科学研究センター
超分子機能化学部門 物質評価支援ユニット
ユニットリーダー 橋爪 大輔(はしづめ だいすけ)
袖岡有機合成化学研究室
研修生(研究当時) 中村 元太(なかむら げんた)
特別研究員(研究当時)シルバン・レクター(Sylvain Lectard)
明治大学 理工学部
教授 土本 晃久(つちもと てるひさ)
背景
右手と左手のように、実像と鏡像を重ね合わせることができない分子を「キラル分子(不斉分子)」といいます。例えば、生体において核酸(DNA、RNA)はD体の糖で構成され、タンパク質は主にL体のアミノ酸で構成されています。また自然界では、主にL体のアミノ酸より構成されるタンパク質が酵素として働くことで、さまざまなキラル分子が選択的に合成されています。
生物はキラル分子を識別できることから、生体高分子と選択的に相互作用するキラル分子の作製は、医薬や農薬の開発において重要です。そのため、微量の金属塩と不斉配位子の組み合わせを選択することで、目的とするキラル分子を人工的に供給する「触媒的不斉反応」が活発に開発されています。これにより、医薬や農薬などのビルディングブロック[9]として有用なキラル分子を合成することができます。
しかし、新しい触媒的不斉反応が次々と報告されてきましたが、従来の研究では反応収率や選択性を指標に、金属塩と不斉配位子の種類や混合割合を調整する試行錯誤を重ねることで、有用な触媒を見つけてきました。一方で、金属錯体触媒が反応基質をどのように活性化するのかを可視化できれば、より論理的かつ効率的に金属錯体触媒を開発することが可能になります。
今回、共同研究グループは新たにニッケル錯体触媒を開発し、X線結晶構造解析、分光学的手法、計算科学を駆使して、その結晶構造や電子構造、触媒的不斉反応の機構の解明を試みました。
研究手法と成果
共同研究グループは、α-ケトエステル[10]とニトロン[11](1,3双極子の一つ)の触媒的「不斉[3+2]環化付加型反応」により、既存分子とは置換基パターンが異なる三つの連続する不斉炭素を持つ、新しいへテロ環化合物(5員環)合成法の確立を目指しました。そのためにまず、ニトロンと反応しやすい「ニッケル-エノレート」を形成できるニッケル錯体触媒を開発しました(図1)。
次に触媒の構造を知るために、ニッケル錯体のX線結晶構造解析を行いました(図2左)。その結果、ニッケル錯体はNi中心に(Λ)-キラリティを持つ“歪んだ八面体構造”であること、次の二つの特徴を持つことが分かりました。
① Ni-O4(Niとアセテート配位子の酸素O4)の結合距離が2.302オングストローム(Å、1Åは100億分の1m)と著しく長いため、解離しやすい。つまり、解離により生じるアセテートアニオンがプロトン(H+)を受け取る塩基として働き、α-ケトエステルの脱プロトン化(β位の炭素に結合している水素が外れる)を促進することにより、ニッケル-エノレートが生じると考えられます。
② ジアミン配位子上のN(1)-H(窒素1-水素)は、溶媒のテトラヒドロフランの酸素と水素結合しています。これにより、N(1)-Hは水素結合ドナーとしてニトロンを活性化できる(ニッケルエノラートと反応しやすくする)と考えられます。
また電子密度分布解析により、ニッケル錯体の価電子[12]分布を可視化することに成功しました(図2右)。この図では、電子不足な領域を赤色、電子豊富な領域を青色で示しています。Ni中心とアセテート配位子の酸素(O1、O2、O3、O4)に注目すると、電子不足なNiのd軌道[8](赤)とO1、O2、O3の孤立電子対(青)が相互作用していることが分かります。これは通常の金属-配位子間の相互作用です。一方、O4の孤立電子対(青)はNiの電子豊富な領域(青)に向いています。Niの裸の電子不足な「dz2軌道」(赤)がはっきりと可視化されています。このdz2軌道はα-ケトエステルのカルボニル基と相互作用することで、脱プロトン化を促進すると考えられます。
さらに触媒的不斉反応を理解するためには、溶液中でのニッケル錯体の構造解析も重要です。共同研究グループは、分光学的手法と計算科学とを駆使することで、テトラヒドロフラン溶液中においても、ニッケル錯体が歪んだ八面体構造を持つことを示しました。
以上の結果から、①Niの裸のdz2軌道と解離しやすいアセテート塩基によるα-ケトエステルの脱プロトン化、②ジアミン配位子上のN(1)-Hを水素結合ドナーとして用いるニトロンの活性化を基軸とするモデルを提示しました。本モデルにより、[3+2]環化付加型反応で得られる生成物の絶対立体配置[13]を説明することができます(図3)。
今後の期待
今回開発したニッケル錯体触媒は、α-ケトエステルとニトロンとの不斉[3+2]環化付加型反応を実現しました。これにより、既存の分子とは置換基パターンの異なる新しい分子である、三つの連続する不斉炭素を持つヘテロ環化合物を選択的に合成することが可能となりました。
また、開発したニッケル錯体触媒は歪んだ八面体構造を持ち、裸のdz2軌道と解離しやすいアセテート配位子が存在することを示しました。これは、X線結晶構造解析、分光学的手法、計算科学の三つのアプローチを組み合わせることで、初めて得られた成果です。金属錯体触媒がどのように基質を活性化するかは、これまでベールに包まれていましたが、本研究により、金属錯体の電子構造と活性の相関関係を理解できるようになりました。
本成果により今後、複雑なキラル分子の合成を可能とする金属錯体触媒の開発がさらに発展すると期待できます。
原論文情報
- Yoshihiro Sohtome, Genta Nakamura, Atsuya Muranaka, Daisuke Hashizume, Sylvain Lectard, Teruhisa Tsuchimoto, Masanobu Uchiyama, Mikiko Sodeoka, "Naked d-orbital in a centrochiral Ni(II) complex as a catalyst for asymmetric [3+2] cycloaddition", Nature Communications, doi: 10.1038/NCOMMS14875
発表者
理化学研究所
環境資源科学研究センター 触媒・融合研究グループ
研究員 五月女 宜裕(そうとめ よしひろ)
(袖岡有機合成化学研究室 研究員)
グループディレクター 袖岡 幹子(そでおか みきこ)
(袖岡有機合成化学研究室 主任研究員)
創発物性科学研究センター 超分子機能化学部門 物質評価支援ユニット
ユニットリーダー 橋爪 大輔(はしづめ だいすけ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.ニッケル錯体触媒
触媒は一般に金属錯体触媒と非金属(有機)触媒とに分類することができる。本研究で開発したニッケル錯体触媒は中心のNi(Ⅱ)に対して六つの配位子( [4]参照)が配位し、歪んだ八面体構造を持つ。 - 2.電子密度分布解析
X線回折法によって分子構造(結晶構造)だけでなく、化学結合の形成に直接関与する価電子( [12]参照)の分布を観測する解析手法。 - 3.D体、 L体
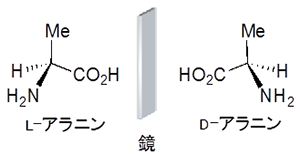
DL表記法は、アミノ酸や糖の右手と左手の関係の分子(鏡像異性体)を区別するために用いられる。図にはアミノ酸の一つであるアラニンの例を示す。
- 4.不斉配位子
配位子とは金属に配位する化合物の総称。配位とは分子中のある原子の孤立電子対(非共有電子対)が金属の陽イオンとの結合に使われて、新たに結合ができることをいう。不斉配位子とは金属に配位し、不斉触媒としての機能を引き出すキラルな化合物のこと。 - 5.触媒的不斉反応
少量の不斉配位子を触媒として用いることで、大量のキラル分子を合成する反応の総称。 - 6.[3+2]環化付加型反応
1,3-双極子(3原子)とアルケン(2原子)との環化反応の総称。5員環が生成する。
![[3+2]環化付加型反応の図](/medialibrary/riken/pr/press/2017/20170406_2/note6.gif)
- 7.(Λ)-キラリティ
二座配位子を二つ以上持つ金属錯体にはキラリティが生じる。三回回転軸から見たとき、二座配位子が形成するらせん構造が左回りのものを(Λ)-キラリティと呼ぶ。Λはラムダと読む。 - 8.dz2軌道、d軌道
dz2とはd軌道の一つ。z軸(紙面垂直)方向に軌道が広がっている。d軌道にはdz2軌道の他に、dxy軌道、dyz軌道、dzx軌道およびdx2-y2軌道がある。d軌道はこれら五つの軌道のエネルギー順位が分裂によって分散することから、「diffuse」の頭文字をとって名付けられた。

- 9.ビルディングブロック
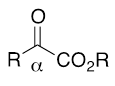
医薬や農薬の多くは複雑な化学構造をした有機化合物である。通常はプラモデルのように複数の部品を組み立てて作られる。この部品に相当する化学変換しやすい小さな分子をビルディングブロックと呼ぶ。 - 10.α-ケトエステル
エステルの(-CO2R)のα位にケトン基を持つ化合物の総称。
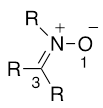
- 11.ニトロン
1位に求核性の酸素、3位に求電子性の炭素を持つ1,3-双極子の一つ。以下に示す構造を含む化合物群の総称。
- 12.価電子
原子やイオンにおいて、結合に関与する最外殻の電子。本研究のNi錯体のNi(Ⅱ)ではd軌道に存在する電子を指す。 - 13.絶対立体配置
キラル分子の右手と左手の関係を区別するために用いられる( [4]参照)。カーン・インゴルド・プレログ(Cahn-Ingold-Prelog)順位則に従い、 RS表記法で議論することが多い。不斉炭素上の四つの結合において、最も優先順位の低い(4)を奥に向け、残りの置換基を優先順位の高い方から数えたとき(1→2→3)、右回りの場合( R)-体であり、左回りの場合( S)-体とする。
![ニッケル-エノレートとニトロンとの不斉[3+2]環化付加型反応の図](/medialibrary/riken/pr/press/2017/20170406_2/fig1.gif)
図1 ニッケル-エノレートとニトロンとの不斉[3+2]環化付加型反応
ニッケル錯体触媒によるα-ケトエステルの活性化を反応駆動力とする、触媒的不斉[3+2]環化付加型反応の開発を試みた。ニッケル-エノレートの電子豊富な二重結合(黒丸の炭素)とニトロンとは、反応しやすいと予想した。Lは通常の配位子、青い三日月は不斉配位子、橙色の丸は、不斉炭素を示す。
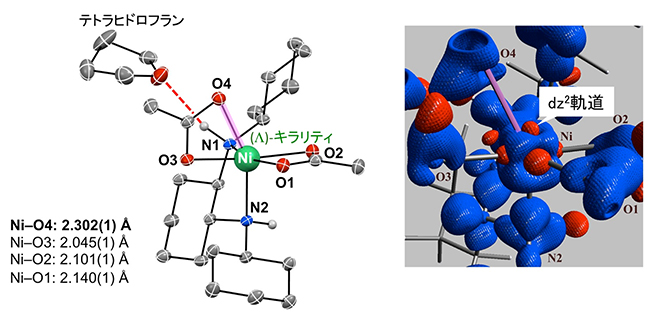
図2 ニッケル錯体触媒のX線結晶構造解析(左)と電子密度分布解析(右)
左:X線結晶構造解析により得られたニッケル錯体の構造。Ni中心に(Λ)-キラリティを持つ歪んだ八面体構造をしている。Ni-O4の結合距離(ピンク色の線)が著しく長いため解離しやすい。配位子上のN(1)-Hは溶媒のテトラヒドロフランの酸素(O)と水素結合している(赤い破線)。これは、ニッケル錯体の調整の際に用いた溶媒のテトラヒドロフランを除去した後に、ジクロロメタン溶媒を用いて再結晶を行ったにもかかわらず、ニッケル錯体とテトラヒドロフランが1:1の割合で結晶中に残っていたため明らかになった。
右:電子密度分布解析により得られたニッケル錯体中心近くの価電子の分布。電子不足な領域を赤色、電子豊富な領域を青色で示す。電子不足なNiのd軌道(赤)とO1、O2、O3の孤立電子対(青)は、通常の金属-配位子間の相互作用をしているが、O4の孤立電子対(青)はNiの電子豊富な領域(青)に向いる(ピンク色の線)。Niの裸の電子不足なdz2軌道(赤)がはっきりと可視化されているのが分かる。
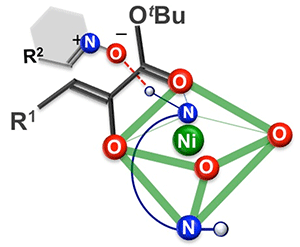
図3 立体選択性を説明するためのモデル
Ni中心の(Λ)-キラリティ上において、ニッケル-エノレートが生成するとともに、水素結合(赤色の破線)によりニトロンが活性化されると考えられる。両反応基質が近接する方向が制御されることにより、高い立体選択性で[3+2]環化付加型反応が進行すると考えられる。またこの図では、ニッケル-エノレートが紙面の上側、ニトロンが紙面の下側にあることを示している。
