ポイント
要旨
理化学研究所(理研)脳科学総合研究センターシナプス分子機構研究チームの吉原良浩チームリーダー、脇阪紀子客員研究員らの研究チーム※は、食べ物が発するアデノシン三リン酸(ATP)[1]へと魚が誘引される際に、鼻腔内の嗅細胞で機能する新しいアデノシン[1]受容体「A2c」を発見しました。
嗅覚系は外界の匂い分子を受容し、その情報を鼻から脳へと伝えて、個体の生存や種の保存のために必要な行動の発現や生理的変化をもたらす神経システムです。特に、食べ物の匂いへの誘引行動、危険な匂いからの逃避行動、フェロモン[2]を介した性行動は、多くの生物に共通する三つの根源的な嗅覚行動です。一方、私たちの体内でエネルギー源、DNAやRNAの構成成分、さらには細胞間や細胞内のシグナル伝達分子として重要な役割を果たしているATPは、魚類などの水棲生物にとっては、水に溶けているATPが匂い分子としても機能すると考えられています。しかし、魚がどのようなメカニズムでATPを嗅いでいるのか、ATPに対してどのような応答を示すのかについては、これまで不明でした。
今回、研究チームは小型魚類のゼブラフィッシュ[3]を用いて、食べ物が発する匂い物質の中で特にATPが低濃度で魚を誘引する作用を持つことを見いだしました。次に、どのようにして魚がATPの匂いを認識しているのかを調べたところ、鼻腔内へ入ったATPが酵素反応によって速やかにアデノシンに分解され、アデノシン受容体A2cを発現する嗅細胞を活性化し、餌を探す行動を引き起こす嗅覚神経回路を駆動させることが分かりました。この新しいアデノシン受容体A2cの遺伝子(A2c)は、哺乳類・鳥類・爬虫類には存在せず、魚類と両生類に特異的であることも分かりました。魚類においては淡水魚・海水魚を問わず、ゲノム配列が発表されている全ての魚種にA2cが存在していることから、ATPを匂い分子として認識して誘引行動を起こす嗅覚神経回路は、すべての魚類に共通して存在すると考えられます。
今後、魚類や両生類に特異的なA2cを調べることで、進化生物学の分野で新たな知見が得られると予想されます。また水産養殖業における効率的な給餌法の開発、飼料の低コスト化などへの応用が期待できます。
本研究成果は、米国の科学雑誌『Current Biology』(5月22日号)に掲載されるのに先立ち、オンライン版(5月11日付け:日本時間5月12日)に掲載されます。
本研究は、日本学術振興会科学研究費補助金新学術領域研究「記憶ダイナミズム」および「蛍光生体イメージング」、HFSP HUMAN FRONTIER SCIENCE PROJECT研究グラント、科学技術振興機構(JST)戦略創造事業ERATO「東原化学感覚シグナルプロジェクト(研究総括:東原和成)」、上原記念生命科学財団、内藤記念科学振興財団および花王株式会社の支援により行われました。
※研究チーム
理化学研究所 脳科学総合研究センター シナプス分子機構研究チーム
チームリーダー 吉原 良浩(よしはら よしひろ)
客員研究員 脇阪 紀子(わきさか のりこ)
副チームリーダー 宮坂 信彦(みやさか のぶひこ)
研究員 小出 哲也(こいで てつや)
テクニカルスタッフⅠ 増田 美和(ますだ みわ)
基礎科学特別研究員 梶山(平木)十和子(かじやま(ひらき)とわこ)
背景
嗅覚は、動物の摂食行動、危険回避行動、繁殖行動などを引き起こし、個体の生存、種の保存のために重要な感覚です。匂い分子は、鼻腔の奥に存在する嗅細胞に発現する嗅覚受容体[4]によって検出されます。ヒトでは約400種類、マウスでは約1,400種類、ゼブラフィッシュでは約300種類の嗅覚受容体遺伝子がゲノムに存在していますが、個々の嗅細胞ではたった1種類の嗅覚受容体遺伝子を選択的に発現しています。鼻腔で受容された匂いの情報は脳の嗅球[5]と呼ばれる一次中枢に伝わりますが、同じ受容体を発現する嗅細胞は嗅球の同じ糸球体[6]に軸索を投射します。匂いの情報はさらに糸球体から高次嗅覚中枢へと伝えられ、「好きな匂い」「危険な匂い」「異性の匂い」などが判断されます。
私たちはカレーのスパイスの匂いやケーキの甘い匂いを嗅ぐと、その食べ物を思い浮かべ、おいしいという記憶が呼び起こされます。ヒトを含め陸上で生活している陸棲生物は空気中に存在する揮発性の物質を匂い分子として感じますが、水中で生活している魚などの水棲生物は水に溶けている物質を匂い分子として感じます。私たちの体内でエネルギー源として、DNAやRNAの構成成分として、さらには細胞間や細胞内のシグナル伝達分子として重要な役割を果たしているアデノシン三リン酸(ATP)も、水棲生物では匂い分子としても機能すると考えられています。しかし、魚がどのようなメカニズムでATPを嗅いでいるのか、ATPに対してどのような応答を示すのかについては、これまで明らかにされていませんでした。
そこで研究チームは、小型魚類のゼブラフィッシュを用いて、ATPに対する行動、その嗅覚受容のメカニズムさらにはATPによって活性化される嗅覚神経回路の解明を試みました。
研究手法と成果
研究チームはまず、匂い分子ATPへのゼブラフィッシュの誘引行動を調べました。ゼブラフィッシュを水槽に入れて馴れさせた後、水槽の片方からATP、もう一方から水を入れたところ、ゼブラフィッシュはATPを投与した側に滞在する時間が増えました(図1A)(YouTube:ATPのおいしそうな匂いに誘われて(動画))。すなわち、ゼブラフィッシュはATPを好きな匂いとして感じ、ATPに「近寄る」という誘引行動を示すことが明らかになりました。しかも、研究チームが2009年に発表した注1)魚が好きな匂いであるアミノ酸のアラニンより、100倍低い濃度のATPでもゼブラフィッシュの誘引行動は観察されました(図1B)。また、嗅上皮[7]を除去したゼブラフィッシュはATPに全く応答しなかったことから、ATPに対するゼブラフィッシュの誘引行動は嗅覚に依存することが分かりました。
次に、ATPによって活性化される嗅覚神経回路の解析を行いました。鼻腔の嗅細胞で受容された匂い情報は、次に嗅覚の一次中枢である嗅球という脳領域内の特定の糸球体へと伝えられ、「匂い地図」として表現されます。その後、終脳や間脳の高次嗅覚中枢へと情報は伝達され、多様な嗅覚行動の発現へと至ります。
そこで、ATPの嗅覚刺激によって活性化される糸球体の同定を試みました。神経活動マーカーである抗リン酸化ERK抗体を用いた免疫染色[8]およびカルシウム感受性タンパク質のGCaMP7発現トランスジェニックゼブラフィッシュの嗅球におけるカルシウムイメージング[9]によって、ATPは外側糸球体2(lG2)というたった一つの糸球体を活性化することが分かりました(図2A)。
さらに、脳切片におけるin situハイブリダイゼーション法[10]による神経活動マーカーのc-Fos[11]のmRNA発現の結果から、ATP刺激によって終脳腹側部交連上核(Vs)、終脳背側部後方領域(Dp)、視床下部腹側核(Hv)などの高次嗅覚中枢領域が活性化されることが明らかになりました(図2B)。そのうちHvという神経核は、哺乳類で摂食をつかさどることが報告されている弓状核と相同な視床下部領域であり、この領域の活性化を介してATPが魚の摂食行動を促進する可能性が示されました。
また、ATPによって活性化される嗅細胞に発現する嗅覚受容体の同定も試みました。まず、ゲノムデータベースに登録されているゼブラフィッシュの約300種類の嗅覚受容体、24種類のATP受容体および9種類のアデノシン受容体をPCR法[12]でクローニングして、それぞれのcRNAプローブ[13]を作製しました。次に、ATPで刺激した嗅上皮における蛍光二重in situハイブリダイゼーション法[10]により、神経活動マーカーであるc-Fosの発現と重なりが観察される受容体遺伝子を探索しましたが、c-Fos陽性嗅細胞においては、これら既知の受容体はどれも発現していませんでした。一方、ゼブラフィッシュのゲノムデータベース検索によって、アデノシンA2aおよびA2b受容体に非常に高い相同性を示す新しい受容体を発見し、「A2c」と名付けました。蛍光二重in situハイブリダイゼーションを行ったところ、A2c受容体の遺伝子(A2c)がc-Fos陽性嗅細胞の94%において発現していることが分かりました(図3A)。
さらにこのA2cは、現在までに全ゲノムデータが報告されている全ての魚類(淡水魚、海水魚を問わず)と両生類で共通に存在しますが、爬虫類、鳥類、哺乳類のゲノムには存在しません。すなわち、A2cは水棲脊椎動物に特異的な遺伝子であり、A2cが水棲脊椎動物特異的な新しいアデノシン受容体であることが分かりました(図3B)。
ATPがA2c受容体を活性化するかどうかを調べるため、A2cを培養細胞に発現させてATPを投与し、ATPによって活性化された細胞の指標となる細胞内環状アデノシン一リン酸(cAMP)[14]濃度をELISA法[15]により測定しました。しかし予想に反して、ATPはA2c発現細胞のcAMP濃度を上昇させませんでした。そこでATPに関連する化合物であるアデノシン二リン酸(ADP)[1]、アデノシン一リン酸(AMP)[1]、アデノシンなどで刺激すると、A2c受容体はアデノシンによってのみ活性化されることが分かりました。
そこで研究チームは、ゼブラフィッシュの鼻腔でATPが速やかにアデノシンに分解されているのではないかと予想しました。ゼブラフィッシュの鼻におけるATPを分解するATP脱リン酸化酵素の遺伝子の発現をin situハイブリダイゼーション法で調べると、二つの酵素(TNAP、CD73)が発現していることが分かりました。そのうちの一つの酵素(CD73)はA2c受容体を発現する嗅細胞に共発現していました。これら二つの酵素とA2cを培養細胞に発現させると、ATPによる細胞内cAMP濃度が上昇しました。また、嗅球におけるカルシウムイメージング実験で、これら二つの酵素の選択的阻害剤をATPとともに投与すると、lG2糸球体の活性化がみられなくなりました。一方、阻害剤存在下でもアデノシンの投与によりlG2糸球体は活性化されました。
これらの結果から、ATPが脱リン酸化されてアデノシンになることでATPによるlG2糸球体の活性化が起こっていることが示唆されました(図4)。さらに、A2c受容体の拮抗剤XAC(A2c受容体の働きを弱める薬剤)を同定し、XAC存在下では、ATPあるいはアデノシンを投与してもlG2の活性化は観察されませんでした。
注1)2009年6月2日プレスリリース「おいしそうな匂いを伝える嗅覚神経回路を同定」
今後の期待
本研究によって、ATPはゼブラフィッシュにとって好きな匂いであること、水中のATPは鼻腔に入ると脱リン酸化酵素によって速やかにアデノシンに分解されること、分解されたアデノシンはA2c受容体を発現する嗅細胞を活性化して、餌を探す行動を引き起こす嗅覚神経回路を駆動することが明らかとなりました。
今後、今回発見した魚類・両生類特異的なA2cの分子進化と機能の連関を調べることで、進化生物学の分野における新たな知見が得られると予想されます。また、すべての魚類がA2cを持っていることから、水産養殖におけるアデノシンを利用した効率的な給餌法の開発や餌料の低コスト化など、水産業分野への貢献が期待できます。
また、ATPは血液に多く含まれています。サメやピラニアは血の匂いに寄ってきて獲物を仕留めるといわれていますが、血の中に含まれるATPの匂いである可能性が考えられます。ATPやアデノシンを散布して人間がいない方向におびき寄せたり、A2c拮抗剤でATPの匂いを嗅がせないようにすることで、サメやピラニアから身を守れる可能性も考えられます。
原論文情報
- Noriko Wakisaka, Nobuhiko Miyasaka, Tetsuya Koide, Miwa Masuda, Towako Hiraki-Kajiyama, Yoshihiro Yoshihara, "An Adenosine Receptor for Olfaction in Fish", Current Biology, doi: 10.1016/j.cub.2017.04.014
発表者
理化学研究所
脳科学総合研究センター シナプス分子機構研究チーム
チームリーダー 吉原 良浩(よしはら よしひろ)
客員研究員 脇阪 紀子(わきさか のりこ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.アデノシン三リン酸、アデノシン、アデノシン二リン酸、アデノシン一リン酸
アデノシンはアデニン(核酸を構成する五つの塩基のうちの一つ)とリボース(糖)が結合したもの。アデノシン三リン酸(ATP)はアデノシンに三つのリン酸基が結合したもので、筋肉が収縮するときにエネルギー源などとして利用される。ATP分解酵素の働きによってリン酸基が外されて分解されていき、アデノシン二リン酸(ADP)、アデノシン一リン酸(AMP)となる。 - 2.フェロモン
ある個体から放出され、同種の他個体の行動や内分泌系に影響を与える化学物質(生理活性物質)の総称。性フェロモン、警報フェロモン、集合フェロモン、道標フェロモンなどが知られている。 - 3.ゼブラフィッシュ
インド原産の体長3~5センチメートルの小型熱帯魚。飼育が容易で多産。稚魚の体は透明なので、体内の発達過程を生きたままで観察することができる。発生工学的手法を用いて、特定の神経細胞を可視化したり、特定の遺伝子の機能を阻害したりすることができる。魚類とほ乳類の脳の基本構造は同じなので、脳研究の新しいモデル動物として注目されている。 - 4.嗅覚受容体
鼻腔に入ってくる匂い分子、フェロモン分子を認識する受容体。鼻の奥に存在する嗅細胞に発現している。多種多様な匂い分子・フェロモン分子に対応できるように、ヒトでは約400種類、マウスでは約1,400種類、ゼブラフィッシュでは約300種類の嗅覚受容体遺伝子がゲノム上に存在している。 - 5.嗅球
嗅覚の1次中枢として機能する脳の領域。匂いを受容する嗅細胞(感覚神経細胞)の神経線維が直接接続している。 - 6.糸球体
嗅球の表面に並んだ神経線維からなる球状の構造体。一つの糸球体は、同じ嗅覚受容体を発現する嗅細胞に神経支配されており、その受容体と結合する匂い分子の情報を表現している。嗅細胞(1次嗅覚ニューロン)で受容された匂い分子の情報が、糸球体内のシナプスを介して嗅球ニューロン(2次嗅覚ニューロン)へと伝達される。 - 7.嗅上皮
鼻腔の奥にある上皮組織。物体から発せられて、鼻腔に入ってくる匂い分子を感知する嗅細胞が並んでいる。 - 8.免疫染色
抗体を用いて組織や細胞などのサンプル中における抗原(タンパク質など)を検出する手法。検出したいタンパク質に対する抗体を用いることで、興味のあるタンパク質がサンプル中のどこにどのくらいの量存在するのかを知ることができる。 - 9.カルシウムイメージング
ニューロンの興奮は細胞内カルシウム濃度の上昇を伴う。カルシウム感受性タンパク質(GCaMP7など)を遺伝学的に特定のタイプのニューロンに発現させて、蛍光顕微鏡でその蛍光変化を観察(イメージング)することによって、ニューロンの興奮を可視化することができる。 - 10.in situ ハイブリダイゼーション、蛍光二重 in situハイブリダイゼーション法
組織や細胞において、特定のDNAやmRNAの発現や分布を検出する方法を in situハイブリダイゼーション法という。蛍光二重 in situハイブリダイゼーション法は、異なった蛍光波長(例えば赤色と緑色)を持つ蛍光物質で別々に標識した2種類のcRNAプローブを用いて行う方法。2種類の遺伝子が同じ細胞に発現しているかどうかを確認することができる。 - 11.c-Fos
さまざまな外的刺激により、興奮した神経細胞で急速かつ一過的に発現が誘導されるタンパク質c-Fosをコードする遺伝子。活性化した神経細胞のマーカーとしてよく使われる。 - 12.PCR法
ポリメラーゼ連鎖反応法。少量のDNAを鋳型にして、DNA複製酵素および短い単鎖DNAを用いて、鋳型DNAを大量増幅する手法。PCRはPolymerase chain reactionの略。 - 13.cRNAプローブ
特定のmRNAを高感度で検出するための相補鎖(complementary)RNAプローブ。プラスミドDNAを鋳型として、 in vitro転写反応で合成できる。 in situハイブリダイゼーション法でcRNAプローブを用いることにより、高い特異性と感度で組織や細胞に存在する目的のmRNAの発現を観察することができる。 - 14.環状アデノシン一リン酸(cAMP)
細胞内でのエネルギー伝達体であるATPから合成される。種々の外界情報を細胞内の標的分子に伝える細胞内シグナル伝達のセカンドメッセンジャーとして働き、cAMP依存性タンパク質リン酸化酵素を活性化して多くのタンパク質をリン酸化するほか、糖や脂質の分解などの多くの生物学的過程をコントロールする。 - 15.ELISA法
抗体を用いて、試料中に含まれる抗原の濃度を特異的に検出・定量する生化学的測定法。ELISAは、Enzyme-linked immune sorbent assayの略。
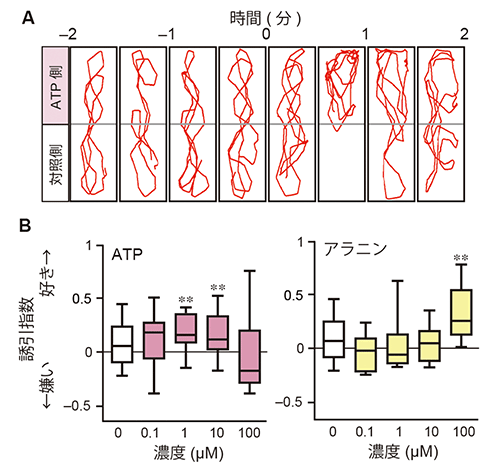
図1 ATPへのゼブラフィッシュの誘引行動
A:ゼブラフィッシュのATP投与による行動変化。水槽を泳ぐゼブラフィッシュを上部からビデオ撮影し、ATP投与前(-2~0分)と投与後(0~2分)の遊泳の軌跡を赤線で示す。投与30秒後から、ゼブラフィッシュがATP投与側に長く滞在しているのが分かる。
B:嗅覚行動の定量解析結果。異なる濃度のATPとアラニンに対するゼブラフィッシュの誘引行動を誘引指数で示した。ATPはアラニンよりも低い濃度で誘引行動を引き起こすことが読み取れる。
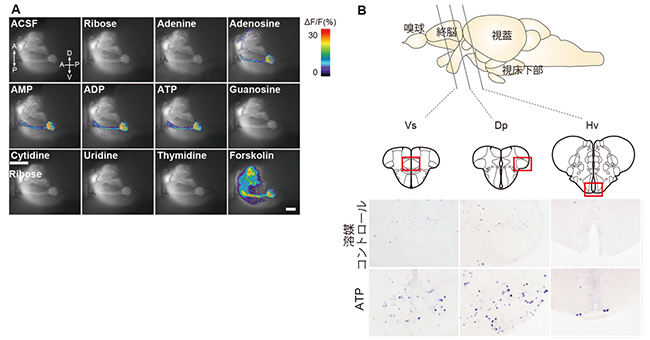
図2 ATPによって活性化される嗅覚神経回路
A:ATP関連物質による嗅球のlG2糸球体の活性化。GCaMP7を発現するトランスジェニックゼブラフィッシュの嗅球のカルシウムイメージング。lG2糸球体はATP、ADP(アデノシン二リン酸)、AMP(アデノシン一リン酸)、アデノシンによってのみ活性化される。右下のForskolinは、多くの嗅細胞を興奮させるポジティブコントロールとして用いた。
B:ATPが活性化する高次嗅覚中枢。ATPへの誘引行動を示したゼブラフィッシュの脳切片におけるc-Fos in situハイブリダイゼーションの結果。Vs(終脳腹側部交連上核)、Dp(終脳背側部後方領域)、Hv(視床下部腹側核)などの脳領域がATPによって活性化されている。
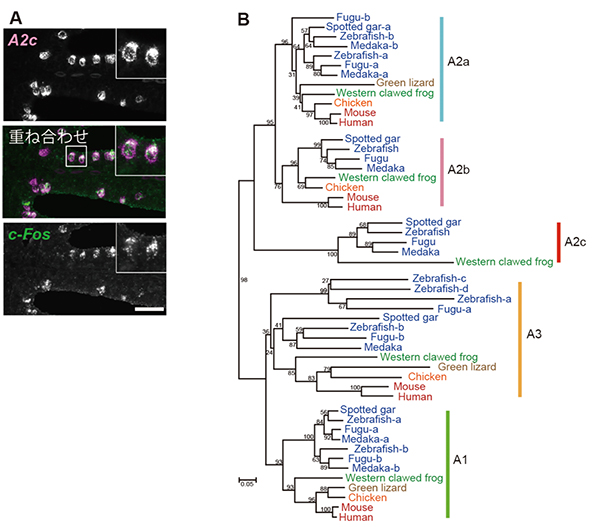
図3 魚類と両生類だけに存在する新規アデノシン受容体A2cの発見
A:ゼブラフィッシュの嗅上皮の二重蛍光in situハイブリダイゼーション。ATPによって活性化された嗅細胞(c-Fos陽性細胞)は新しいアデノシン受容体「A2c」の遺伝子(A2c)を発現している。真ん中の写真では、A2cはピンク、c-Fosは緑で示され、重ね合わせされている。
B:新しいアデノシン受容体「A2c」はゼブラフィッシュ、メダカ、フグ、ガー、カエルなどの水棲脊椎動物に存在するが、ヒト、マウス、トリ、ウシ、トカゲなど哺乳類、鳥類、爬虫類には存在しない。その他のアデノシン受容体(A1、A2a、A2b、A3)は全ての脊椎動物に存在する。なお。図中の青い文字は魚類、緑は両性類、薄茶は爬虫類、オレンジは鳥類、赤は哺乳類を示す。
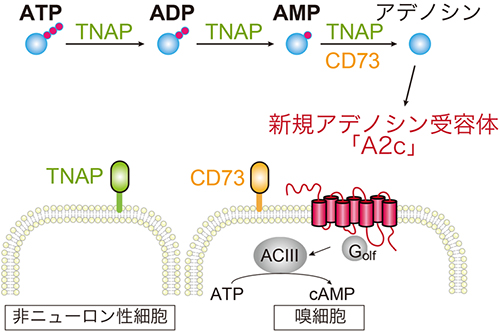
図4 鼻腔内でのATPからアデノシンへの分解とA2c発現嗅細胞の活性化機構
水中から鼻腔内に入ってきたATPは、2種類の細胞外ヌクレオチダーゼ(TNAP、CD73)による酵素反応によって速やかにアデノシンに分解される。アデノシンはA2c受容体に結合し、嗅細胞特異的GTP結合タンパク質(Golf)、アデニル酸シクラーゼⅢ(ACIII)の活性化、細胞内cAMP濃度の上昇を介して、嗅細胞を興奮させる。その情報は嗅球さらには高次嗅覚中枢へと伝えられ、誘引行動を引き起こす。
