要旨
理化学研究所(理研)環境資源科学研究センター代謝システム研究チームの岡村英治特別研究員と平井優美チームリーダーの研究チームは、シロイヌナズナにおいてセリンの生合成を担う3-ホスホグリセリン酸脱水素酵素(PGDH)[1]の新しい制御機構を発見しました。
タンパク質性アミノ酸の一種であるセリンは、タンパク質の構成要素であると同時に、細胞膜を構成する一部の脂質や核酸、他のアミノ酸を作る原材料でもあります。セリンはリン酸化経路と呼ばれる代謝経路によって生合成されますが、微生物では、細胞内のセリン濃度が上昇するとリン酸化経路の最初の酵素であるPGDHの活性が低下し、逆にセリン濃度が低下するとPGDHの活性が増大することが知られています。このため、PGDHの活性はセリン濃度によってのみ制御されると考えられてきました。しかし、植物におけるPGDH活性制御の詳細については明らかになっていませんでした。
今回、研究チームは、シロイヌナズナの三つのPGDHアイソザイム[2]の遺伝子(PGDH1、PGDH2、PGDH3)を大腸菌内で発現させて組換えタンパク質を作製し、試験管内でそれぞれの酵素活性を調べました。酵素反応液に43種類のアミノ酸を一つずつ添加して活性の変化を調べた結果、PGDH1とPGDH3はL-セリンによる活性阻害に加え、L-アラニン、L-バリン、L-メチオニン、L-ホモセリン、L-ホモシステインによる活性促進を受けることが分かりました。これは、シロイヌナズナにおけるセリン生合成の制御がこれまで考えられていた以上に複雑であることを示しており、セリンが関わるさまざまな細胞プロセスは、新しく発見した酵素活性調節の仕組みによって制御されていると考えられます。
本成果は、生命現象の理解、そしてセリン生合成制御の進化的意味の理解に新たな糸口を与えるものと期待できます。
本研究は、英国の科学雑誌『Scientific Reports』(6月14日付け)に掲載されます。
背景
タンパク質性アミノ酸の一種であるセリンは、タンパク質の構成要素であると同時に、細胞膜を構成する一部の脂質や核酸の原材料でもあります。植物においては、他のアミノ酸であるトリプトファン、システイン、メチオニンを作るもとでもあり、極めて重要なものです。
セリンは、リン酸化経路[3]と呼ばれる代謝経路によって生合成されます(図1)。この経路は植物、哺乳動物、微生物に保存されています。大腸菌などの微生物では、細胞内のセリン濃度が上昇するとリン酸化経路の最初の酵素である3-ホスホグリセリン酸脱水素酵素(PGDH)の働きが低下し、逆にセリン濃度が低下するとPGDHの働きが上昇することで、細胞内のセリン濃度が一定に保たれています。つまり、PGDHの働きの調節がセリンの代謝を制御する上で鍵となっています。これまで、植物のPGDHは微生物のPGDHと同様、セリン濃度によってのみ、その活性が制御されていると考えられてきましたが、その詳細については明らかになっていませんでした。
研究手法と成果
研究チームは、モデル実験植物であるシロイヌナズナの三つのPGDHアイソザイム(PGDH1、PGDH2、PGDH3)の活性がどのように制御されているかを調べるため、これら三つのアイソザイムの組換えタンパク質を、大腸菌を用いて作製しました。そして、この組換えタンパク質を生体内で主にみられるL-体のアミノ酸のほか、D-体のアミノ酸も合わせて計43種類のアミノ酸と一つずつ試験管内で混合することで、組換えタンパク質の酵素活性がどのように変化するかを調べました。
その結果、PGDH1とPGDH3は、L-セリンによる活性阻害だけでなく、L-アラニン、L-バリン、L-メチオニン、L-ホモセリン、L-ホモシステインによる活性促進を受けることを見いだしました。さらに各アミノ酸に対する応答をより詳しく調べた結果、L-ホモシステインが最も低い濃度で活性促進の効果を示すことが分かりました。一方、PGDH2は43種類のいずれのアミノ酸による制御も受けませんでした。
セリンは、トリプトファンおよび硫黄を含むアミノ酸であるシステイン、ホモシステイン、メチオニンの生合成前駆体であり(図2)、特にPGDH1はトリプトファンの生合成に深く関わっていることが報告されています。したがって、今回発見した制御は、細胞内のアミノ酸量のバランスを調節していると考えられます。
今後の期待
セリン以外のアミノ酸によるPGDHの活性制御はシロイヌナズナ以外の植物、さらには他の生物にも保存されている可能性があります。また、セリンが関わるさまざまな細胞プロセスはPGDHの活性制御によっても調節されていると考えられます。本研究成果は生命現象の理解、そしてセリン生合成制御の進化的意味の理解に新たな糸口を与えると期待できます。
原論文情報
- Eiji Okamura and Masami Yokota Hirai, "Novel regulatory mechanism of serine biosynthesis associated with 3-phosphoglycerate dehydrogenase in Arabidopsis thaliana.", Scientific Reports, doi: 10.1038/s41598-017-03807-5
発表者
理化学研究所
環境資源科学研究センター 代謝システム研究チーム
特別研究員 岡村 英治(おかむら えいじ)
チームリーダー 平井 優美(ひらい まさみ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.3-ホスホグリセリン酸脱水素酵素(PGDH)
糖を分解してエネルギーを生成する解糖系、および光合成で二酸化炭素固定を担うカルビン回路の中間代謝産物である3-ホスホグリセリン酸を酸化する酵素。 - 2.アイソザイム
同一の化学反応を触媒するが、一次構造(アミノ酸配列)が異なる酵素のこと。多くの場合、酵素タンパク質そのものの物理化学的な性質や、酵素の働きの強さ、さらには生体において機能する時期や部位が異なる。 - 3.リン酸化経路
生体内においてセリンを合成する代謝経路。3-ホスホグリセリン酸から3段階の反応を経てセリンを合成する。植物では高濃度の二酸化炭素への適応や植物ホルモンであるオーキシンの合成に関与していることが示唆され、また、ヒトではがん細胞の増殖や神経細胞の発達に関与していることから、近年注目されている。
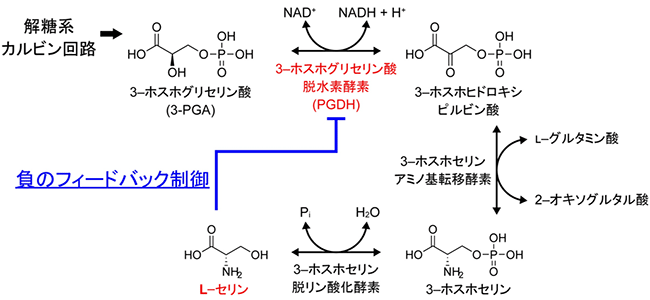
図1 リン酸化経路によるセリン生合成とその制御のこれまでの理解
リン酸化経路は、解糖系やカルビン回路の中間代謝産物である3-ホスホグリセリン酸(3-PGA)を出発物質とする3段階の反応によってl-セリンを合成する。これまでに、シロイヌナズナでは微生物と同様に、l-セリンによる負のフィードバック制御(リン酸化経路の最終産物であるl-セリンの濃度が高くなると、同経路の酵素であるPGDHの活性が抑制される)が存在することが知られていた。
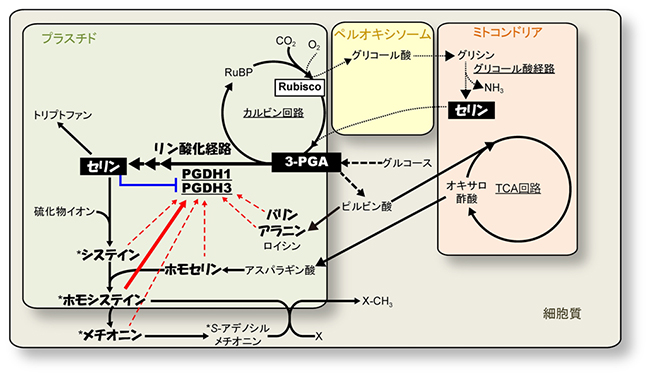
図2 3-ホスホグリセリン酸脱水素酵素(PGDH)活性の調節を介したアミノ酸代謝の制御
アミノ酸の一種であるトリプトファン、システイン、ホモシステイン、メチオニンはセリンから合成される。シロイヌナズナの一部の組織では、トリプトファンを作る材料となるセリンはPGDH1の働きで合成されることが知られている。本研究で発見したように、シロイヌナズナではシステイン、ホモシステイン、メチオニンの細胞内量が増えたときにPGDH1を活性化することで、セリン生合成、ひいてはトリプトファン生合成を促進し、アミノ酸の量的バランスを保っていると考えられる。図中のアスタリスク(*)は硫黄を含むアミノ酸を示す。
