要旨
理化学研究所(理研)田中生体機能合成化学研究室の田中克典主任研究員、泰地美沙子特別研究員(研究当時)らの共同研究グループ※は、細胞表面の受容体[1]に対するリガンド分子[2]の「強い」相互作用と「弱い」相互作用を同時に働かせ、さらに両リガンド分子同士を細胞表面で官能基[3]選択的に化学結合させることにより、標的細胞を高度に見分ける技術開発に成功しました。
医療診断分野において、生体内に多数存在する細胞群から、特定の細胞だけを高度に見分ける新手法の開発は重要な課題です。これまで、見分けようとする細胞(標的細胞)表面に発現する1種類の受容体に「強く」相互作用するリガンド分子(抗体やペプチドなど)が用いられてきました。しかし、「強く」相互作用するリガンド分子を用いると、標的細胞以外のあらゆる細胞や器官にも吸着してしまいます。これが検出の選択性の低下につながり、1種類の受容体に「強く」相互作用するリガンド分子を用いる上での大きな難点でした。
共同研究グループは、標的細胞の表面に発現する、2種類以上の異なる受容体に対して「強く」、そして「弱く」相互作用する複数のリガンド分子の相乗効果を活用することで、従来の1種類の受容体に「強く」相互作用するリガンド分子を利用する手法では達成できなかった、高感度かつ選択性の高い手法を開発しました。今後、この手法を利用して生体内に多数存在する細胞群の中から、特定のがん細胞や疾患細胞を選択的に検出する新しい手法の開発が期待できます。
本研究成果は、ドイツの科学雑誌『Advanced Science』に掲載されるのに先立ち、オンライン版(7月28日付け)に掲載されます。
※共同研究グループ
理化学研究所
田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
特別研究員(研究当時)泰地 美沙子(たいち みさこ)
特別研究員 野村 昌吾(のむら しょうご)
グローバル研究クラスタ 理研-マックスプランク連携研究センター
システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
副チームリーダー 北爪 しのぶ(きたづめ しのぶ)
テクニカルスタッフ 今牧 理恵(いままき りえ)
特別研究員 木塚 康彦(きづか やすひこ)
テクニカルスタッフ(研究当時) 太田 芙美(おおた ふみ)
チームリーダー 谷口 直之(たにぐち なおゆき)
環境資源科学研究センター
ユニットリーダー 堂前 直(どうまえ なおし)
大阪府立大学 21世紀科学研究機構
特別講師 中瀬 生彦(なかせ いくひこ)
背景
医療診断分野において、生体内に多数存在する細胞群から、特定の細胞だけを高度に見分ける新手法の開発が重要な課題となっています。これまで、見分けようとする細胞(標的細胞)表面に発現する1種類の受容体に「強く」相互作用する抗体やペプチド(複数のアミノ酸が結合した分子)などのリガンド分子が用いられてきました。現在行われている新手法の開発は、リガンド分子の受容体の選択性や、リガンド分子と受容体との相互作用の向上を目指した研究がほとんどです。しかし、「強く」相互作用するリガンド分子を用いる場合には、標的細胞以外の細胞に発現している受容体も「強く」認識して吸着してしまうため、数多くの細胞から標的細胞のみを選択的に認識させるには限界があります。
例えば、「強く」相互作用するリガンド分子を用いて、同じ種類の受容体を持つ細胞A、Bから細胞Aのみを選択的に認識しようとしても、分子リガンドが細胞A、B両方の受容体を認識してしまうため区別するのは困難です(図1a)。また、「弱く」相互作用する分子リガンドを用いた場合には、受容体に相互作用してもすぐ離れてしまうため、感度良く検出することはできません(図1b)。
研究手法と成果
共同研究グループは、標的の細胞表面に存在する2種類以上の受容体に対して、「強く」、そして「弱く」相互作用する複数のリガンド分子を組み合わせ、それらを細胞表面上で直接、化学反応により結合させることで細胞の選択性を著しく向上させることに成功しました(図1c)。
開発した手法では、まず、ある反応性官能基を持ち、「強く」相互作用するリガンド分子(ペプチドリガンド)を細胞表面上の受容体と一次的に相互作用させます(プレターゲティング[4])。次に、「弱く」相互作用するリガンド分子(糖鎖リガンド)を別の受容体と二次的に相互作用させます。この糖鎖リガンドは、プレターゲティングした官能基に選択的に結合する反応性官能基と、標識基を併せ持っています。二次的相互作用の際、ペプチドリガンドと糖鎖リガンドがそれぞれ相互作用する2種類の受容体が存在する細胞Aのみで、両リガンド同士の結合反応が進行します。そのため、標識基を細胞A表面に固定化させることで細胞Aを選択的に検出することができます。また、糖鎖リガンドが相互作用する受容体を持たない細胞Bでは、糖鎖リガンドは速やかに洗い流されるため、バックグラウンド[5]の低下を効率的に防ぐことができます。
共同研究グループは本手法の妥当性を検証するため、HUVEC細胞(ヒト臍帯静脈内皮細胞)を用いて実験を行いました(図2)。図1cの基本戦略に従ってまず、HUVEC細胞表面上の受容体、αVβ3インテグリン[6]に対して「強く」相互作用するリガンド分子「環状RGDyKペプチド[6]」(図2aの1)を一次的に相互作用させました。次に、別の受容体、PECAMレクチン[7]に対して「弱く」相互作用するリガンド分子「α (2,6)-シアリル化糖鎖[7]」(図2aの2)を蛍光標識して二次的に相互作用させました。そして、歪み解消クリック反応[8]を用いて細胞表面で2つのリガンド同士を結合させました(図2a)。その結果、αVβ3インテグリンしか持たないHeLa細胞(ヒト子宮頸癌細胞)に比較して、2つの受容体を持つHUVEC細胞のみを選択的に可視化することに成功しました(図2b)。この際、「強く」相互作用するリガンド分子である環状RGDyKペプチドを標識したプローブ(特定の物質を検出するための物質)(図2の1’)では、2つの細胞をまったく区別することができず(図2c)、また「弱く」相互作用するα (2,6)-シアリル化糖鎖のみでは蛍光シグナルを得ることができませんでした。さらに、あらかじめペプチドと糖鎖をつないだプローブでも2つの細胞を区別することができず(図2c)、本手法が標的細胞の高選択的な検出に有効であることを実証しました。
今後の期待
本研究成果は、「強い」相互作用に対して、「弱い」相互作用を細胞表面上で有機反応させ、標識基のバックグラウンドを軽減しつつ、複数の受容体を標的として細胞を選択的に見分ける革新的な技術です。これにより、これまで困難だった複雑な細胞表面を効率的に理解できる一般的な分子認識システムの開発が期待できます。また、生体内でも同様の戦略を展開して、PET(Positron Emission Tomography)やMRI(Magnetic Resonance Imaging)を代表とする分子イメージングを用いた診断に大きく貢献すると期待できます。
原論文情報
- Misako Taichi, Shogo Nomura, Ikuhiko Nakase, Rie Imamaki, Yasuhiko Kizuka, Fumi Ota, Naoshi Dohmae, Shinobu Kitazume, Naoyuki Taniguchi and Katsunori Tanaka, "In-Situ Ligation of High- and Low-Affinity Ligands to Cell Surface Receptors Enables Highly Selective Recognition", Advanced Science, doi: 10.1002/advs.201700147
発表者
理化学研究所
主任研究員研究室 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
 田中主任研究員(左)と泰地特別研究員(研究当時)
田中主任研究員(左)と泰地特別研究員(研究当時)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.受容体
タンパク質や低分子に相互作用するタンパク質。「レセプター」とも呼ばれる。 - 2.リガンド分子
受容体に相互作用するタンパク質や低分子。 - 3.官能基
ここでは、ある特定の有機反応を起こすことのできる反応性置換基を指す。 - 4.プレターゲティング
標的細胞に対して、ある受容体のリガンドをあらかじめ(プレ)相互作用(ターゲティング)させておくことを示す。抗体を用いた分子イメージングなどでよく使用される手法。 - 5.バックグラウンド
ここでは、蛍光標識された低分子化合物が細胞表面に対して非特異的に吸着することにより、全体として観察される「蛍光強度」のことを示す。非特異的な吸着により蛍光バックグラウンドが上がると、目的とする蛍光シグナルが見えにくくなるため、バックグラウンドをいかに抑えるかが、効率的な蛍光イメージング研究において鍵となる。 - 6.αVβ3インテグリン、RGDyKペプチド
インテグリンは細胞表面にある接着分子のこと。αVβ3インテグリンは特に代表的な膜タンパク質であり、数あるインテグリン・スーパーファミリーの1つ。がん細胞に多く発現しているため、がんの分子イメージングの標的受容体としてよく利用される。インテグリンに相互作用する分子として、フィブロネクチンが知られているが、この相互作用する部分構造がArg-Gly-Asp-Ser(RGD配列)である。このために、このRGD配列のさまざまな誘導体がインテグリンリガンドとして多用されている。本研究で用いた環状RGDyKペプチド誘導体もその代表例である。 - 7.PECAMレクチン、α(2,6)-シアリル化糖鎖
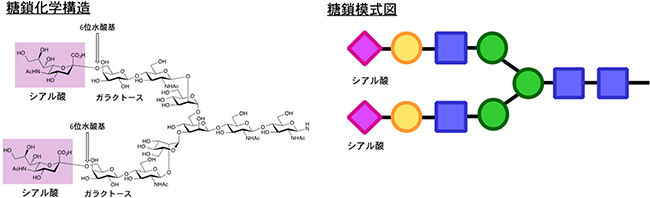
糖鎖の末端にシアル酸がガラクトースの6位水酸基とα-結合(下図では、分子の右横から結合した形)した糖鎖を、α(2,6)-シアリル化糖鎖と呼ぶ。細胞表面に脂質や膜タンパク質と結合した形で多く見られる。本研究で使用したα(2,6)-シアリル化糖鎖の構造と模式図を下記に示す。また、糖鎖分子(リガンド)と相互作用する受容体はレクチンと呼ばれ、PECAMレクチンはα(2,6)-シアリル化糖鎖に対して弱いものの、糖鎖の中では選択的に相互作用するレクチンであることが知られている。
- 8.歪み解消クリック反応
図2aで示したようなアジド化合物(1)は、分子(2)に存在する8員環内のアセチレンと温和な条件下で速やかに反応し、1,2,3-トリアゾール付加体を与える。アジド基と歪んだアセチレン基は他のさまざまな官能基存在下で、ほぼ選択的にお互いと反応するので、生物学や材料科学の分野で現在盛んに用いられている。
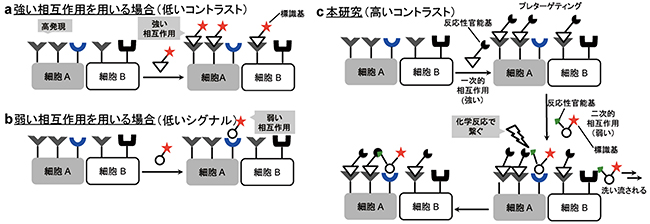
図1 標的細胞を見分ける方法:従来法(a、b)および新手法(c)
(a)「強く」相互作用するリガンド分子を用いる場合には、たとえ細胞Aにその受容体がより多く発現していても、細胞A、B両方の受容体を認識してしまうため区別が困難である。
(b)「弱い」相互作用を用いる場合には、受容体に相互作用してもすぐ離れてしまうため、感度良く検出できない。
(c)「強い」相互作用と「弱い」相互作用を併用して用い、さらにこれらのリガンド分子を目的の細胞表面で化学反応によりつなぐことで、細胞の選択性が著しく向上する。
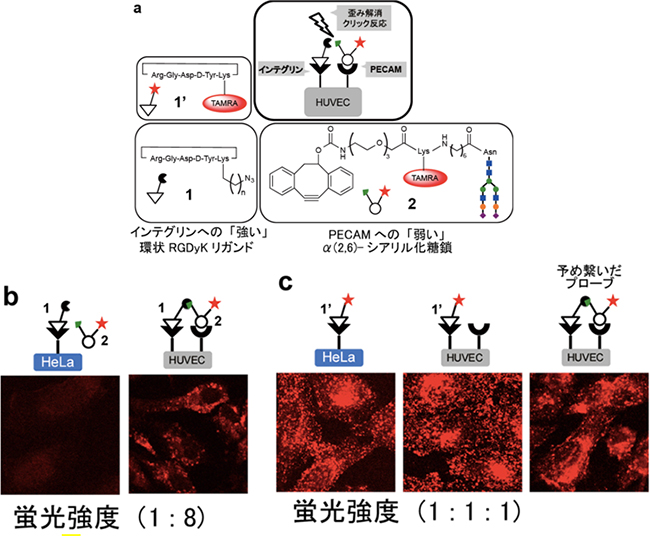
図2 細胞表面での「強・弱」相互作用と化学反応を用いる高度な細胞認識
(a)αVβ3インテグリン受容体、PECAMレクチン受容体とそのリガンド分子であるRGDyKペプチド、およびα(2,6)-シアリル化糖鎖糖鎖の構造。
(b)HUVEC細胞(αVβ3インテグリン受容体とPECAMレクチン受容体の両者を持つ)とHeLa細胞(αVβ3インテグリン受容体のみを持つ)を用いた本手法による実験結果。蛍光強度が1:8と大きな違いが見られ、HUVEC細胞では細胞を区別ができていることが分かる。赤色はTAMRA色素による染色。
(c)左:HeLa細胞に対して環状RGDyKペプチドを標識したプローブのみを用いた実験結果。
中:HUVEC細胞に対して環状RGDyKペプチドを標識したプローブのみを用いた実験結果。
右:HUVEC細胞に対してあらかじめペプチドと糖鎖をつないだプローブを用いた実験結果。
3つとも蛍光強度がどれも同じ割合のため、区別ができていないことが分かる。
