要旨
理化学研究所(理研)バイオリソースセンター遺伝工学基盤技術室の小倉淳郎室長、畑中勇輝訪問研究員、眞貝細胞記憶研究室の眞貝洋一主任研究員、津坂剛史大学院生リサーチ・アソシエイト、環境資源科学研究センター生命分子解析ユニットの堂前直ユニットリーダー、鈴木健裕専任技師らの共同研究グループ※は、マウスを用いた研究から、哺乳類の受精時に起こる精子ゲノムの再構築に関する新たな制御機構を明らかにしました。
卵子および精子のゲノムは受精後、全ての細胞に分化できる能力(分化全能性)を獲得します。非常にコンパクトな構造を持つ精子核は、受精後に通常の細胞核へと再構築されます。この際、精子ゲノムには二つの大きな変化が生じます。一つは、精子固有の核タンパク質プロタミン[1]が卵子由来のヒストンタンパク質[2]に置換されます。もう一つは、大規模な能動的DNA脱メチル化[3]です。しかし、このようなゲノム再構築に関わる詳しい分子機構は分かっていません。
今回、共同研究チームはマウス受精卵を用いて、精子ゲノムの再構築に関わる母性(卵子由来)因子「Mettl23」を新たに同定しました。生化学的な解析により、Mettl23はヒストンH3テール部[2]の17番目のアミノ酸であるアルギニン残基H3R17をジメチル化[4](H3R17me2a)する非対称性ヒストンアルギニンメチル化酵素[4]であることが分かりました。また、このH3R17me2aは、精子ゲノムへのヒストン(ヒストンH3.3[5])の取り込みに必須であることも分かりました。さらに、ゲノム編集技術[6]により作製したMettl23欠損マウスを用いた観察により、Mettl23は能動的DNA脱メチル化因子GSEおよびTet3が精子ゲノムへ結合するのに必須であることが分かりました。これらの結果から、ヒストン修飾酵素Mettl23とそれが触媒するヒストンジメチル化修飾H3R17me2aが、プロタミン-ヒストン置換および能動的DNA脱メチル化という二つの精子ゲノムの再構築過程に重要な役割を果たしていることが明らかになりました。
本研究により今後、ゲノムの分化全能性獲得機構の理解がさらに進むものと期待できます。また、同定した因子の多能性幹細胞[7]樹立や維持に及ぼす影響などが確認できれば、再生医療分野への応用につながる可能性も考えられます。
本研究成果は、米国のオンライン雑誌『Cell Reports』(9月19日号、日本時間9月20日付け)に掲載される予定です。
本研究は、科学研究費補助金新学術領域研究「生殖細胞のエピゲノムダイナミクスとその制御(領域代表:篠原隆司)」および内藤記念科学振興財団の特定研究助成金の支援を受けて行われました。
※共同研究グループ
理化学研究所
バイオリソースセンター 遺伝工学基盤技術室
室長 小倉 淳郎(おぐら あつお)
訪問研究員 畑中 勇輝(はたなか ゆうき)(日本学術振興会特別研究員PD)
客員研究員 本多 新(ほんだ あらた)
テクニカルスタッフⅡ 廣瀬 美智子(ひろせ みちこ)
大学院生リサーチ・アソシエイト(研究当時) 上村 悟氏(かみむら さとし)
専任技師 越後貫 成美(おごぬき なるみ)
専任研究員 井上 貴美子(いのうえ きみこ)
眞貝細胞記憶研究室
主任研究員 眞貝 洋一(しんかい よういち)
大学院生リサーチ・アソシエイト 津坂 剛史(つさか たけし)
環境資源科学研究センター 技術基盤部門 生命分子解析ユニット
ユニットリーダー 堂前 直(どうまえ なおし)
専任技師 鈴木 健裕(すずき たけひろ)
近畿大学大学院 生物理工学研究科
教授 松本 和也(まつもと かずや)
教授 細井 美彦(ほそい よしひこ)
博士後期課程 清水 なつみ(しみず なつみ)
博士後期課程 守田 昴太郎(もりた こうたろう)
博士後期課程 佐藤 学(さとう まなぶ)
早稲田大学大学院 先進理工学研究科
教授 胡桃坂 仁志(くるみざか ひとし)
助教 町田 晋一(まちだ しんいち)
大阪大学大学院 医学系研究科
教授 仲野 徹(なかの とおる)
長浜バイオ大学大学院 バイオサイエンス研究科
准教授 中村 肇伸(なかむら としのぶ)
背景
卵子および精子のゲノムは受精後、全ての細胞に分化できる能力(分化全能性)を獲得します。非常にコンパクトな構造を持つ精子核は、受精後に通常の細胞核へと再構築されます。この際、精子ゲノムには二つの大きな変化が生じます。一つは、精子固有の核タンパク質プロタミンが卵子由来のヒストンタンパク質に置換されるという変化です。これにより、精子由来核(雄性前核)は通常の細胞核と同様にクロマチン構造[8]を形成し、遺伝子発現制御を受けるようになります。もう一つは、雄性前核に大規模な能動的DNA脱メチル化という変化が起こります。
すなわち、哺乳類の精子ゲノムには、受精後の短期間にDNAやヒストンのエピジェネティック修飾[9]変化が劇的に生じることになります。しかし、その背景にある詳しい分子機構は分かっていません。
研究手法と成果
共同研究グループは、精子や卵子のみに存在し、能動的DNA脱メチル化に関わるGSEタンパク質に着目しました。まず、酵母ツーハイブリッド法[10]を用いて、GSEが他の能動的DNA脱メチル化因子であるTet3と相互作用することを明らかにしました。また、GSEとの相互作用領域を欠失したTet3は雄性前核へ局在できなくなったことから、GSEはTet3が精子ゲノムへ結合するのに重要であることが分かりました。
さらに同様の方法で解析を重ね、GSEのもう一つの相互作用因子として、母性(卵子由来)因子のアルギニンメチル化酵素の機能ドメインを持つ「Mettl23」を新たに同定しました。試験管内でMettl23の酵素活性を質量分析装置[11]を用いて解析したところ、Mettl23は非対称性ヒストンアルギニンメチル化酵素として、ヒストンH3テール部の17番目のアミノ酸であるアルギニン残基H3R17のジメチル化(H3R17me2a)を触媒することが分かりました。
次に、受精卵におけるGSEとMettl23の詳しい機能を明らかにするために、ゲノム編集技術の一つであるCRISPR/Cas9[12]を用いて、それぞれのノックアウトマウスを作製しました。これらのマウスを交配させたところ、いずれのノックアウトマウスからも産子を得ることができました。しかし、Mettl23欠損マウスでは、産子数の減少と一部の生まれた産子の死亡が観察されたことから、この因子が受精あるいは個体発生に重要な役割を担っていることが分かりました。
また、マウス受精卵におけるGSEとMettl23の機能解析では、GSE欠損受精卵およびMettl23欠損受精卵は野生型と比べて、DNAメチル化産物の5-メチルシトシン(5mC)が蓄積されたままとなり、DNA脱メチル化過程の産物である5-ヒドロキシメチルシトシン(5hmC)が蓄積されないことが明らかになりました(図1)。さらに、GSE欠損受精卵およびMettl23欠損受精卵では、5mCから5hmCへ変換する脱メチル化酵素Tet3の精子ゲノムへの結合が野生型と比べて著しく減少していること、さらにMettl23欠損受精卵ではGSEの精子ゲノムへの結合も減少することも明らかになりました。一方で、卵子ゲノムをDNA脱メチル化から保護しているPGC7タンパク質を欠損した受精卵では、GSEの局在が卵子ゲノムで増加していることが分かりました。
これらの結果は、受精後の精子ゲノムの能動的脱メチル化の際にGSEおよびTet3が精子ゲノムへ結合するために、Mettl23が必要であることを示しています。
受精後、ヒストンH3が卵子から精子ゲノムに取り込まれる際、H3.3変異体が優先されます。Mettl23が触媒する非対称性ヒストンアルギニンジメチル化修飾H3R17me2aが卵子からのヒストンH3.3の取り込みに必要なのかを明らかにするために、メチル化されないヒストン変異体H3.3R17Kを受精卵で発現させ、その変異体の受精後の精子ゲノムへの取り込みを観察しました。その結果、H3.3R17Kは、野生型のヒストンH3.3や他のアルギニン残基の変異体(H3.3R8K、H3.3R26K)と比較して、ヒストンH3.3の精子ゲノムへの取り込みが著しく減少することが明らかになりました(図2)。このことから、H3R17me2aは受精後の精子ゲノムへのヒストンH3.3の取り込みに重要なヒストン修飾であることが分かりました。
以上の結果から、Mettl23およびそれが触媒するH3R17me2aは、卵子からのヒストンの取り込みおよび能動的DNA脱メチル化という二つの精子ゲノムの再構築過程に重要な役割を果たしていることが分かりました。
今後の期待
これまでに、精子ゲノム再構築に関与するいくつかの因子が同定されていますが、まだ多くの因子が不明です。今回、新たに同定されたヒストン修飾酵素Mettl23とそれが触媒するH3R17me2aは、受精卵の精子ゲノム上に広く分布すると予想され、受精の前後で生じるゲノムの分化全能性獲得に関与している可能性があります。
今後の詳しい研究により、生命の始まりに関するゲノムの分化全能性獲得機構の理解が進むものと期待できます。また、今回同定したゲノム再構築因子が、多能性幹細胞の樹立や維持に及ぼす影響などが確認できれば、再生医療分野における応用につながる可能性も考えられます。
原論文情報
- Yuki Hatanaka, Takeshi Tsusaka, Natsumi Shimizu, Kohtaro Morita, Takehiro Suzuki, Shinichi Machida, Manabu Satoh, Arata Honda, Michiko Hirose, Satoshi Kamimura, Narumi Ogonuki, Toshinobu Nakamura, Kimiko Inoue, Yoshihiko Hosoi, Naoshi Dohmae, Toru Nakano, Hitoshi Kurumizaka, Kazuya Matsumoto, Yoichi Shinkai, Atsuo Ogura, "Histone H3 methylated at arginine 17 is essential for reprogramming the paternal genome in zygotes", Cell Reports, doi: 10.1016/j.celrep.2017.08.088
発表者
理化学研究所
バイオリソースセンター 遺伝工学基盤技術室
室長 小倉 淳郎(おぐら あつお)
訪問研究員 畑中 勇輝(はたなか ゆうき)
(日本学術振興会特別研究員PD)
主任研究員研究室 眞貝細胞記憶研究室
主任研究員 眞貝 洋一(しんかい よういち)
大学院生リサーチ・アソシエイト 津坂 剛史(つさか たけし)
環境資源科学研究センター 技術基盤部門 生命分子解析ユニット
ユニットリーダー 堂前 直(どうまえ なおし)
専任技師 鈴木 健裕(すずき たけひろ)
 畑中 勇輝
畑中 勇輝
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.核タンパク質プロタミン
精子のDNAを物理的なダメージから保護するタンパク質。成熟した精子のDNAは、このプロタミンにより高度に折り畳まれ精子頭部に格納される。 - 2.ヒストンタンパク質、ヒストンH3テール部
ヒストンは真核生物のクロマチンを構成する一群のタンパク質で、H1、H2A、H2B、H3、H4の5種類に分けられる。テール部は、ヒストンタンパク質のアミノ酸配列においてN末端(上流)およびC末端(下流)部のうち、N末端部の領域を指す。エピジェネティック修飾であるメチル化やアセチル化などが付加されるアミノ酸が豊富に存在する領域として知られる。 - 3.能動的DNA脱メチル化
DNA脱メチル化には、細胞分裂のたびに脱メチル化される受動的脱メチル化と、細胞分裂に依存しない能動的脱メチル化の二つのシステムがある。能動的脱メチル化ではTETやTDGなどの酵素によってメチル化シトシンが脱メチル化して、メチル化していないシトシンへと変換される。 - 4.ジメチル化、非対称性ヒストンアルギニンメチル化酵素
アミノ酸のメチル化は、モノメチル化、ジメチル化およびトリメチル化からなり、それぞれのメチル化酵素が存在している。アルギニンメチル化に関してはジメチル化のみであり、その中でもメチル基が非対称に付加される非対称性ジメチル化(me2a)と、対称に付加される対称性ジメチル化(me2s)に分かれ、それぞれのアルギニンメチル化酵素が存在する。非対称性ヒストンアルギニンメチル化酵素は前者を指す。 - 5.ヒストンH3.3
ヒストンにはそれぞれ数個のアミノ酸が異なるバリアント(変異体)が存在する。マウスのヒストンH3バリアントはH3.1、H3.2、およびH3.3が存在し、受精直後の精子DNAはH3.3が優先的に取り込まれることが知られている。 - 6.ゲノム編集技術
配列特異的にDNAを切断する酵素を用いて、ゲノム上の目的の配列に変異を生じさせる技術の総称。 - 7.多能性幹細胞
胎盤系の細胞以外の、個体を形成する全ての細胞に分化できる能力(多分化能性)を有する細胞。再生医療の応用で注目されるiPS細胞(人工多能性肝細胞)もこれに当たる。 - 8.クロマチン構造
DNAがヒストンに巻かれた構造であるヌクレオソームがつながった構造のこと。 - 9.エピジェネティック修飾
DNAの塩基配列の変化を伴わず、遺伝子の発現を活性化したり不活性化したりする後付けの修飾のこと。主たる現象として、DNAのメチル化修飾、ヒストンのアセチル化やメチル化、リン酸化が知られる。 - 10.酵母ツーハイブリッド法
タンパク質間相互作用を調べるための生化学的手法。酵母内で二種類のタンパク質を発現誘導させその相互作用を確認する方法と、特定のタンパク質とcDNAライブラリーを発現誘導させることで相互作用因子をスクリーニングする方法がある。 - 11.質量分析装置
タンパク質を切断酵素を用いて小分子にした後、分子をイオン化させることでそのイオンの質量電荷比によりアミノ酸配列を同定することができる装置。メチル化などの化学修飾が付加されたアミノ酸も同定できる。 - 12.CRISPR/Cas9
ゲノム編集技術の一つ。Single guide RNA(sgRNA)と呼ばれるゲノム上の目的配列に特異的に結合する短いRNAとそれを認識するDNA切断酵素Cas9を、細胞内に導入することで、目的のDNA配列に変異を引き起こす。
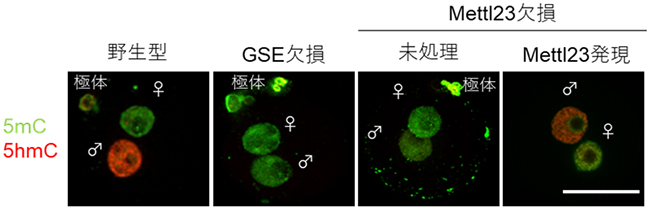
図1 マウス野生型とGSEおよびMettl23欠損受精卵の5mCおよび5hmCの免疫染色
DNAメチル化産物である5-メチルシトシン(5mC)とその脱メチル化過程の産物である5-ヒドロキシメチルシトシン(5hmC)の免疫染色像。マウス受精卵は、受精後数時間で、精子ゲノム由来の雄性前核(♂)と卵子ゲノム由来の雌性前核(♀)を形成する。野生型の受精卵では、雄性前核特異的に5mCの減少と5hmCの増加が観察されるのに対し、GSEおよびMettl23欠損(未処理)ではこの蓄積量の変化が認められない。一方で、Mettl23欠損した受精卵にMettl23を発現させると、野生型と同じくDNA脱メチル化過程が観察された。スケールバーは50µm(1μmは1,000分の1mm)。
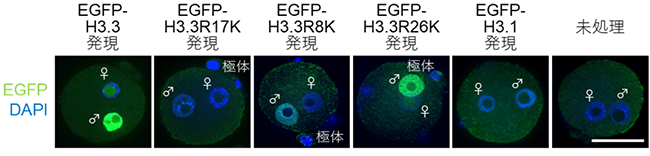
図2 マウス受精卵における各ヒストンH3.3変異体の精子ゲノムへの取り込み
それぞれのヒストンH3に緑色蛍光タンパク質(EGFP)を付加することで、その取り込みを蛍光観察により確認した。受精後精子ゲノムにおいて取り込まれる主なヒストンH3はH3.3変異体であるため、他の変異体であるH3.1は取り込まれない(右から2番目)。野生型H3.3(左端)や他の変異体(左から3番目と4番目)と比べて、H3.3R17K変異体はほとんど精子ゲノムへ取り込まれない(左から2番目)。スケールバーは50µm。
