理化学研究所(理研)光量子工学研究センター画像情報処理研究チームの大山慎太郎客員研究員、辻村有紀テクニカルスタッフⅠ、横田秀夫チームリーダー、技術基盤支援チームの山澤建二副チームリーダー、株式会社リコーの渡邉政樹スペシャリストの共同研究グループ※は、患者の骨の内部を含む欠損部位の形状を再現した「人工骨」を「3Dプリンター[1]」技術により製造する手法を開発しました。 本研究成果は、骨に関わる疾患の早期治療や患者の生活の質(QOL)向上に貢献すると期待できます。
今回、共同研究グループは、BJ(Binder Jetting)方式[2]をベースに、α-リン酸三カルシウム[3]の粉末に対してエチドロン酸などの新しい凝固インクを用いた粉末積層装置により、人工骨の3次元造形手法を開発しました。本手法は、3Dプリントしてすぐに使え、高強度で高い骨置換性[4]を持つ3次元造形人工骨を造形することができます。作製した人工骨の生体適合性を、培養環境下での培養細胞の増殖率と動物への移植実験の組織観察により調べたところ、良好な細胞の増殖率に加えて、速やかに本来の骨組織に入れ替わることを確認しました。これは、骨本来が持つリモデリング機能を阻害しない良好な人工骨であることを示しています。
本研究は、米国アトランタで開催されるSociety For Biomaterials’ 2018 Annual Meetingにおいて研究成果の発表(4月11日および13日付け:日本時間4月12日および14日)を行います。
背景
整形外科手術や頭頚部手術などにおいて、欠損骨への治療には「人工骨」が頻用されています。現在、ブロックや顆粒、セメントなどさまざまなタイプの人工骨が市販されています。顆粒型は骨置換性に優れていますが、強度は低く、逆にセメントは骨置換性で劣りますが、変形が自由で、安定化後の強度は高いという特徴があります。人工骨は、疾患部位によって使い分ける必要があります。近年、手関節や手指、足根骨部などの部位に使用できる精密な形状と高い強度を両立する「3Dプリンター」による人工骨造形が注目を集めています。
これまで、3Dプリンターを用いて造形された医療デバイスの臨床応用例として、レーザーや電子ビームを用いたPBF(Powder Bed Fusion)方式[5]で造形された人工関節や人工骨などがあります。これらは、長期にわたって構造材料としての力学的安全性を担保する必要があるため、主に純チタン(Ti)やTi-6Al-4V(Al:アルミニウム、V:バナジウム)などのチタン合金が用いられており、欧米では既に整形外科や口腔外科などの分野で実用化されています。しかし、これらの材料は骨置換性がなく、生涯にわたって体の中に残存するため、長期的な視点で金属アレルギーなどの副作用が懸念されていました。
理研は2003年に、3DプリンターによるBJ(Binder Jetting)方式で、リン酸カルシウム系粉末材料を用いた人工骨の造形に成功しました(図1)注1)。本手法では、自家骨との間での生体親和性の向上が期待されることから、顎顔面補綴分野などでの展開が考えられています。しかし、この人工骨を作製するためには、所望形状を作製後、力学的強度を向上させるために、一定時間水和反応を行なう後処理工程が必須です。また、作製された人工骨の最小孔径は2mm程度で、力学的強度もあまり高くなく、骨置換性も乏しいといった課題がありました。
注1)山澤建二,横田秀夫他,粉末積層造形法を用いた人工骨成形法の提案‐成形性の検討‐,生体医工学 45(2),169 - 176,2007.
研究手法と成果
共同研究チームは、目的とする造形物の形状データをもとに、BJ方式をベースに、インクジェットヘッドや材料を改良することで、3Dプリントしてすぐに使え、高強度で骨置換性を持つ3次元造形人工骨の造形に挑戦しました。このBJ方式では、α-リン酸三カルシウム(α-CTP)の粉末層を作製した後、キレート剤[6]のエチドロン酸などの各種材料が調合された凝固インクを、リコー製の試作機を用いて粉末層上に塗布することで造形します(図2)。
粉末積層装置の試作機には、α-TCP粉末で満たされた二つの粉末槽(粉末供給層と造形層)が設置されています。粉末供給層からリコーター(粉末を造形層へ均一に敷き詰める装置)により、造形層にα-TCP粉末が供給され、造形層側に凝固インクを塗布し硬化させることで、造形物を得ます。それぞれの粉末槽は互いに独立に昇降することができ、今回の人工骨では、一層あたり150マイクロメートル(1μm、1μmは1,000分の1mm)で積層しました(図3)。
また、α-CTPは、エチドロン酸とキレート反応[6]により硬化しているため、凝固インク塗布後は数秒で十分に硬化し、相対密度[7]が60%でありながら圧縮強度として、自家骨と同等レベルの強度25~30メガパスカル(MPa、1MPaは100万パスカル)を実現しました(図4)。
さらに、プロセス条件を調整することにより、細胞が好適に侵入することが可能な200μm程度の穴を空けることや、さまざまな形状での造形も実現しました(図5)。
また、作製した造形物は、数分程度水洗するだけで細胞が増殖できる状態となり、焼成も必要としないことから、高いスループット(単位時間あたりの処理能力)の実現が期待できます。次に、製造した人工骨の生体適合性を培養環境下と動物に移植した実験により解析をしました。
まず、培養環境下にて人工骨上での培養細胞の増殖を観察しました。人工骨上に蛍光標識した細胞をまき、通常の培養環境下で培養し、増殖の様子を観察しました(図6)。その結果、人工骨上でも細胞の増殖が観察され、安全性に問題ないことが確認できました。
次に、人工骨を動物に移植して安全性と骨組織との関係を調べました。ラット大腿骨顆部に外側から直径2.2mmの孔を開け、直径2mmに造形したαTCP 3D人工骨柱(新造形法:BJ柱)とαTCPセメント(既存の方法:製品名「バイオペックス®」)円柱(CE柱)を左右に埋入して、1週間後、2週間後、4週間後に摘出して病理組織標本を作製し、骨吸収や置換の進行、異物反応や有害事象を検討しました(図7)。 その結果、BJ柱では海綿骨[8]における破骨細胞[8]と骨芽細胞[8]の侵入が1週間でみられたのに対し、CE柱は4週間でも同じ形態を維持しており、周辺組織の進入がみられませんでした。皮質骨の癒合はいずれも4週間で完成しており、異物反応などの有害事象はいずれにおいてもみられませんでした。このことから、新たに開発した手法で製造した人工骨は、速やかに本来の骨組織に入れ替わることが分かりました。
今後の期待
これまで、骨欠損部が複雑な疾患に対する正確な再建や、術後早期に骨負荷をかける場所の治療は困難であり、セメント人工骨などを術者の手で造形して再建したり、形状を似せる形で自家骨を用い再形成したりする手術には、大きな困難を伴っていました。
本手法は、骨の内部まで含む3次元構造を設計し、高い精度で3次元造形することができます。骨はそれ自体が受ける外力により、不要な部分の骨が消失し、必要な骨を作るリモデリングにより、その環境に適応した形状に変化することが知られています。新しい造形法は骨のリモデリングに適応した人工骨の製造法といえます。また、任意の3次元形状を造形できることから、骨の内部にある骨髄の移動を妨げることが少なく、内部を支える骨梁を反映した人工骨は欠損する前の骨の形状を再現できることから、骨の持つリモデリング機能をいち早く回復することができます。
本手法は患者一人一人異なる形状に合わせた、複雑な形状の人工骨造形などを可能とするオーダーメード医療のための3Dプリンターとしての展開が期待できます。
原論文情報
発表1(4月11日付け:日本時間4月12日):Masaki Watanabe(1), Yuki Tsujimura(2), Shintaro Oyama(2,3), Kenji Yamazawa(2), Hideo Yokota(2), "Development of new binder jetting process for fabricating bone regeneration implants", 1.RICOH company Ltd. 2.RIKEN RAP 3.Nagoya University
発表2(4月13日付け:日本時間4月14日):Shintaro Oyama1,2, Masaki Watanabe3, Yuki Tsujimura1, Kenji Yamazawa1, Hideo Yokota1, "In Vivo Study of Stable Alpha-TCP Scaffolds Fabricated by Modified Binder Jetting", 1. RIKEN Center for Advanced Photonics; 2. Nagoya University Department of Hand Surgery; 3. Ricoh Company Ltd.
学会名称:Society For Biomaterials’ 2018 Annual Meeting
発表者
理化学研究所
光量子工学研究センター 画像情報処理研究チーム
客員研究員 大山 慎太郎(おおやま しんたろう)
(名古屋大学 医学部 附属病院 助教)
テクニカルスタッフⅠ 辻村 有紀(つじむら ゆき)
チームリーダー 横田 秀夫(よこた ひでお)
光量子工学研究センター 技術基盤支援チーム
副チームリーダー 山澤 建二(やまざわ けんじ)
株式会社リコー 研究開発本部 APT研究所 材料技術開発センター
AMS開発室 AMS開発三グループ
スペシャリスト 渡邉 政樹(わたなべ まさき)
 左から渡邉(リコー)、横田、山澤、辻村、大山(理研)
左から渡邉(リコー)、横田、山澤、辻村、大山(理研)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
株式会社リコー 広報室
Tel: 050-3814-2806
Email:koho[at]ricoh.co.jp
※上記の[at]は@に置き換えてください。
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.3Dプリンター
設計データをもとにして、特定の材料の2次元の層を自動的に1層ずつ積み重ねていくことによって、所望の立体形状を造形する装置。 - 2.BJ(Binder Jetting)方式
粉末材料にインクジェット装置により結合剤を塗布し、固着させ積層する原理の3Dプリンター。 - 3.α-リン酸三カルシウム
化学式:Ca3(PO4)2で表されるリン酸とカルシウムの塩。αは単斜晶系のリン酸カルシウムであり、六方晶系のβに比べて、可溶性と生分解性が優れている。 - 4.骨置換性
材料の生体骨への置換が促される性質を持つこと。材料は、骨誘導能や伝導能を持ち、骨原性細胞の遊走・分化・増殖を助ける働きを持つ。 - 5.PBF(Powder Bed Fusion)方式
粉末材料をレーザーや電子ビームなどの熱源を使って、選択的に溶融固化させ積層する原理の3Dプリンター。 - 6.キレート剤、キレート反応
キレート反応とは、他座配位子が環を形成して、中心金属と結合する化学反応のこと。キレート剤は、キレート反応を起こす多座配位子を持つ化合物。 - 7.相対密度
本研究においては、造形物中が粉末で完全に詰められていた場合を真密度(100%)としたときの空間占有率を意味する。 - 8.海綿骨、破骨細胞、骨芽細胞
海綿骨とは、緻密骨である皮質に囲まれた海綿状の骨構造のこと。骨再構築(リモデリング)が行われている。破骨細胞とは、骨再構築に関わる細胞で、骨の吸収を担当する造血幹細胞に由来する多核巨細胞のこと。骨芽細胞とは、骨再構築に関わる細胞で、骨の新生及び再生を担当する間葉系幹細胞に由来する細胞のこと。
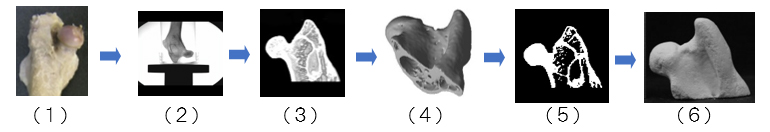
図1 生体形状の3D造形(BJ方式)による作製例
生体形状から3D造形までのおもなプロセス(BJ法)。(1)生体形状(家兎大腿骨骨頭関節)、(2)X線CT装置による撮影、(3)断層画像の再構築、(4)3Dデータ出力(ポリゴン化)、(5)断面データ化(ビットマップ)、(6)3D造形物の完成。
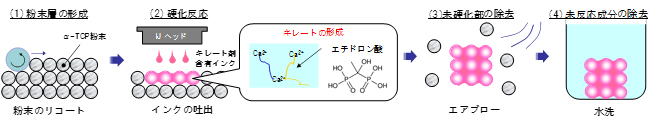
図2 3次元積層造形プロセスの概要
α-リン酸三カルシウム(α-TCF)粉末層の形成から造形物を得るまでのプロセス。(1)リコートにより粉末層を形成する。(2)粉末層上にインクジェットヘッドから、エチドロン酸(キレート剤)を含む凝固インクを吐出する。すると、α-TCFはエチドロン酸とキレート反応により硬化する。(3)硬化しなかった粉末をエアーブローで取り除く。(4)キレート反応が起こらなかった部分を水洗によって除去する。
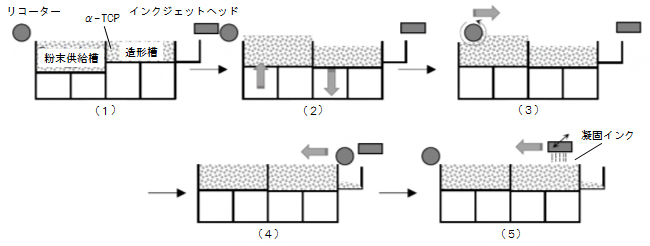
図3 粉末積層造形の原理
粉末積層装置のシーケンス。(1)粉末槽へα-リン酸三カルシウム(α-CTP)粉末を充填する。(2)粉末供給槽が上昇、造形槽が下降する。(3)リコーターを動かすことで、粉末供給槽の粉末を造形槽へ移送する。(4)リコーターを元の位置に戻す。(5)インクジェットヘッドから凝固インクを吐出する。
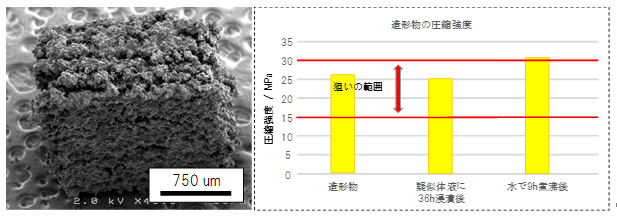
図4 3次元積層造形物の走査型電子顕微鏡写真と圧縮強度
(左)造形物の走査型電子顕微鏡写真、(右)造形物の圧縮強度の実験結果。作製した造形物は自家骨と同等レベルの強度を持ち、疑似体液への浸漬や煮沸による強度劣化もみられなかった。

図5 3次元積層造形物のさまざまな形状
(左)造形物中の孔の走査型電子顕微鏡写真、(右)さまざまな造形物の外観。精密で自由な造形を実現した。
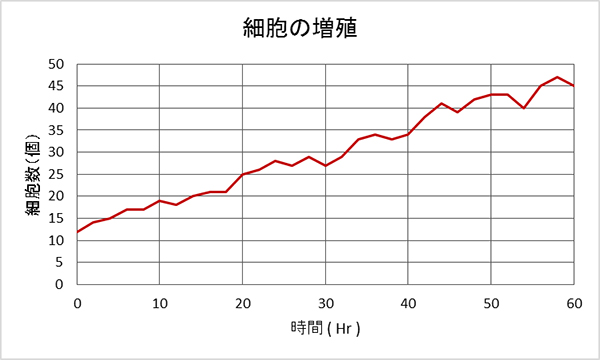
図6 人工骨上での細胞の増殖
人工骨上で蛍光標識した細胞を通常の培養環境下にて培養したところ、細胞が増殖していく様子を確認できた。
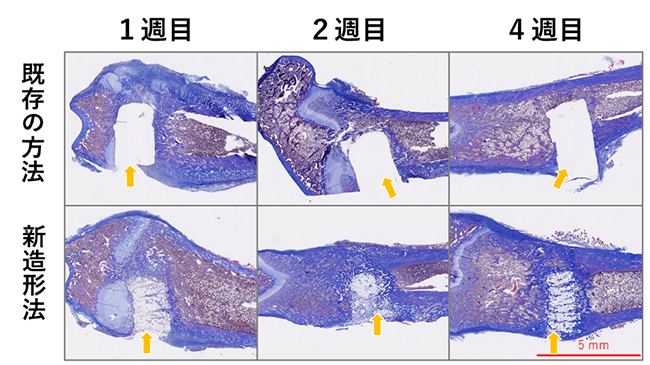
図7 ラット大腿骨における既存方法と新造形法材料の比較
マッソントリクローム染色による組織観察。既存の方法では人工骨の置換がみられないが、新造形法では組織に置換していることが分かる。
